
Лекции по биофизике
.pdf
25,2 12,6 33,6 35,28 36,12
кДж/моль.
В разных точках протон испытывает различные воздействия со стороны электроотрицательных атомов – имеется 2 минимума.
III. Гидрофобные взаимодействия с энергией 4-8,5 к Дж/моль.
Основано на силах отталкивания воды гидрофобными (неполярными) молекулами. Более корректно их можно определить, основываясь на термодинамике.
Вода представляет собой довольно сложную структуру, ассиметрична и имеет большой дипольный момент (~1,82 дебая (Д)).
Тетраэдрическая структура полностью координированной воды
Молекулы воды ассоциированны с координаторным числом 4, то есть атомы кислорода четырѐх молекул образуют тетраэдр, в центре которого атом кислорода пятой молекулы. Структура жидкой воды до конца не ясна. Существуют две группы гипотез:
1. Модель непрерывной структуры воды
Вода представляет собой непрерывную структуру, связанная водородными связями, и при изменении температуры, давления и других факторов они лишь растягиваются и деформируются. Но по расчѐтам, тогда при t=25 С =1,8 г/см3 (а не 1,0).
2. Модели мерцающих кластеров. Франк, Уэн (1957)
Водородные связи формируют короткоживущие (10-10 - 10-11 сек) кластеры, размер которых зависит от температуры. При t=20 С в кластеры входит 29,5% молекул воды.
Вода как полярная молекула может конкурировать с другими полярными молекулами за места образования водородных связей. Но неполярное вещество, попав в водную среду, будет подчиняться другим
закономерностям, описанным Каузманом. |
|
Если помните, свободная энергия |
G= H-T S. При растворении |
неполярных веществ G увеличится, |
но Н почти не изменится, |
следовательно, S<0.
Понижение энтропии связано с изменением структуры воды. Вблизи неполярных участков снижается конкуренция за водородные связи, следовательно, повышается вероятность формирования упорядоченных кластеров.
Согласно второму началу термодинамики в неравновесной области система стремится увеличить энтропию. Для этого есть один путь – неполярным молекулам в растворе «установить контакты», вытеснив воду и тем самым разрушить кластеры и снизить упорядоченность системы.
Исходя из этого, была количественно оценена гидрофобность аминокислот в белках. Мерой гидрофобности служит G при переносе их из 100% этанола в воду:
61
Try |
G=14 к Дж/моль, |
Phe |
G=10,5 к Дж/моль, |
Ala |
G=2,1 к Дж/моль, |
Ser |
G=1,25 к Дж/моль. |
Ala и Ser – гидрофильные остатки.
Пространственная структура белка
Первичная структура белка – последовательность аминокислот (АК). Пептидная связь между аминокислотами (Рис. 5) отличается от обычной ковалентной связи перераспределением электронной плотности и, потому, является жѐсткой и вокруг неѐ вращение затруднено. Расстояния в ней соответствуют:
C –N-0,132 нм
N – C -0,147 нм С – С -0,153 нм
Рис. 5. Пептидная связь между
аминокислотами
Зато оно возможно вокруг связей С – С (угол ) и N – C
(угол ) и N – C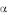 (угол ), за счѐт чего и возникают конформации белковых молекул. Число возможных конформаций ограничено, так как согласно расчѐтам Рамачандрана и
(угол ), за счѐт чего и возникают конформации белковых молекул. Число возможных конформаций ограничено, так как согласно расчѐтам Рамачандрана и  могут принимать лишь определѐнные значения. Конформации стабилизируются слабыми взаимодействиями между пептидными группами (вторичная структура) и боковыми остатками АК (третичная структура).
могут принимать лишь определѐнные значения. Конформации стабилизируются слабыми взаимодействиями между пептидными группами (вторичная структура) и боковыми остатками АК (третичная структура).
Вторичная структура – упорядоченное расположение полипептидной цепи, стабилизированное водородными связями между пептидными группами.
Чаще всего встречается и наиболее термодинамически выгодна правая -спираль, постулированная Поллингом и Кори (Рис. 6).
1.на один шаг спирали – 3,6 остатка,
2.шаг спирали d = 0,54 нм,
3. трансляция на 1 остаток вдоль спирали d = 0,15 нм,
4.радиус спирали r = 0,23 нм,
5.водородные связи параллельны оси спирали и образуются между 1 – 4 аминокислотными остатками,
6.= -57 , = -47 .
Но возможны и другие виды спиралей. Она обнаруживается в отдельных участках белка, r = 0,19 нм, то есть она более скручена. На 1шаг три АК,
62

водородные связи между 1 –10 АК. Это 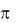 – спираль. Она теоретически рассчитана, но пока не обнаружена в белках, r = 0,28 нм, длина шага 4, 4 АМК.
– спираль. Она теоретически рассчитана, но пока не обнаружена в белках, r = 0,28 нм, длина шага 4, 4 АМК.
Рис. 6.
Вторичная структура белка
Слева – α-спираль Справа – β-склад- чатая структура
Другой тип вторичных структур: |
– складчатые структуры. |
||
Водородные связи расположены параллельно оси спирали. Они могут |
|||
быть параллельными – = +1130 , |
= -119 и антипараллельными – = |
||
+113 , = -119 , имеют фиксированные значения |
и |
, включают до 6 |
|
белковых цепей, состоящих из 6 остатков, размеры |
– |
складчатого листа |
|
22,5 нм. Они могут быть скручены перпендикулярно цепям.
Внекоторых случаях выделяют сверхвторичные структуры –
суперспирали (например миозин – 2 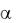 – спирали и фибриноген – 3
– спирали и фибриноген – 3 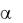 – спирали), скрученные относительно друг друга. К третичным структурам их отнести нельзя, так как связи опять же между пептидными группами. Сюда
– спирали), скрученные относительно друг друга. К третичным структурам их отнести нельзя, так как связи опять же между пептидными группами. Сюда
же относятся структуры типа 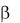 или
или 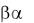 .
.
Третичная структура белка – конформации, стабилизированные слабыми связями между боковыми остатками АК. В основном это Ван–дер– Ваальсовы и электростатические взаимодействия. Переход в растворе от неупорядоченного клубка в наиболее удобную упаковку третичной структуры происходит от 10-6 до 10 сек у разных белков. Сегменты белка образуют  – спирали и - структуры, которые затем укладываются в глобулы – домены. Домены относительно автономны, могут самостоятельно раскручиваться и, как правило, являются носителями определѐнных функций.
– спирали и - структуры, которые затем укладываются в глобулы – домены. Домены относительно автономны, могут самостоятельно раскручиваться и, как правило, являются носителями определѐнных функций.
Четвертичная структура белка
Наиболее сложные белки, особенно ферменты, имеют ещѐ более высокую структурную организацию, включающую несколько белковых глобул, объединѐнных гидрофобными взаимодействиями.
63
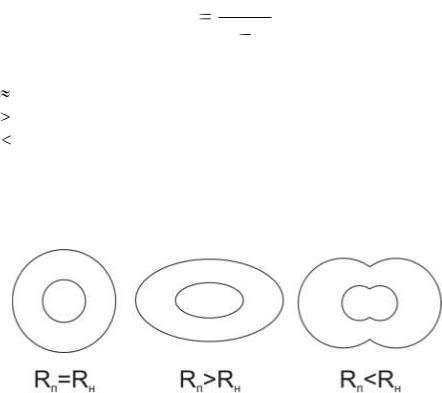
Согласно модели Бреслера–Тилмуда.
3d
вS r0 d ,
где в – отношение числа полярных остатков к неполярным остаткам, если в вs – то глобула в растворе будет сферической формы,
если в вs – то глобула в растворе будет эллипсоидной формы.
если в вs, то неполярные структуры не могут быть полностью закрыты полярными и тогда и образуются олигомерные структуры, стабилизированы гидрофобными взаимодействиями.
Рис. 7. Виды четвертичной структуры белка согласно отношению числа
полярных остатков (Rп) к неполярным остаткам (Rн)
Тест–задания
1.Предметом исследования молекулярной биофизики является:
A.Молекулярный состав биомакромолекул
B.Пространственная организация биомакромолекул
C.Химические реакции с участием биомакромолекул
2.К сильным взаимодействиям относятся:
A.Ковалентные связи
B.Водородные связи
C.Ван-дер-Ваальсовы взаимодействия
D.Гидрофобные взаимодействия
3.К слабым взаимодействиям относятся:
A.Ковалентные связи
B.Водородные связи
C.Ван-дер-Ваальсовы взаимодействия
D.Гидрофобные взаимодействия
4.Ориентационные взаимодействия возможны в том случае, если:
A.Обе молекулы обладают постоянным дипольным моментом
B.Одна из молекул обладает постоянным дипольным моментом
C.Ни одна из молекул не обладает постоянным дипольным моментом
5.Индукционные взаимодействия возможны в том случае, если:
64
A.Обе молекулы обладают постоянным дипольным моментом
B.Одна из молекул обладает постоянным дипольным моментом
C.Ни одна из молекул не обладает постоянным дипольным моментом
6.Дисперсионные взаимодействия возможны в том случае, если:
A.Обе молекулы обладают постоянным дипольным моментом
B.Одна из молекул обладает постоянным дипольным моментом
C.Ни одна из молекул не обладает постоянным дипольным моментом
7.Ван-дерВаальсовы взаимодействия являются:
A.взаимодействиями электрических зарядов
B.взаимодействиями электрических диполей
C.гидрофобными взаимодействиями
8.Водородные связи имеют природу:
A.Диполь-дипольных взаимодействий
B.Заряд-дипольных взаимодействий
C.Заряд-зарядных взаимодействий
9.Водородные связи образуются между атомом водорода и:
A.Кислорода
B.Азота
C.Углерода
D.Фтора
E.Железа
10.Природа гидрофобных взаимодействий связана:
A.С взаимным притяжением неполярных групп
B.С отталкиванием полярных и неполярных групп
C.С отталкиванием молекул воды неполярными группами
11.Молекула воды является:
A.Неполярным соединением
B.Сильнополярным соединением
C.Амфифильным соединением
12.Молекулы воды связанны друг с другом:
A.Электростатическими взаимодействиями
B.Водородными связями
C.Гидрофобными связями
13.Мерой гидрофобности аминокислот служит:
A.Изменение свободной энергии при переносе из спирта в воду
B.Изменение энтропии при переносе из спирта в воду
C.Изменение свободной энергии при переносе из масла в воду
14.Гидрофобные взаимодействия возможны при следующих условиях:
A.полярный растворитель
B.амфифильность растворенных веществ
C.неполярный растворитель
15.Что такое Дебаевский радиус макромолекулы:
A.Радиус глобулы в полярном растворителе
B.Расстояние, на котором заряд уменьшается в 0,37 раз
C.Минимальное расстояние, на которое могут сблизится молекулы
16.Вискозимитрическим методом можно оценить:
A.Форму макромолекул
65
B.Размеры макромолекул
C.Заряд макромолекул
17.Метод квазиупругого рассеяния света для исследования макромолекул основан:
A.На изменении длинны волны рассеянного света
B.На изменении направления рассеянного света
C.На изменении интенсивности рассеянного света
18.Седиментационный метод позволяет определить:
A.Форму макромолекул
B.Заряд макромолекул
C.Массу макромолекул
19.Метод дифференциальной сканирующей микрокалориметрии позволяет оценить:
A.Кооперативность структурных перестроек в глобуле
B.Размер глобулы
C.Электрический заряд глобулы
20.Метод рентгеноструктурного анализа основан на явлении:
A.Поглощения рентгеновского излучения
B.Дифракции рентгеновских лучей
C.Рассеяния рентгеновских лучей
Правильные варианты ответов:
1. |
B |
8. |
B |
15. |
B |
2. |
A |
9. |
A, B, D |
16. |
A, B |
3. |
B, C, D |
10. |
C |
17. |
A |
4. |
A |
11. |
B |
18. |
B |
5. |
B |
12. |
B |
19. |
A |
6. |
C |
13. |
A |
20. |
B |
7. |
B |
14. |
A, B |
|
|
66

V. СТРУКТУРА И ФУНКЦИИ БИОМЕМБРАН
Введение
Еще в 30-х годах ХХ века наличие дифференцированной мембранной структуры на поверхности клеток представлялось далеко не бесспорным. Прямые морфологические доказательства наличия мембраны были немногочисленны или отсутствовали. Первые указания на свойства клеточной поверхности, лимитирующей диффузию красителя внутрь клетки, сделал в середине XIX века К. В. Нагели. Он также показал, что клетки проявляют осмотические свойства: набухают в разбавленных растворах и сжимаются в концентрированных. Морфологические данные о существовании клеточной мембраны были получены только после разработки методов приготовления ультратонких срезов тканей.
В настоящее время не вызывает сомнений, что биологические мембраны образуют наружную оболочку всех живых клеток, а также участвуют в формировании многочисленных внутриклеточных органелл.
Мембраны выполняют многочисленные функции, обеспечивая целостность клеток и тканей и их активность.
Функции биологических мембран
Основные функции (выполняются всеми без исключения мембранами):
1.Компартментализация – участие мембран в образовании изолированных отсеков (компартментов). Мембраны всегда образуют замкнутые структуры, самая крупная из них – цитоплазматическая мембрана.
2.Барьерная функция – препятствие свободной диффузии различных веществ. В результате мембрана регулирует перенос веществ и их содержание в клеточных и субклеточных компартментах.
3.Рецепторная (сигнальная) функция – связывание мембранными рецепторами внеклеточных эффекторов – биологически (физиологически) активных веществ, что приводит к изменению активности регуляторных белков клетки.
4.Ферментативная функция обеспечивается мембранно-связанными белками-ферментами, которые образуют своеобразные конвейеры.
5.Факультативные функции, присущие не всем мембранам:
 Транспорт электронов и фосфорилирование в дыхательной цепи (способны выполнять мембраны митохондрий, хлоропластов). Преобразование внешних стимулов в электрические импульсы. Проведение биоэлектрических импульсов (характерны для мембран электровозбудимых клеток: нервной и мышечной ткани).
Транспорт электронов и фосфорилирование в дыхательной цепи (способны выполнять мембраны митохондрий, хлоропластов). Преобразование внешних стимулов в электрические импульсы. Проведение биоэлектрических импульсов (характерны для мембран электровозбудимых клеток: нервной и мышечной ткани).
 Высвобождение синаптических нейромедиаторов и пиноцитоз.
Высвобождение синаптических нейромедиаторов и пиноцитоз.
67

Химический состав мембран
Исследования показали, что основными химическими компонентами мембран являются липиды ( 30%), белки ( 60%) и углеводы ( 10%). Минорными компонентами мембран являются нуклеиновые кислоты, полиамины, неорганические ионы.
Липиды, входящие в состав мембран, принадлежат к трем классам. Это
фосфолипиды, гликолипиды и стероиды.
Фосфолипиды построены по единому плану, их молекула имеет полярную головку и два неполярных хвоста.
В состав головки фосфолипида обязательно входят: А) остаток спирта (реже аминокислоты); Б) остаток фосфорной кислоты; В) по вариантам, либо:
-глицерин (глицерофосфолипиды),
-многоатомный спирт сфингозин (сфингофосфолипиды).
Неполярные хвосты всех молекул фосфолипидов образуются жирными кислотами, определяющими разнообразие их представительства.
Глицерофосфолипиды мембран растительных клеток содержат в
основном пальмитиновую (С16:1(9)), олеиновую (С18:1(9)), линолевую (С18:2(9,12)) жирные кислоты. Жирные кислоты с количеством атомов углерода более 20
– 24 в растительных клетках встречаются редко.
Глицерофосфолипиды мембран животных клеток содержат пальмитиновую, олеиновую, стеариновую (С18:0) жирные кислоты, а также кислоты (арахидоновая и др.) с числом атомов углерода, превышающим 20.
Обычно из двух жирных кислот, образующих гидрофобный хвост глицерофосфолипида, одна ненасыщенная. Она образует связь со вторым атомом углерода глицерина и одна из ее двойных связей обязательно находится на уровне 9 атома углерода, считая от головки.
Остаток спирта (аминокислоты) головки глицерофосфолипида связан сложноэфирной связью с фосфорной кислотой. Глицерофосфолипид, лишенный спирта (аминокислоты), называется фосфатидной кислотой, которая является промежуточным продуктом в биосинтезе фосфолипидов и в свободном виде практически не встречается.
В зависимости от того, какой именно спирт (аминокислота) входит в состав головки молекулы, различают несколько классов глицерофосфолипидов. Самые распространенные:
фосфатидилхолин, содержащий спирт холин; фосфатидилэтаноламин, содержащий спирт этаноламин; фосфатидилинозитол, содержащий циклический спирт инозитол; фосфатидилсерин, содержащий остаток гидроксиаминокислоты – серина.
Примерами сфингофосфолипидов могут служить сфингомиелины, которые в составе полярной головки содержат фосфохолин или фосфоэтаноламин. В составе сфингофосфолипидов одна жирная кислота.
68
Роль второго неполярного хвоста выполняют углеродные структуры многоатомного спирта сфингозина.
Таким образом, фосфолипиды содержат группировки двух видов – полярные гидрофильные головки и неполярные гидрофобные хвосты. Вследствие этого фосфолипиды обладают амфипатическими свойствами. При рН = 7 остаток фосфорной кислоты в полярной головке заряжен отрицательно.
Гликолипиды – липиды, содержащие 2 остатка жирных кислот, спирт сфингозин и остатки моно- (цереброзиды) или олигосахаров (ганглиозиды).
Стероиды содержат стероидное ядро, образованное тремя гексагональными полностью насыщенными кольцами и одним циклопентановым кольцом. Стероиды представлены в основном холестерином (в животных клетках) или ситостерином и стигмастерином (в растительных клетках).
Физиологическая роль различных классов липидов
Фосфолипиды выполняют структурную функцию, образуя липидный бислой мембраны. Кроме этого, они могут выполнять и важные физиологические функции. Так, арахидоновая кислота, состоящая из цепи с 20 атомами углерода и с 4 двойными связями, входящая в состав фосфолипидов, служит предшественником таких биологически активных веществ, как простагландины.
Гликолипиды широко представлены в различных тканях, в частности, в нервной. Они локализованы преимущественно на наружной поверхности цитоплазматической мембраны, где их углеводные компоненты входят в число других углеводов клеточной поверхности. Ганглиозиды участвуют в дифференцировке нейрональной ткани. Ганглиозиды других клеток определяют видоспецифичность и регулируют межклеточные контакты. В иммуннокомпетентных клетках они участвуют в формировании иммунной реакции. Холестерин выполняет важную роль в модификации бислоя: он, в частности, регулирует упаковку и подвижность фосфолипидов мембраны. Кроме того, холестерин служит предшественником в образовании половых гормонов, гормонов коры надпочечников, а также желчных кислот.
Липид–липидные взаимодействия. Динамика липидов в мембране
Длина растянутой углеводородной цепи жирной кислоты, состоящей из 18 атомов углерода, составляет 2 нм, на полярную головку приходится еще 0,5 – 0,7 нм, следовательно, толщина бислоя липидов должна превышать 4 нм, но в действительности толщина двойного слоя липидов оказывается равной 3,5 – 4 нм. Причиной обнаруженного феномена является рыхлое, а не упорядоченное расположения остатков жирных кислот. Раз одна из двух жирных кислот, образующих гидрофобный хвост, ненасыщенная, как правило, увеличивается вероятность образования цис-конформации.
Наличие цис-изомеров жирных кислот в составе фосфолипидов, а также высокая скорость вращения вокруг С-С связей жирно-кислотных радикалов
69
(например, частота вращения вокруг единичной С–С связи составляет 1010, а вокруг двойной С=С связи – 108 с-1) обеспечивают неупорядоченное расположение гидрофобных хвостов. Различные конфигурации молекул жирных кислот, возникающие при поворотах вокруг С-С связей, называют ротамерами или конформерами. Процесс изменения конформации молекул за счет таких поворотов называется транс-гош-изомеризацией. Гошконформация (―гош‖ – скошенный) аналогична цис-конформации. Вероятность транс-гош-перехода весьма велика и еще более возрастает при увеличении температуры. При переходе из транс- в гош-конформацию образуются складки или кинки (от англ. kink – петля). Такого рода изменения способны захватывать целые кластеры мембранных липидов. Считается, что именно с образованием кинков связан транспорт воды и других веществ через мембраны.
Липиды способны совершать вращательные движения вокруг оси молекулы (вращательная диффузия), перемещаться вдоль одного слоя (латеральная диффузия), а также перемещаться из одного слоя в другой (трансмембранный переход или флип-флоп). Наибольшую скорость имеют вращательная и латеральная диффузия. Например, коэффициент латеральной диффузии составляет 1,8×10-8 см2 с-1. Это соответствует частоте парных перестановок соседних молекул 107 с-1. Наиболее медленным процессом является флип-флоп, что связано с высоким уровнем энергии, необходимой для проталкивания заряженных полярных головок через средний углеводородный слой мембраны. Поперечная диффузия молекул фосфолипидов на расстояние 5 нм занимает в 109 раз больше времени, чем диффузия на то же расстояние в латеральном направлении.
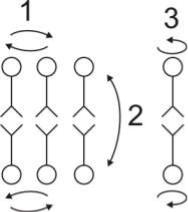
Рис. 8. Виды диффузии липидов в
мембране
1 – латеральная диффузия;
2 – трансмембранный переход или флип-флоп; 3 – вращательная диффузия.
Сочетание быстрой диффузии молекул липидов вдоль мембраны и медленной диффузии поперек мембраны имеет большое значение для функционирования мембран. Благодаря этому поддерживается упорядоченность в молекулярной структуре мембраны, определенная ориентация белков поперек мембраны, что имеет значение для направленного переноса веществ через мембрану, кроме того, обеспечивается асимметрия бислоя липидов. Функциональная асимметрия мембраны – один из важнейших аспектов, характеризующих липид –
70
