
Лекции по биофизике
.pdfA.Скорость поступления субстрата в систему постоянна
B.Скорость удаления продукта реакции из системы постоянна
C.Скорости поступления субстрата в систему и удаления продукта реакции из системы постоянны
16.Автоколебательный характер реакции возможен в том случае, если:
A.Убыль субстрата реакции постоянно восполняется
B.Продукт реакции постоянно удаляется из системы
C.Продукт реакции влияет на скорость реакции
17.Модель Лотки (1925) описывает:
A.Автоколебательный химический процесс
B.Периодические колебания в системе "хищник - жертва"
C.Колебания скоростьи синтеза белка в клетке
18.Модель Вольтерры (1930) описывает:
A.Автоколебательный химический процесс
B.Периодические колебания в системе "хищник - жертва"
C.Колебания скоростьи синтеза белка в клетке
19.Модель Гудвина (1966) описывает:
A.Автоколебательный химический процесс
B.Периодические колебания в системе "хищник - жертва"
C.Колебания скоростьи синтеза белка в клетке
20.Автоколебательный процесс может быть незатухающим:
A.в открытой системе
B.в закрытой системе
C.в любой системе
Правильные варианты ответов |
|
|
|
|
|
1. |
B |
8. |
A |
15. |
C |
2. |
C |
9. |
B |
16. |
C |
3. |
A |
10. |
A |
17. |
A |
4. |
A |
11. |
C |
18. |
B |
5. |
C |
12. |
B |
19. |
C |
6. |
A |
13. |
A |
20. |
B |
7. |
B |
14. |
C |
|
|
41

III. КВАНТОВАЯ БИОФИЗИКА
Классификация и стадии фотобиологических процессов
Квантовая биофизика изучает электронную структуру биомакромолекул (белков и нуклеиновых кислот), электронные переходы в этих молекулах и пути превращения энергии возбужденного состояния молекул и их продуктов.
Относительно изменения уровня свободной энергии (Е0) системы
фотобиологические процессы можно подразделить на:
1.Процесс повышения Е0, который происходит при фотосинтетических процессах (синтез биологических соединений под влиянием света, фотосинтез).
2.Информационные процессы, которые не связаны со значительным изменением Е0 (фотопериодизм, фототаксис, зрение животных).
3.Процесс понижения Е0 может вызывать:
а) повреждающее действие света Летальные реакции Мутации
Патофизиологические процессы (временное нарушение процессов жизнедеятельности).
б) физиологический процесс.
Природа света и его физические характеристики. Понятие кванта. Орбитальная структура атомов и молекул и энергетические уровни.
Свет имеет двойственную природу: с одной стороны свет – это поток
квантов, с другой стороны, свет имеет волновую природу. В связи с этим свет характеризуется частотой ( ) и длиной волны ( ), а также энергией кванта:
E h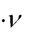
Чем выше частота света (а значит меньше длина волны), тем больше энергия кванта, так как их произведение дает скорость света (с):
c
.
Каждый электрон занимает в молекуле определенный энергетический уровень, характеризующийся определенной энергией. В невозбужденной молекуле электроны занимают уровни с наименьшей энергией. Это электронные уровни. На каждом заполненном уровне может находиться два электрона с противоположными (антипараллельными) спинами +1/2 и –1/2. Суммарный спиновый момент в этом случае равен 0. Такие уровни называют синглетными. Состояние молекулы, в которой электроны находятся на низших
синглетных уровнях в невозбужденном состоянии, называется основным.
42

Под воздействием света электроны могут переходить с основного синглетного на другой возбужденный синглетный уровень, с более высокой энергией. Такие переходы не сопровождаются изменением спина.
Рис. 3. Образование возбужденных энергетических уровней, характеризующихся определенной энергией.
1 – синглетного;
2 – триплетного.
Время жизни электрона в возбужденном синглетном состоянии очень мало и равно 10-8 - 10-9 с. Следует помнить, что электронный переход осуществляется при поглощении 1 кванта света.
Ряд молекул обладает так называемыми триплетными уровнями, на которых находятся неспаренные электроны, особенностью которых является проявление возможности однонаправленного спинового момента. Суммарный спиновый момент в этом случае может быть равен трем значениям: –1, 0 или +1.
Переход из основного синглетного состояния в триплетное запрещен, т.к.
этот переход должен сопровождаться обращением спина электрона, а для этого необходима энергия. На триплетный уровенье электрон попадает из
возбужденного синглетного состояния.
Время жизни электрона в триплетном состоянии на много дольше, чем в синглетном, и составляет: 10-4 - 10 сек.
Многоатомные макромолекулы кроме электронных энергетических уровней имеют вращательные и колебательные подуровни. Их существование и энергетические характеристики связаны с внутримолекулярными движениями, например, ядер атомов.
В зависимости от величины энергии состояния они представляют следующую последовательность: электронный > колебательный > вращательный уровни.
Взаимодействие света с веществом
Спектр поглощения Способность молекулы поглощать свет зависит от ее электронной конфигурации. При поглощении света происходит переход электронов в возбужденное состояние. Данным веществом поглощается свет определенной длины волны. Поглощательную способность вещества отражает
спектр поглощения.
43

Спектр поглощения представляет собой сумму индивидуальных полос поглощения, каждая из которых соответствует переходу между двумя электронными уровнями. Так как сложные молекулы обладают не только электронными, но и вращательными и колебательными подуровнями, их спектр поглощения представляет собой сплошную линию – зависимость интенсивности поглощения света от его длины волны.
Обычно спектр поглощения имеет вид кривой с одним или несколькими максимумами, которые отражают наибольшую способность поглощать свет именно этой длины волны и являющейся одной из главных спектральных характеристик.
Закон поглощения света Бугера – Ламберта – Бера
Мерой интенсивности поглощения служит оптическая плотность D. Эта величина вводится через закон поглощения Бугера – Ламберта – Бера: интенсивность поглощенного света (I0-I) уменьшается по экспоненциальному закону в зависимости от концентрации растворенного вещества (с) и длины оптического пути (l):
В дифференциальной форме изменение интенсивности равно: dI 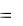 kIcdl Решение уравнения с учетом константы интегрирования I=I0 при l=0:
kIcdl Решение уравнения с учетом константы интегрирования I=I0 при l=0:
I I |
|
e kcl |
ln |
I0 |
k c l |
0 |
|
||||
|
или |
|
I |
||
|
|
|
|||
При переходе к десятичному логарифму:
D lg |
I0 |
c l |
|
|
I |
,где: |
|||
|
|
I0- интенсивность падающего света, I- интенсивность света, прошедшего через объект, k и -константы пропускания света веществом. Их соотношение друг с другом определяется тем, что:
2,303 ln lg и тогда: 2,303 k ln |
lg |
Закон Бугера – Ламберта – Бера выполняется при условиях:
Свет монохроматический –одной длины волны (частоты). Отсутствие взаимодействия между молекулами Беспорядочная ориентация молекул
Последние два условия выполняются в случае разбавленных растворов. Закон Бугера – Ламберта – Бера является основой для абсорбционной
спектрометрии, позволяющей определять количество (концентрацию) веществ, основываясь на линейной зависимости их содержания в растворе от степени поглощения – оптической плотности. Фотоэлектроколориметр и спектрофотометр – приборы абсорбционной спектрофотометрии. Последний отличает способность устанавливать постоянную волну возбуждающего света монохроматором.
44

Пути размена энергии возбужденного состояния молекулы
При поглощении кванта света молекула переходит в возбужденное состояние. Так как долго находиться в этом состоянии молекула не может, она возвращается в основное состояние. Энергия возбужденного состояния может тратиться (размениваться) на разные процессы при:
переходе в основное состояние с выделением энергии в виде тепла;
высвечивании квантов света: люминесценция (флюоресценция и фосфоресценция); миграции энергии; фотохимической реакции.
По своей сути все фотобиологические процессы – это пути размена энергии возбужденного состояния молекул.
Люминесценция (флюоресценция и фосфоресценция), ее механизмы, законы и методы исследования
Высвечивание кванта света при переходе с возбужденного состояния в основное называется люминесценцией. Она подразделяется на флюоресценцию и фосфоресценцию.
Флюоресценция – высвечивание кванта света при переходе с нижнего возбужденного синглетного состояния в основное. Переход с высшего возбужденного синглетного уровня на нижний синглетный возбужденный уровень сопровождается выделением тепла и называется внутренней конверсией.
Характеристики флюоресценции:
 Спектр флюоресценции: зависимость интенсивности флюоресценции от длины волны.
Спектр флюоресценции: зависимость интенсивности флюоресценции от длины волны.
 Квантовый выход флюоресценции: отношение числа квантов высветившихся к числу квантов поглощенных.
Квантовый выход флюоресценции: отношение числа квантов высветившихся к числу квантов поглощенных.
 Время жизни кванта флюоресценции 10-8 – 10-9 сек.
Время жизни кванта флюоресценции 10-8 – 10-9 сек.
Законы флюоресценции:
 Закон Стокса: спектр флюоресценции сдвинут в длинноволновую область по сравнению со спектром поглощения.
Закон Стокса: спектр флюоресценции сдвинут в длинноволновую область по сравнению со спектром поглощения.
 Правило Левшина: коротковолновая часть спектра флюоресценции симметрична длинноволновой области спектра поглощения.
Правило Левшина: коротковолновая часть спектра флюоресценции симметрична длинноволновой области спектра поглощения.
 Закон Вавилова: квантовый выход флюоресценции не зависит от длины волны возбуждающего света.
Закон Вавилова: квантовый выход флюоресценции не зависит от длины волны возбуждающего света.
Методы изучения: флюорометрические исследования отличают от
спектрофотометрических необходимость применения особого светофильтра после объекта, не пропускающего длину волны возбуждающего света, но позволяющего регистрировать длину волны флюоресценции образца.
Фосфоресценция – высвечивание кванта света при переходе с триплетного уровня в основное состояние. Переход с высшего синглетного возбужденного
45

уровня на триплетный уровень сопровождается выделением тепла и называется
интеркомбинационной конверсией (Рис. 3).
Характеристики и законы фосфоресценции – те же, что и для
флюоресценции.
Рис. 4. Спектральные характеристики при поглощении света (1) и его люминесценции (2).
По оси абсцисс – длина волны По оси ординат – оптическая плотность.
Миграция энергии. Виды и условия миграции. Правила Ферстера
Миграция энергии – безизлучательный обмен энергией между возбужденной молекулой (донором) и молекулой в основном состоянии (акцептор) без кинетических соударений донора и акцептора и на расстояния, превышающие межатомные.
Виды миграции:
1.Индуктивно-резонансная миграция. Для этого необходимо, чтобы донор и акцептор имели одинаковые разности энергии между определенными энергетическими уровнями, взаимодействие должно быть достаточно интенсивным.
Выполняется при 3-х правилах Ферстера:
Донор должен обладать способностью к флюоресценции.
Длинноволновая часть спектра флюоресценции донора должен перекрываться с коротковолновой частью спектра поглощения акцептора.
 Донор и акцептор должны располагаться на определенном (не далее 2 нм) расстоянии друг от друга.
Донор и акцептор должны располагаться на определенном (не далее 2 нм) расстоянии друг от друга.
2.Обменно-резонансный тип миграции происходит в результате переноса энергии с триплетного уровня донора на триплетный уровень акцептора, происходит при перекрывании триплетных уровней на расстоянии 1-2 нм.
3.Полупроводниковая миграция энергии. Полупроводники характеризуются наличием валентной зоны, зоны проводимости, которые разделены
46

запрещенной зоной. Переход из валентной зоны в зону проводимости может произойти вследствие влияния кванта света (фотопроводимость).
4.Экситонная миграция наблюдается в кристаллах. Пара «электрон – дырка» называется экситоном. Переноса заряда нет.
Методы исследования миграции энергии основаны на том, что при этом процессе поглощает свет одно вещество, а люминесцирует - другое.
Сенсибилизированная люминесценция:
|
A h |
A* A* |
B A B* B* |
B* h |
|
|
погл |
; |
|
; |
фл |
Сенсибилизированная фотохимическая реакция: |
|
||||
A h |
A* A* B A B* B* |
C |
|
||
погл |
; |
|
; |
– фотохимическая реакция. |
|
Фотохимические реакции. Законы фотохимии
Фотохимическими реакциями называют реакции, идущие под действием света. В этом случае энергия поглощенного кванта трансформируется в энергию химической связи.
Виды фотохимических реакций: Фотоокисление (в фотосинтезе) Фотовосстановление
Фотоизомеризация (реакции превращения фотопигмента в палочках)
Фотодиссоциация |
|
|
|
Законы фотохимии: |
|
|
|
1. Гротгуса – Дрейпера: |
фотохимическое |
действие |
оказывает |
поглощенный свет. |
|
|
|
2.Эквивалентности: один квант вызывает один фотохимический акт.
3.Правило Бунзена – Роско: количество фотопродукта зависит от дозы облучения P=I t.
I1 t1 I2 t2 ...  Intn , то P1 P2 ...
Intn , то P1 P2 ...  Pn
Pn
Скорость фотохимических реакций пропорциональна количеству квантов, поглощенных в единицу времени:
dc dN
dt dt
Но следует учесть, что не все поглощенные кванты вызывают фотохимическую реакцию, поэтому следует учесть квантовый выход реакции –
47

, определяющий отношение числа квантов участвующих в химической реакции к общему числу поглощенных квантов.
В результате скорость будет равна:
dc dN
dt dt
Скорость поглощения квантов пропорциональна интенсивности падающего света (I0), концентрации вещества (c), участвующего в поглощении и эффективному поперечному сечению молекулы – площади (S):, при попадании в которую, квант поглощается:
dN S I c dt 0
С учетом квантового выхода реакции, уравнение примет вид:
|
|
|
|
|
|
|
dc |
S I |
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
||
|
|
|
|
|
|
|
dt |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Решая дифференциальное уравнения имеем: |
|
|
|
|
|||||||||||
|
dc |
S I |
|
dt |
|
|
|
|
|
|
dc |
S I |
|
dt |
|
|
|
|
0 |
; и далее, интегрируя, имеем: |
|
0 |
|||||||||
|
c |
c |
|||||||||||||
|
|
|
|
|
|
|
|||||||||
В итоге с учетом константы интегрирования:
c c0 e |
SI |
0t |
|
|
s = – поперечное сечение фотореакции, это площадь, при попадании в которую, квант не только поглощается, но и вызывает реакцию.
Можно заключить, что концентрация реагирующего вещества убывает экспоненциально в зависимости от интенсивности действующего света.
Задачи
1.Через пластинку из прозрачного вещества толщиной l = 4,2 см проходит половина падающего на нее светового потока. Определите натуральный показатель поглощения данного вещества. Рассеянием света в пластинке пренебречь; считать, что 10% падающей энергии отражается на поверхности пластинки.
2.В 4%-ном растворе вещества в прозрачном растворителе интенсивность света на глубине l1 = 20мм ослабляется в 2 раза. Во сколько раз ослабляется интенсивность света на глубине l2 = 30мм в 8%-ном растворе того же вещества?
48

3.Какова концентрация раствора, если одинаковая освещенность фотометрических полей была получена при толщине l1 = 8мм у эталонного 3%-ного раствора и l2 = 24мм – у исследуемого раствора?
4.Коэффициент пропускания раствора  = 0,3. Чему равна его оптическая плотность?
= 0,3. Чему равна его оптическая плотность?
5.Оптическая плотность раствора D = 0,08. Найдите его коэффициент пропускания.
6.При прохождении света через слой раствора поглощается 1/3 первоначальной световой энергии. Определите коэффициент пропускания и оптическую плотность раствора.
7.При прохождении монохроматического света через слой вещества толщиной
l = 15см его интенсивность убывает в 4 раза. Определите показатель рассеяния, если показатель поглощения равен 0,025 см-1.
8.Вычислите толщину слоя половинного ослабления параллельного пучка - излучения для воды,если натуральный показатель ослабления
'= 0,053см-1.
9.Интенсивность света, прошедшего через раствор, уменьшилась в 10 раз. Известно, что данное вещество имеет молярный показатель поглощения на данной длине волны, равный 500. Длина кюветы с раствором 1см. Найдите
концентрацию вещества в растворе.
10.Чему равен молярный показатель поглощения вещества, на длине волны 400 нм, если при прохождении света через раствор с концентрацией 0,5М интенсивность света уменьшилась в 10 раз? Длина кюветы 0,3 см.
Ответы на задачи |
|
|
|
|
1. |
0,14 см-1. |
6. |
0,67; 0,18. |
|
2. |
N = 8. |
7. |
0,015 см-1. |
|
3. |
1%. |
8. |
13,1 |
см. |
4. |
0,52. |
9. |
0,46 |
М. |
5. |
0,83. |
10. |
1500 л/(М.м). |
|
Тест–задания
1.Предметом фотобиологии является воздействие на биологические системы:
A.Гамма - излучения
B.ультрафиолетового и видимого излучения
C.рентгеновских лучей
D.медленных нейтронов
2.Физиологические фотохимические процессы подразделяются на следующие группы:
A.Энергетические
B.Двигательные
49
C.Информационные
D.Фотосинтетические
E.Дегидратационные
3.Деструктивно - модификационные фотохимические процессы подразделяются на следующие группы:
A.Патофизиологические
B.Мутационные
C.Аллергические
D.Летальные
4.Поглощение энергии квантов видимого света происходит на уровне:
A.Нейтронов и протонов
B.Ядра атома
C.Электронов
D.Ковалентных связей
5."Разрешенные" электронные уровни это:
A.Величина энергии, которой может обладать электрон
B.Расстояние от ядра, на котором может находиться электрон
C.Расстояние от соседнего атома до электрона на внешней орбитали
6.Основной электронный уровень:
A.Это уровень с максимальной энергией
B.Это уровень с минимальной энергией
C.Это уровень, максимально удаленный от ядра
D.Это уровень, максимально приближенный к ядру
7.Электронный уровень расщепляется на подуровни:
A.Индукционные
B.Колебательные
C.Вращательные
8.Если спины электронов ориентированы параллельно и не компенсируют друг друга, уровень является:
A.Синглетным
B.Триплетным
C.Неравновесным
9.Переход электрона на триплетный уровень возможен:
A.С нижележащего синглетного
B.С нижележащего триплетного
C.С вышележащего синглетного
10.Необходимыми условиями для отражения света являются следующие:
A.Одна из сред должна быть прозрачна
B.Среды должны находится в различных фазовых состояниях
C.Среды должны иметь различные коэффициенты преломления.
11.Явление полного внутреннего отражения наблюдается:
A.Когда длинна волны падающего света лежит вне области поглощения
B.Когда угол падения света менее критической величины
C.Если поверхность является оптически гладкой
50
