
Лекции по биофизике
.pdf
3.Определить изменение энтропии 1 кг воды, если ее нагреть от 0 до
500С?
4.Чему равно изменение энтропии при таянии 1 кг льда, имеющего температуру 00С?
5.1 моль пара конденсируется при 1000С, вода охлаждается до 00С и замерзает при этой же температуре. Найти изменение энтропии воды.
6.Для поддержания нормальной температуры в деревянном доме приходится сжигать ежедневно 0,1м3 дров в печке с КПД, равным 15 %. Определить разность температур наружной и внутренней
поверхности стенки дома, если общая его поверхность, проводящая теплоту, 200м2. Толщина стенки 30 см. Считать, что за счет теплопроводности теряется 80 % теплоты.
7.Какое количество теплоты за сутки теряет человек путем теплопроводности через кожу, если считать коэффициент
теплопроводности кожи равным 0,25 Вт/(м К)? Поверхность тела 1,8м2, толщина кожи 2 мм, разность температур на наружной и внутренней поверхностях 0,10С.
8.Определить потери теплоты с 1м2 кирпичной стены палаты в час, если температура в палате +180С, а на улице –20С. Толщина стены 80 см.
9.Площадь дна латунного стерилизатора равна 34х16 см. Определить разность температур между его поверхностями, если за 30с через дно
толщиной 1 мм проходит 20,7 кДж теплоты.
10.Определить количество воды, испаряющейся за 1 мин в стальном стерилизаторе, если его дно имеет площадь 40х19 см и толщину 1 мм, а разность температур поверхностей дна достигает 0,50С. Потерями теплоты через боковые стенки стерилизатора пренебречь.
Ответы на задачи |
|
|
|
|
|||
1. |
~5,4 10-12 Дж/К. |
6. |
~10,40С. |
||||
2. |
370С. |
|
|
|
|
7. |
1944 кДж. |
3. |
~7,1 102 Дж/К. |
8. |
~73 кДж. |
||||
4. |
1,2 10 |
3 |
Дж/К |
9. |
~0,10С. |
||
|
|
|
|||||
5. |
S ~1,5 10 |
2 |
Дж/моль К |
10. |
~64 г. |
||
|
|
|
|||||
Тест–задания
1.Термодинамическая система, которая обменивается с окружающей средой и веществом, и энергией, называется:
A.Изолированной
B.Закрытой
C.Открытой
2.Закон Гесса указывает на то, что:
21
A.Энергетический итог процесса не зависит от пути, а определяется начальным и конечным энергетическим состоянием системы
B.Энергетический итог процесса определяется путем развития процесса, а не зависит от температуры окружающей среды
C.Энергетический итог процесса определяется температурой окружающей среды, а не зависит от пути развития процесса
3.Чем сходны параметры термодинамического равновесия и стационарного состояния?
A.Соотношением величин свободной энергии и энтропии
B.Динамическими характеристиками термодинамических функций
C.Возможностью системы самостоятельно совершать работу
4.Какая энергия может быть использована для совершения работы?
A.Свободная энергия
B.Связанная энергия
C.Энергия, рассеянная в виде тепла
5.Чем различаются термодинамическое равновесие и стационарное состояние?
A.Величинами свободной энергии и энтропии
B.Динамическими характеристиками термодинамических функций
C.Возможностью системы самостоятельно совершать работу
6.Функция состояния - это термодинамическая функция, для которой верно следующее утверждение:
A.Ее изменение зависит только от начального и конечного состояний системы.
B.Она полностью характеризует состояние системы.
C.От нее возможно вычислить полный дифференциал.
7.Функцией состояния системы является:
A.Теплота
B.+Внутренняя энергия
C.Работа
8.В экспериментах Лавуазье по прямой калориметрии поток теплоты определялся:
A.По нагреванию наружной стенки калориметра
B.По скорости испарения воды.
C.По скорости таяния льда.
9.Метод непрямой калориметрии основан:
A.На учете тепловых эквивалентов поглощенных пищевых продуктов
B.На измерении температуры организма
C.На измерении теплоемкости организма
10.Энтропия системы связана с термодинамической вероятностью состояния системы следующей формулой:
A.S = RT Lnw
B.S = k Lnw
C.S = k (1 + w)
11.Энтропия системы при протекании необратимого процесса:
22
A.Увеличивается
B.Не изменяется
C.Уменьшается
12.Объединенная запись 1 и 2 законов термодинамики выглядит следующим образом:
A.dU = dQ - TdS
B.dU = dA - TdS
C.dU = dF - TdS
13.Свободная энергия системы - это часть внутренней энергии, которая:
A.Рассеивается в виде тепла.
B.Затрачивается на совершение работы.
C.Затрачивается на поддержание стабильности системы.
14.Связанная энергия системы - это часть внутренней энергии, которая:
A.Рассеивается в виде тепла.
B.Затрачивается на совершение работы.
C.Затрачивается на поддержание стабильности системы.
15.Энтальпия отражает:
A.Скорость продукции энтропии
B.Теплосодержание системы
C.Теплоемкость системы
16.Энтальпия определяется при постоянном:
A.Давлении
B.Температуре
C.Объеме
17.Укажите правильную запись уравнения для энтальпии:
A.dH = dQ + PdV
B.dH = dU + VdP
C.dH = dU + PdV
18.Свободная энергия Гельмгольца определяется при постоянных:
A.Давлении и объеме
B.Температуре и объеме
C.Температуре и давлении
19.Укажите правильную запись уравнения для свободной энергии Гельмгольца:
A.dF = dQ - TdS
B.dF = dU - PdS
C.dF = dU - TdS
20.Свободная энергия Гиббса определяется при постоянных:
A.Давлении и объеме
B.Температуре и объеме
C.Температуре и давлении
Правильные варианты ответов: |
|
|
|
|
|
1. |
С |
4. |
A |
7. |
B |
2. |
A |
5. |
A, C |
8. |
C |
3. |
B |
6. |
A, C |
9. |
A |
23
10. |
B |
14. |
A |
18. |
B |
11. |
A |
15. |
B |
19. |
C |
12. |
B |
16. |
A |
20. |
C |
13. |
B |
17. |
C |
|
|
24
II. КИНЕТИКА БИОЛОГИЧЕСКИХ ПРОЦЕССОВ
Введение
Кинетика биологических процессов – это раздел биофизики,
изучающий протекание во времени различных процессов, протекающих в живых системах – химических и биохимических превращений, транспорта веществ через клеточные мембраны, и так далее. Основное внимание будет уделено кинетике химических превращений, поскольку на данном примере удобно рассмотреть основные закономерности, присущие всем биологическим процессам. Особенности тех или иных видов превращений будут рассмотрены далее в соответствующих разделах настоящей книги.
Основой математического описания кинетики химических превращений является составление кинетических уравнений. В левой части уравнения расположена скорость изменения параметра по времени, то есть дифференциал (производная) по времени:
В химических и биохимических превращениях анализируемый параметр представлен концентрацией реагирующего вещества. Правая часть уравнения составлена на основе закона действующих масс, согласно которому скорость элементарного акта химической реакции пропорциональна произведению концентраций реагирующих веществ (с) в степенях, соответствующих их стехиометрическим коэффициентам:
dc kcn dt
Молекулярность и порядок реакции
Молекулярность реакции определяется числом молекул, участвующих в ее элементарном акте. Реакция может быть мономолекулярной: А В; бимолекулярной: А+В С или 2А В; тримолекулярной: А+2В С.
Реакции с молекулярностью выше трех встречаются крайне редко, так как вероятность одновременного столкновения четырех и более молекул крайне мала. Реакции, протекающие с участием 4 и более молекул, как правило, включают несколько последовательных стадий.
Порядок реакции определяется суммой показателей степеней, в которых концентрации реагирующих веществ входят в левую часть кинетического уравнения. В большинстве случаев порядок реакции совпадает с молекулярностью. Расхождение возможно в том случае, если одно из реагирующих веществ находится в избытке. В этом случае изменение концентрации одного из реагентов не влияет на скорость реакции, и ее порядок оказывается меньше молекулярности. Как следствие, возможна реакция нулевого порядка.
25

Кинетика реакции нулевого порядка
В живых системах нередко встречается ситуация, когда запасы реагирующего вещества в клетке постоянно пополняются и скорость реакции фактически не зависит от концентрации реагента А. Такая реакция, будучи по сути мономолекулярной, подчиняется закономерности нулевого порядка и не зависит от концентрации:
da |
k0 |
|
dt |
||
|
После взятия определенного интеграла в пределах от 0 до t и от ао до а получаем:
a  a0 k0 t
a0 k0 t
Графически это уравнение прямой линии с тангенсом угла наклона t. Скорость реакции остается постоянной на всем ее протяжении, пока не прекратиться поступление реагирующего вещества в систему.
Кинетика прямой реакции первого порядка
Реакция первого порядка: А В с коэффициентом скорости k1 подчиняется следующему кинетическому уравнению:
|
|
da |
k1 a xlim |
||
|
|
dt |
|||
|
|
|
|
|
|
Это дифференциальное уравнение с разделяющимися переменными, |
|||||
после интегрирования которого, мы получаем: |
|
||||
lna |
k |
t C или a |
C e k1 t . |
||
|
1 |
|
1 |
|
1 |
Константу интегрирования |
С1 |
можно определить как начальную |
|||
концентрацию реагента Ао |
при t=0, задав граничные условия аналогично |
||||
предыдущему случаю и тогда: |
|
|
|
|
|
|
|
a |
a0 e |
k1 |
t . |
|
|
|
|
||
Кинетика обратимой реакции первого порядка
Вбиологических системах большая часть реакций является
обратимыми, то есть одновременно протекают в обоих направлениях: А В. Кинетика такой реакции рассматривается как две одновременно протекающие реакции – прямую и обратную с константами скоростей k1 и k-
1.
Кинетическое уравнение выглядит следующим образом:
da |
k a |
k |
|
b . |
|
|
|
1 |
|||
|
|
||||
dt |
1 |
|
|
||
|
|
|
|
||
26

Кроме начальных условий t=0, a=a0, b=0, мы можем наложить ограничение замкнутости системы, следовательно: a+b=aо в любой момент времени.
Тогда кинетическое уравнение будет выглядеть следующим образом:
|
da |
(k |
k ) a k |
a . |
||
|
|
|
||||
|
|
|
||||
|
dt |
1 |
1 |
1 |
0 |
|
|
|
|
|
|
||
Дифференциальные уравнения такого типа решаются в два этапа. |
||||||
Сначала находим решение однородного уравнения: |
|
|||||
|
da |
( k1 |
k 1 ) a |
0 |
|
|
|
|
dt |
|
|||
|
|
|
|
|
|
|
a |
|
C1 |
e |
(k1 |
k |
1) t |
|
|
|
|
|
|
|||
Частное решение неоднородного уравнения с постоянной правой частью |
|||||||
находим в виде константы а = С и тогда |
|
|
|
|
|||
da |
0 |
, a |
|
C |
k1a0 |
. |
|
dt |
|
(k1 |
k 1) |
||||
|
|
|
|
|
|||
|
|
|
|
|
|
||
Константу интегрирования можно определить из начальных условий t=0, a=a0, тогда общее решение дифференциального уравнения запишется следующим образом:
a C1 e |
(k1 |
k 1) t |
C |
|
|
В результате вычислений подставляя значения С:
a |
k-1a0 |
|
k |
1 k1e |
(k1 k |
1 )t |
|
k1 |
k |
1 |
|
|
|||
|
|
|
|
|
|||
Учитывая, что b=a0-a, получим:
b |
k1a0 |
|
1-e (k1 k 1 )t |
|
k1 k |
1 |
|||
|
|
Кинетика реакции второго порядка
Реакция 2-го порядка имеет вид:
A B k2 C ,
и с учетом того, что при t = 0, исходные концентрации равны a0 и b0, в любой момент времени на основании эквимолярного взаимодействия a и b:
dx |
k2 |
( a0 |
x )( b0 x ) |
|
dt |
||||
|
|
|
27

Проведя разделение, переменных получим:
|
|
|
|
|
|
|
dx |
|
|
|
|
|
k2 |
dt |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
(a0 |
|
x)(b0 |
|
x) |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Используя тождество: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
1 |
|
|
|
|
|
1 |
|
|
( |
|
1 |
|
|
|
1 |
|
) , |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
(a0 |
x)(b0 |
x) a0 |
|
b0 b0 |
x a0 |
x |
||||||||||||||||
получим стандартное дифференциальное уравнение: |
|
|
|||||||||||||||||||||
|
|
1 |
|
( |
1 |
|
|
|
1 |
|
|
) |
k dt . |
|
|
||||||||
|
|
a0 |
|
b0 |
|
x |
a0 |
|
x |
|
|
||||||||||||
|
|
b0 |
|
|
|
2 |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Его решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
b (a |
|
x) |
|
|
|
||||||
|
|
k2 |
dt |
|
|
|
|
|
ln |
|
|
0 0 |
|
|
|
. |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
a0 |
|
|
b0 |
|
a0 (b0 |
|
x) |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
При избытке одного из веществ это выражение превращается в уравнение 1-го порядка.
Сложные реакции
В биологических процессах химические и биохимические реакции часто образуют сложные каскады, включающие целый ряд элементарных актов реакций, протекающих последовательно или одновременно. Кинетика таких многокомпонентных (многостадийных) процессов основывается на уже
знакомых закономерностях. |
|
|
|
|
|
Несколько последовательно протекающих |
элементарных |
реакций |
|||
образуют линейные цепи |
реакций: A |
k1 |
B |
k1x |
стадия |
|
C , каждая |
||||
характеризуется своей константой скорости (k1 и k1x, соответственно). Рассмотрение данного примера так же начнем с установления
граничных условий: в момент времени t = 0 a = a0, b = c = 0; в любой момент
времени a + b + c = a0.
Кинетическое описание данной цепи реакций можно представить в виде системы уравнений:
da |
k1 |
a |
|
dt |
|||
|
|
||
db |
k a |
k x b |
|
dt |
1 |
1 |
|
|
|
||
dc |
x |
b |
|
dt |
k1 |
||
|
|
Первая формула представляет собой уравнение скорости реакции первого порядка, решение которого имеет вид
28

k t a a0 e 1
Тогда, с учетом b=a0–a–c
dc |
x |
x |
|
x |
|
k t |
|
|
|
1 |
|||
|
k1 |
c k1 |
a0 |
k1 |
a0 e |
|
dt |
|
|||||
|
|
|
|
|
|
Общее решение этого уравнения складывается из решения однородного уравнения с правой частью, равной нулю, и частного решения неоднородного уравнения:
|
|
|
|
|
|
k |
x |
t |
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
c |
k1a0 |
|
e |
|
|
|
k1 a0 |
|
e |
k1 t |
a0 |
||||||
|
|
1 |
|
|
|
||||||||||||
k x |
k |
|
|
|
|
|
|
k x |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
k |
|
|
|
||||||
|
1 |
|
1 |
|
|
|
|
|
|
1 |
|
1 |
|
|
|
|
|
Используя заданные граничные условия, можно получить формулу и для |
|||||||||||||||||
кинетики вещества В: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k1a0 |
|
|
|
|
|
k xt |
|
|
|
k t |
|
|
||
|
b |
|
|
|
|
|
e 1 |
|
e |
|
|
||||||
|
|
|
|
|
|
|
( |
|
|
1 |
) . |
|
|||||
|
k |
x |
|
k |
|
|
|
||||||||||
|
|
1 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
В первую фазу процесса происходит накопление вещества В, а во вторую – вещества С.
Если скорость первой реакции существенно выше, чем второй, в системе образуется избыток вещества В и вторая реакция начинает подчинятся кинетическому уравнению нулевого порядка. Тогда накопление вещества С в системе перестанет зависеть от скорости первой реакции и будет подчиняться уравнению:
ck0 t
Врезультате скорость линейной цепи реакций полностью определяется
еевторой стадией, которую в этом случае называют лимитирующей стадией процесса.
Если цепь последовательных реакций замыкается, то есть конечный продукт цепи является субстратом для ее первой стадии, такую реакцию называют циклической.
Циклические реакции нередко встречаются в биохимических системах, играя важную роль в процессах метаболизма, широко известен цикл Кребса. Скорость цикла всегда определяется скоростью лимитирующей (то есть самой медленной) стадии.
Разветвленные (параллельные) цепи реакций
29
|
|
|
|
t |
0, |
|
k1 |
k |
1 |
протекают на условиях |
a |
a |
0 , |
B |
A |
|
|
|
|
в с 0.
В результате, необходимо решить систему уравнений:
da |
|
|
|
(k1 |
k 1) a |
|||
|
|
|
|
|
||||
dt |
|
|
|
|||||
|
|
|
|
|
|
|
||
|
|
|
db |
k1 |
a |
|||
|
|
|
|
|
|
|||
|
|
|
dt |
|
||||
|
|
|
|
|
|
|
||
|
|
dc |
|
k |
|
a |
||
|
|
|
|
|
|
1 |
||
|
|
dt |
|
|||||
|
|
|
|
|
|
|||
Решая эти уравнения, получим:
|
|
|
a a0 e |
(k1 |
k 1) t |
|
|
|
|
|
|
|
|
|
|
|
|
b |
k1a0 |
|
1-e (k1 k 1 )t и c |
|
k1a0 |
|
1-e (k1 k 1)t |
|
|
|
|
|
|||||
k1 k |
|
|
k1 k |
|
||||
|
1 |
|
|
|
1 |
|||
Нетрудно увидеть, что b/с=k1/k-1., т.е. соотношение образующегося вещества при параллельных реакциях пропорционально отношениям констант скоростей реакций.
Зависимость скорости реакции от температуры
До сих пор мы рассматривали зависимость скорости от констант реагентов, однако очевидно, что большое влияние на скорость реакции оказывает изменение температуры.
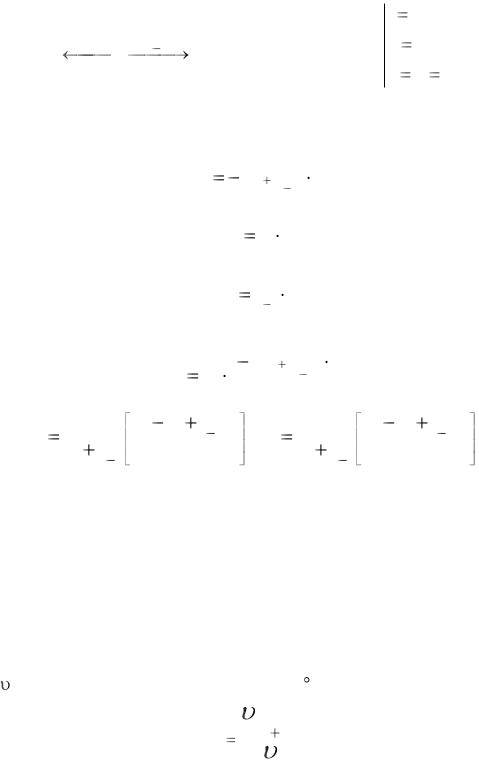
Вант-Гоффу принадлежит утверждение, что скорость химической реакции ( ) при увеличении температуры на 10 С увеличивается в 2-4 раза.
Q |
T |
10 |
|
|
|
. |
|
|
|
||
10 |
|
Т |
|
|
|
||
Позднее установили, что для: химической реакции Q10=2-4, физической реакции Q10=1,1-1,2, ферментативной реакции Q10~1,7.
Вант-Гофф установил, что константа равновесия К подчиняется уравнению:
30
