
Помощник по физике
.pdf
|
21 |
|
|
|
Q |
λ |
dT |
St , |
|
dx |
||||
|
|
|
где Q – теплота, прошедшая посредством теплопроводности через площадь S за время t; dT/dx – градиент температуры; λ – теплопроводность:
λ |
1 |
C v ρ υ l |
, |
|
|||
3 |
|
|
|
где Сv – удельная теплоемкость газа при постоянном объеме; ρ – плот-
ность газа; υ |
- средняя арифметическая скорость теплового движения |
его молекул; |
l - средняя длина свободного пробега. |
10 Закон диффузии Фика: |
|
d |
|
|
M |
D |
St , |
||
|
||||
|
|
dx |
||
где М – масса вещества, переносимая посредством диффузии через площадь S за время t; dρ/dx – градиент плотности, D – диффузия:
D 1 |
v l . |
3 |
|
11 Закон Ньютона для внутреннего трения (вязкости):
F dv S , dx
где F – сила внутреннего трения между движущимися слоями площадью S; dυ/dx – градиент скорости; η – динамическая вязкость:
1 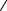 v
v 
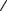 l
l  . 3
. 3
12Коэффициентом поверхностного натяжения:
F ,
L
где F – сила поверхностного натяжения, отнесенную к единице длины контура L.
13 Энергия поверхностного слоя (поверхностная энергия):
,
где S - площадь поверхности. Знак минус указывает, что сила поверхностного натяжения направлена внутрь поверхности.
14 Высота поднятия (опускания) жидкости при смачивании (несмачивании) в капилляре (закон Мюрена):
h2 cos ,
g r

22
где r – радиус капилляра; - краевой угол - угол между касательной к поверхности и поверхностью твердого тела, отсчитываемый внутрь поверхности жидкости; α - коэффициентом поверхностного натяжения; ρ – плотность жидкости.
15 Закон Бойля – Мариотта
|
|
PV const |
|
при |
|
T const |
, m const |
, |
|||||||||||||||
|
|
|
|
P 1 V 1 |
|
P 2 V 2 - |
для двух состояний газа. |
|
|||||||||||||||
Закон Гей-Люссака: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
V |
|
const |
|
при |
|
P const |
, m |
const |
, |
|||||||||||
|
|
|
T |
|
|||||||||||||||||||
|
|
|
|
|
|
V 1 |
|
|
|
|
V 2 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
- для двух состояний газа. |
|
||||||||||
Закон Шарля: |
|
|
|
T 1 |
|
T 2 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
P |
const |
при |
|
T const |
, m |
const |
, |
||||||||||||||
|
|
|
|
||||||||||||||||||||
|
|
T |
|
|
|
|
P1 |
|
|
|
|
|
P 2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- для двух состояний газа. |
|
|||||||
|
|
|
|
|
|
|
|
|
|
T 1 |
|
|
T 2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Объединенный газовый закон: |
|
|
|
|
|
||||||||||||||||||
|
PV |
|
const |
|
|
|
|
|
при |
m |
const |
, |
|||||||||||
|
|
|
T |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
P1 V1 |
|
|
|
|
P 2 V 2 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
- двух состояний газа. |
|
||||||||||||
|
|
|
|
|
|
|
|
|
T 2 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|||
16 Уравнение Клапейрона - Менделеева (уравнение состояния идеального газа):
PV m RT ,
?
где R – универсальная газовая постоянная, ? – молярная масса газа.
17 Закон Дальтона. Давление Р смеси различных газов равно сумме парциальных давлений Рi газов, составляющих смесь:
|
|
|
n |
|
P P1 |
P2 |
... Pn |
Pi . |
|
|
|
|
i |
1 |
18 Средняя кинетическая энергия, приходящаяся на одну степень свободы:
 i
i 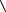 1 kT . 2
1 kT . 2
Средняя кинетическая энергия (поступательного и вращательного движений) одной молекулы:
i |
|
i |
kT , |
|
|||
|
2 |
|
|

23
где i – число степеней свoбоды.
Число i степеней свободы есть число независимых координат, определяющих положение молекулы в пространстве. В зависимости от сложности строения i принимает следующие значения:
i = 3 для одноатомных газов; i = 5 для двухатомных газов;
i = 6 для трех- и многоатомных газов (если не учитывать колебаний частей молекул).
Внутренняя энергия и изменение внутренней энергии идеального газа:
U ν |
i |
RT |
|
m |
|
|
i |
RT |
, |
|
|||||
|
|
|
|
|
|
|
|
||||||||
2 |
|
? 2 |
|
|
|
|
|||||||||
U ν |
i |
R T |
m |
|
i |
R T |
, |
||||||||
|
|
|
|||||||||||||
2 |
|
|
? 2 |
|
|
|
|||||||||
где ν – количество вещества; m – масса газа; ? – молярная масса газа; R
– молярная газовая постоянная.
19 Теплоемкость - это физическая величина, численно равная теплоте, необходимой для нагревания тела (системы) на один кельвин:
C dQ , dT
где dQ – теплота, подведенная к телу при повышении его температуры на dT.
20 Связь между молярной Cm и удельной С теплоемкостями газа:
C m ?c ,
где ? – молярная масса газа.
Молярные теплоемкости газа при постоянном объеме и постоянном давлении:
C V |
|
i |
R , |
C P |
|
i 2 |
R . |
|
|
||||||
|
2 |
|
|
2 |
|
||
Отношение γ теплоемкости газа при постоянном давлении к теплоемкости его при постоянном объеме выражается формулой
|
C P |
|
i 2 |
. |
C V |
|
|||
|
|
i |
||
Уравнение Майера. Разность теплоемкостей газов при постоянном давлении и постоянном объеме равна универсальной газовой постоянной:
C P C V R .
21 Первое начало термодинамики в общем случае:
Q U A ,
24
где Q – количество теплоты, сообщенное газу или отданное им; ΔU – изменение ее внутренней энергии; A – работа, совершаемая газом против внешних сил.
Первое начало термодинамики для малого изменения системы:
dQ dU dA .
Работа, совершаемая газом при изменении его объема: dA pdV .
Полная работа при изменении объема газа:
|
V 2 |
A |
pdV , |
|
V 1 |
где V1 и V2 - соответственно начальный и конечный объемы газа. а) Изохорический процесс (V = const):
V 0, A 0 ,
Q U .
б) Изобарический процесс ( p = const):
Ap V R T , Q U A .
в) Изотермический процесс (T = const): |
|
|
|
V |
|
T 0, U 0, A RT ln |
2 |
, |
V |
||
Q A . |
1 |
|
|
|
|
г) Адиабатический процесс (Q = 0): |
|
|
A U . |
|
|
22 Уравнение адиабатического процесса (уравнение Пуассона):
PV const .
Начальное и конечное значения давления, объема и температуры связаны соотношениями:
P2 |
|
|
V1 |
|
|
T 2 |
V1 |
|
1 |
T |
|
|
|
P |
|
|
1 |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
, |
|
|
|
|
, |
|
2 |
|
|
|
2 |
|
. |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
||||||||||||||
P1 |
|
|
V 2 |
|
|
T1 |
|
V 2 |
|
|
T 1 |
|
|
P1 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
23 Термический коэффициент полезного действия для кругового процесса – цикла (характеризует степень использования теплоты при превращении ее в работу):
|
A |
|
Q 1 Q 2 |
1 |
Q 2 |
, |
|
Q 1 |
Q 1 |
Q 1 |
|||||
|
|
|
|
где Q1 – количество теплоты, полученное системой; Q2 – количество теплоты, отданное системой; А – работа, совершаемая за цикл. Термический коэффициент полезного действия цикла Карно:
|
|
|
|
|
|
|
25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Q1 Q 2 |
|
|
T1 T2 |
, |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
Q1 |
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
где Т1 – температура нагревателя; Т2 – температура холодильника. |
|
|||||||||||||||||||||||||||||
24 Изменение |
энтропии при |
равновесном переходе из состояния 1 в со- |
||||||||||||||||||||||||||||
стояние 2: |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
dQ |
|
|
dU dA |
|
|
|
|
|
||||||||||||||
|
S1 2 S2 S1 |
|
|
|
. |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
T |
|
|
|
1 |
|
|
|
|
T |
|
|
|
|
|
|
|
|||||
Для изохорического процесса: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
||||||
|
|
2 |
|
dU |
|
|
|
|
i m |
|
|
dT |
|
|
|
|
|
|
|
|||||||||||
|
S1 2 |
|
|
|
R |
. |
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
2 |
|
T |
|
|
|
|
|||||||||||||||||||
|
|
1 |
|
|
T |
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|||||||||
Для изотермического процесса: |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
T 2 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
2 |
dA |
|
|
|
|
m |
|
|
dV |
|
|
|
|
|
|
|
||||||||||
|
ΔS 1 2 |
|
|
R |
|
|
. |
|
|
|
|
|||||||||||||||||||
|
T |
? |
|
|
V |
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
||||||||||||
Для изобарического процесса: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
T |
|
|
|
||||
|
2 |
dU dA |
|
|
|
|
i m |
|
|
|
|
dT |
|
|
|
m |
2 |
dV |
|
|||||||||||
ΔS 1 2 |
|
|
|
|
|
|
R |
|
|
|
|
|
R |
|
. |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
T |
|
|
|
2 ? |
|
|
|
T |
|
? |
|
V |
||||||||||||||||||
|
1 |
|
|
|
|
|
|
|
T1 |
|
|
|
T1 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
25 Формула Больцмана: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
S k ln W |
, |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
где k – постоянная Больцмана, W – термодинамическая вероятность со-
стояния системы.
5 Молекулярно-кинетическая теория газов. Уравнение КлапейронаМенделеева. Газовые законы. Закон Дальтона
5.1 Нельзя заставить капельку нефти объемом 1 мм3 расплыться по поверхности воды так, чтобы она заняла площадь больше 3 м2. Минимальные размеры d частиц нефти (М=1 кг/моль, =0,8 103 кг/м3) (м):
1) |
3,3 10-8 ; |
2) 0,33 10-10 ; |
3) |
2,4 10-10 ; 4) |
3,3 10-10 |
; 5) 0,24 10-8. |
|||||||
5.2 При |
изотермическом |
расширении 2 м3 |
газа давление его меняется от |
||||||||||
Р1 = 5 ат до Р2 = 4 ат. Совершенную при этом работу (105 Дж): |
|||||||||||||
1) |
4,2; |
|
2) |
5,0; |
3) |
8,3; |
4) |
2,2; |
5) |
9,1. |
|
||
5.3 При |
нормальных условиях |
смесь 4 кг |
гелия |
и 4 кг азота занимает |
|||||||||
объем (м3): |
|
|
|
|
|
|
|
|
|
|
|||
1) |
6; |
2) |
16; |
3) |
26; |
4) |
36; |
5) |
46. |
|
|
|
|

26
5.4 Запаянный шар, содержащий 35 г воды, нужно нагреть, чтобы он разорвался, (стенки шара выдерживают давление 20 МПа, объем шара 1 л) до температуры (0С):
1) |
573; |
2) |
735; |
3) |
965; |
4) |
643; |
5) |
761. |
5.5 Расширяясь изотермически, |
1 моль |
водорода совершил работу, равную |
|||||||
10 Дж. Его внутренняя энергия изменилась на (Дж): |
|||||||||
1) |
10; |
2) |
20; |
3) 0,1; |
4) 0; |
5) -10. |
|
||
5.6 Количество вещества кислорода равно 0,2 моль. Концентрация молекул
кислорода |
находящегося |
|
в сосуде |
вместимостью 2 л (1025 м 3): |
||||||
1) |
2,70; |
2) |
6,02; |
3) |
3,01; |
4) |
1,35; |
5) |
2,00. |
|
5.7 В баллоне емкостью |
30 л |
находится сжатый воздух при температуре |
||||||||
170С. После того как часть воздуха израсходовали, давление понизилось на 2 МПа. При постоянной температуре была израсходована масса воздуха (г):
1) 322; 2) 422; 3) 522; 4) 622; 5) 722.
5.8 Имеется два баллона одинакового объема. В одном из них находится 1 кг газообразного молекулярного азота, в другом 1 кг газообразного молекулярного водорода. Температуры газов одинаковы.. Давление азота 1 105 Па. Давление водорода (Па):
1) 1 105 ; 2) 14 105 ; 3) 28 105 ; 4) 7 105 ; 5) 3,6 105 .
5.9 Давление идеального газа, находящегося в баллоне объемом V, если кинетическая энергия поступательного движения его молекул равна Е:
1) |
2 |
|
Е |
; |
2) |
E |
; |
3) |
3E |
; |
4) |
2E |
; 5) нет верного. |
3 |
|
V |
|
V |
|
2V |
|
3V |
|||||
5.10 Если при увеличении абсолютной температуры идеального газа в 2 раза его давление увеличилось на 25%, то объем этого газа заданной массы:
1) уменьшился в 1,6 раза; 2) |
увеличился в 1,6 раза; 3) уменьшился в 2 |
раза; 4) увеличился в 2 раза; |
5) не изменился. |
5.11 Изобары одной и той же массы газа располагаются в порядке P3 > P2 > P1 на графике:
V |
1 |
|
V |
3 |
|
V |
2 |
|
V |
1 |
|
V |
3 |
|
|
2 |
1 |
3 |
3 |
2 |
|||||||||||
|
|
|
|
|
|||||||||||
|
3 |
|
2 |
|
1 |
|
2 |
|
1 |
||||||
|
|
T |
|
|
T |
|
|
T |
|
|
T |
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
||||||

27
5.12 В сосуде вместимостью V = 40 л находится кислород при температуре Т = 300 К. Когда часть газа израсходовали, давление в баллоне понизилось наР = 100 кПа. Масса m израсходованного кислорода, если процесс изотерми-
ческий (кг): |
|
|
|
|
|
|
||
1) |
0,5; |
2) |
0,09; |
3) |
1; |
4) |
2; |
5) 0,05. |
5.13 В воду опущена на очень малую глубину стеклянная трубка с диаметром канала d =1 мм. Коэффициент поверхностного натяжения воды = 72 мН/м. Масса m воды, вошедшая в трубку (10-3г):
1) 0,00226; 2) 0; 3) 28,8; 4) 226; 5) 2.
5.14 В сосуде объёмом V = 2 л находится масса m1 = 6 г углекислого газа (СО2) и масса m2 = 5 г закиси азота (N2О) при температуре t = 127 0С. Давление смеси в сосуде (кПа):
1) 10; 2) 415; 3) 7 000; 4) 2 000; 5) 6.
5.15 Число молекул газа N в комнате объемом V = 80 м3 при температуре t = 17 0С и давлении Р =100 кПа (1027):
1) 12; 2) 6; 3) 2; 4) 10; 5) 15.
5.16 Плотность некоторого газа = 0,06 кг, средняя квадратичная скорость
его молекул |
2 |
= 500 м/с. Давление Р, которое газ оказывает на стенки со- |
|||||||
суда (кПа): |
|
|
|
|
|
|
|
|
|
1) |
100; |
2) |
5; |
3) |
10; |
4) |
50; |
5) |
80. |
5.17 Число молекул N двухатомного газа в объеме V = 10 cм3 при давлении Р = 5,3 кПа и температуре t = 27 0С (1019):
1) 7,8; 2) 1,3; 3) 9,1; 4) 2,5; 5) 3,2.
6 Средняя кинетическая энергия молекул. Закон равнораспределения энергии по степеням свободы. Теплоемкости. Первое начало термодинамики. Адиабатический процесс
6.1 Показатель |
адиабаты идеального газа, |
который при температуре |
|||||||
Т = 350 К и давлении Р = 0,4·106 Па занимает объем V = 300 л и имеет удель- |
|||||||||
ную теплоемкость СV = 857 Дж/К: |
|
|
|
||||||
1) |
1,2; |
2) |
1,4; |
3) |
1,6; |
4) |
2,1; |
5) |
1,8. |
6.2 Одноатомный газ при нормальных условиях занимает объем 5 л. Удель-
ная теплоемкость СV |
этого газа при постоянном объеме (Дж/К): |
|||||||
1) |
1,50; |
2) |
8,89; |
3) |
7,80; |
4) |
8,31; |
5) 2,79. |
28
6.3 В закрытом сосуде объёмом V = 10 л находится воздух при давлении Р = 0,1 МПа. Количество теплоты Q, необходимое воздуху, чтобы повысить давление воздуха в сосуде в 5 раз (кДж):
1) 12; 2) 40; 3) 4; 4) 52; 5) 10.
6.4 В закрытом сосуде находится масса m1 = 20 г азота и масса m2 = 32 г кислорода. Изменение W внутренней энергии смеси газов при охлаждении её на Т =28 К (Дж):
1) 2 500; 2) 1 000; 3) 4 000; 4) 8 500; 5) 1 500.
6.5 Для того чтобы 1 моль кислорода совершил работу 10 Дж при изотермическом процессе, ему нужно сообщить количество теплоты (Дж):
1) 0; 2) 10; 3) 20; 4) 8,31; 5) 8,31.
6.6 Идеальному газу передается количество теплоты таким образом, что в любой момент времени переданное количество теплоты Q равно изменению внутренней энергии U тела. При этом осуществляется процесс:
1) адиабатный; 2) изобарный; 3) изохорный; 4) изотермический 5) это мог быть любой процесс.
6.7 Внутренняя энергия трех молей идеального одноатомного газа при изобарном нагревании его от 299 К до 301 К увеличится на (Дж):
1) 33; 2) 50; 3) 75; 4) 25; 5) 42.
6.8 Суммарная кинетическая энергия Ек поступательного движения всех молекул одноатомного газа, находящегося в сосуде вместимостью V = 3 л под давлением Р =540 кПа (Дж):
1) 420; 2) 24; 3) 2430; 4) 45; 5) 1500.
6.9 Работа А, совершаемая при изотермическом расширении водорода массой m = 5 г, взятого при температуре Т = 290 К, если объем газа увеличивается в 3 раза (Дж):
1) 1400; 2) 2020; 3) 2438; 4) 6620; 5) 1000.
6.10 Работа А, которую совершит азот, если ему при постоянном давлении сообщить количество теплоты Q = 21 кДж (Дж):
1) |
2 000; |
2) |
6 000; |
3) |
4 000; |
4) |
1 000; |
5) |
1 500. |
6.11 Внутренняя энергия W двухатомного газа, находящегося в сосуде объе- |
|||||||||
мом V = 2 л под давлением Р = 150 кПа (Дж): |
|
|
|||||||
1) |
250; |
2) |
500; |
3) |
20; |
4) |
150; |
5) 750. |
|

|
|
|
|
|
|
|
29 |
|
|
|
6.12 Удельная |
теплоемкость |
некоторого |
двухатомного |
газа |
||||||
Суд = 14,7 кДж/кг·К. Молярная масса этого газа (кг/моль): |
|
|||||||||
1) |
0,002; |
2) |
1,002; |
3) |
0,005; |
4) |
0,008; |
5) |
0,004. |
|
6.13 При изобарическом расширении двухатомного газа была совершена работа А = 156,8 Дж. Количество теплоты Q, сообщенное газу (Дж):
1) |
200; |
2) |
|
188; |
|
3) |
100; |
4) |
156; |
5) |
550. |
|
|||
6.14 Воздух, |
находящийся при t1 = 00 С, если он расширяется адиабатически |
||||||||||||||
от объема V1 до V2 = 2V1 (воздух можно считать азотом) охладится до темпе- |
|||||||||||||||
ратуры t2 (К): |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1) |
556,2; |
2) |
206,89; |
3) |
|
230,21; |
4) |
211,28; |
5) |
400,51. |
|||||
6.15 Плотность водяного пара, |
находящегося под давлением 2,5 кПа и |
||||||||||||||
имеющего температуру 250 К (кг/м3): |
|
|
|
|
|
||||||||||
1) |
0,02; |
2) |
2; |
3) |
0,002; |
4) |
1,8; |
|
5) |
18. |
|
|
|||
6.16 В одном моле кислорода содержится молекул: |
|
||||||||||||||
1) |
12 1026 ; |
|
2) |
6 1026 ; |
|
3) |
12 1023; |
4) 6 1023; |
5) 1 1023. |
||||||
6.17 Число молекул в 140 г азота, если молярная масса азота 28·10-3 кг/моль, а
постоянная Авогадро |
6·10-23 моль-1: |
1) 2·1025 ; 2) 3·1020; |
3) 3·1024; 4) 4·1025; 5) нет верного. |
6.18 Формулировкой закона Авогадро является утверждение:
1) равновесное состояние простой системы заданного химического состава и массы m определяется заданием двух параметров – объема V и температуры Т; 2) для данной массы газа при постоянной температуре давление газа изменяется обратно пропорционально его объему; 3) V V0 1 αt ; 4) P P0 1 αt ; 5) моль всех идеальных газов при одинаковых давлении и температуре занимает одинаковый объем.
6.19 График изохорического процесса: |
|
P |
5 |
||||||||||
|
|
1 |
|||||||||||
1) |
3; |
2) |
5; |
3) |
2; |
4) |
4; |
5) |
1. |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
6.20 Сосуд откачан до давления Р = 1,33·10-9 Па; |
V |
||||||||||||
|
|||||||||||||
температура воздуха t = 150 С. Плотность воздуха в сосуде (10—14 кг/м3): |
|||||||||||||
1) |
29; |
|
2) |
1,6; |
|
3) |
3,2; |
|
4) |
8,9; |
5) |
4. |
|
6.21 Средняя кинетическая энергия ЕП поступательного движения одно- |
|||||||||||||
атомной молекулы газа равна 4,14·10-21 Дж при какой температуре (К): |
|||||||||||||
|
|
|
|
|
|
|
30 |
|
|
1) |
8000; |
2) |
1200; |
3) |
273; |
4) |
400; |
5) |
200. |
6.22 Расширение газа происходит без теплообмена с окружающей средой.
Изменение внутренней |
энергии |
газа, если он совершает работу 75 Дж |
равно (Дж): |
|
|
1) 0; 2) 37,5; 3) 75; |
4) 75; |
5) 37,5. |
6.23 Внутренняя энергия газа складывается из Ек – суммарной кинетической энергии молекул и Еп – потенциальной энергии их взаимодействия. Соотношение между Ек и Еп , при котором состояние газа может быть описано уравнением Менделеева-Клапейрона:
1) Ек>>Еп ; 2) Ек<<Еп ; 3) Ек=Еп ; 4) Ек и Еп>0; 5) нет верного.
6.24 В процессе подведения к газу тепла газ не совершил работу над окружающей средой. Единственно верным из приведенных утверждений по отношению к такому процессу является:
1) |
объем газа в процессе не изменялся; |
2) окружающая среда не совершала |
|||||||||||||||||
работу над газом; |
3) |
все подведенное к газу тепло пошло на изменение его |
|||||||||||||||||
внутренней энергии; |
4) |
утверждения 1-3 |
все верные; |
5) нет верного. |
|||||||||||||||
6.25 Определить среднюю кинетическую энергию Еср |
одной молекулы водя- |
||||||||||||||||||
ного пара при температуре Т = 500 К (10-20 Дж): |
|
|
|||||||||||||||||
1) |
82; |
2) |
2,1; |
|
3) |
541; |
4) |
421; |
5) |
1,2. |
|
||||||||
6.26 Выражение, определяющее количество молей вещества: |
|||||||||||||||||||
1) |
|
m |
; |
2) ; |
|
3) |
? |
; |
4) |
m |
V ; |
|
5) |
1 |
. |
|
|
||
|
? |
|
|
|
|
m |
|
? |
|
|
|
? |
|
|
|
||||
7 Обратимые и необратимые процессы. Второе начало термодинамики. Тепловые двигатели и холодильные машины. Цикл Карно и его КПД
7.1 При прямом цикле Карно, если температура нагревателя 227 0С, а тем-
пература холодильника 98 0С, то холодильнику отдается |
полученная от на- |
||||||||||||||
гревателя часть теплоты: |
|
|
|
|
|
|
|
|
|
||||||
1) |
0,742; |
|
2) |
0,542; |
3) |
0,442; |
4) |
0,342; |
5) |
0,242. |
|
|
|||
7.2 Коэффициент полезного действия идеальной тепловой машины |
0,3. При |
||||||||||||||
изотермическом расширении газ получил от нагревателя |
200 Дж |
энергии. |
|||||||||||||
Работа, совершаемая при изотермическом сжатии (Дж): |
|
|
|||||||||||||
1) |
60; |
2) |
140; |
3) |
200; |
4) |
80; |
5) |
40. |
|
|
|
|
||
