
- •3. Основные расчетные параметры. Температура, давление, допускаемое напряжение.
- •4. Основные требования, предъявляемые к конструкциям сварных аппаратов (привести нормативные документы). Испытания аппаратов на прочность и герметичность.
- •5. Пластины оболочки. Основные понятия и определения. Напряженное состояние оболочек вращения под воздействием внутреннего давления.
- •10. Механические колебания валов. Критическая скорость вала с одним грузом (анализ формулы динамического прогиба). Условие виброустойчивости. Явление самоцентрирования.
- •11.Особенности расчета валов с несколькими массами. Понятие о точном методе расчета критических скоростей. Приближенные методы.
- •12. Колебания валов. Гироскопический эффект. Влияние различных факторов на критическую скорость
- •15. Расчет колонных аппаратов на действие ветровых нагрузок. Расчетная схема, расчетные состояния. Определение осевой нагрузки.
- •16. Определение ветровой нагрузки и изгибающего момента. Проверка прочности корпуса колонного аппарата.
- •17. Расчет колонных аппаратов на действие ветровых нагрузок. Типы и конструкция опор для вертикальных аппаратов. Выбор типа опоры.
- •18. Расчет колонных аппаратов на действие ветровых нагрузок. Проверка прочности и устойчивости опорной обечайки и ее узлов.
- •19. Теплообменные аппараты. Определение температурных усилий и напряжений в корпусе и трубках та типа тн (Привести расчетную схему, формулы без вывода.Анализ формул).
- •20. Теплообменные аппараты. Определение температурных усилий и напряжений в корпусе и трубках та типа тк (Привести расчетную схему, формулы без вывода.Анализ формул).
- •21)Назначение и роль машин и аппаратов. Основные тенденции в развитии аппаратурного оформления процессов нефтегазопереработки
- •24. Роль и место колонных аппаратоввтехнологическом процессе. Содержание паспорта на аппарат.
- •25. Внутренние устройства колонных аппаратов. Типы тарелок, их классификация и требования к ним. Конструктивное исполнение крепления внутренних устройств. Отбойные устройства.
- •26. Насадочные контактные устройства. Типы и классификация насадок. Принципы выбора насадок.
- •27. Вакуумные колонны. Особенности конструкции и эксплуатации. Вакуумсоздающие системы, конструкции.
- •28. Трубчатые печи. Назначение, их место и роль в технологической системе и область применения. Классификация трубчатых печей и их типы.
- •30. Трубчатый змеевик, его конструктивное исполнение, способы крепления. Выбор размера и материалов труб и отводов, предъявляемые технические требования.
- •31. Горелочные устройства, применяемые в трубчатых печах. Классификация, устройство и принцип действия.
- •32. Способы создания тяги в печах. Способы утилизации тепла уходящих газов.
- •33. Теплообменные аппараты. Общие сведения о процессе теплообмена. Требования предъявляемые к аппаратам. Классификация теплообменной аппаратуры.
- •34. Кожухотрубчатые теплообменники. Теплообменники жесткого типа. Преимущества и недостатки. Способы крепления трубной решетки к корпусу. Теплообменники с компенсатором.
- •35. Теплообменники нежесткой конструкции. Конструкция теплообменника с u-образными трубками.
- •36. Теплообменники с плавающей головкой. Особенности устройства и конструкции плавающих головок. Теплообменник типа «труба в трубе».
- •37. Аппараты воздушного охлаждения. Классификация и область применения. Конструктивное исполнение аво.
- •38. Классификация технологических трубопроводов. Категории трубопроводов. Назначение и применение.
- •39. Температурные деформации трубопроводов и способы их компенсации.
- •40. Трубопроводная арматура. Классификация. Особенности конструктивного и материального исполнения.
- •41. Основы массопередачи. Классификация процессов массообмена. Массообмен, массоотдача, массопередача. Диффузионный и конвективный механизмы массообмена. Равновесие и движущая сила массопередачи.
- •42. Уравнение массоотдачи, коэффициент массоотдачи. Уравнение массопередачи, коэффициент массопередачи. Материальный баланс массопередачи. Уравнение рабочей линии.
- •43 Средняя движущая сила массопередачи. Расчет средней движущей силы массопередачи. Число единиц переноса. Высота единицы переноса. Дифференциальное уравнение конвективной диффузии.
- •45 Расчет высоты массообменных аппаратов. Число теоретических ступеней изменения концентрации и высота эквивалентная теоретической ступени. Графический метод расчета числа теоретических тарелок.
- •48. Дистилляционные процессы. Физико-химические основы. Закон Рауля. Уравнение равновесной линии, относительная летучесть. Изображение процессов дистилляции на у-х и t-X-y диаграммах.
- •49 Простая перегонка, материальный баланс простой перегонки. Схемы фракционной и ступенчатой перегонки, перегонки с частичной дефлегмацией.
- •51. Насадочные и тарельчатые колонные аппараты, виды насадок и тарелок. Полые распылительные колонны, применяемые для абсорбции и экстракции. Пленочные абсорберы.
- •54 Назначение и основные принципы процесса Кристаллизации. Технические способы процесса Кристаллизации в промышленности. Какие типы аппаратов используются для осуществления процесса Кристаллизации.
- •56. Общие сведения о процессе отстаивания. Конструкция отстойников. Определение поверхности осаждения.
- •57. Разделение неоднородных систем в поле центробежных сил. Описание процесса центрифугирования. Устройство центрифуг. Разделение в циклоне.
- •58. Очистка сточных вод методом флотации. Виды и способы флотации. Конструкции флотационных установок.
- •59. Физические основы и способы очистки газов. Виды аппаратов газоочистки.
- •1. Гравитационная очистка газов.
- •2. Под действием сил инерции и центробежных сил.
- •4. Мокрая очистка газов
- •60. Понятие пограничного слоя. Ламинарный пограничный слой. Турбулентный пограничный слой. Профиль скорости и трение в трубах.
- •61. Общие требования к средствам дефектоскопического контроля
- •63. Классификация методов неразрушающего контроля.
- •64. Классификация оптических приборов для визуально-оптического контроля.
- •65 Сущность и классификация методов капиллярной дефектоскопии.
- •66. Область применения и классификация магнитных методов контроля.
- •67. Феррозондовый метод контроля
- •68. Область применения и классификация акустических методов контроля.
- •69. Область применения и классификация радиационных методов контроля.
- •70. Область применения и классификация вихретоковых методов контроля
48. Дистилляционные процессы. Физико-химические основы. Закон Рауля. Уравнение равновесной линии, относительная летучесть. Изображение процессов дистилляции на у-х и t-X-y диаграммах.
Дистилляция (distillatio — стекание каплями) — перегонка, разделение жид смесей на отличающиеся по составу фракции.
Основана на различии в составах жидкости и образования из нее паров. Дистилляция обычно осуществляется путем частичного испарения и последующей конденсации пара. Отогнанная фр (дистиллят Д) обогащена относительно более летучими (низкокипящими) компонентами, а не отогнанная жидкость (кубовый остаток) менее летучими (высококипящими).
Если из исходной отгоняется не одна фракция, а несколько , то такой дистиллят называется фракционной или дробной. В зависимости от условий процесса, дистилляция бывает молекулярной и простой.
Простая дистилляция — проводиться при таких р, когда длина свободного пробега молекул намного меньше, чем расстояние между поверхностями испаряющийся Ж и конденсацией пара. tтакого процесса опр-ся условиями фазового равновесия между Ж и паром. Если необходимо понизитьt, то применяют Д под вакуумом, с вод паром или инерт газами.
Аппараты, кот исп-ся при простой Д дел-ся на емкостные и пленочные. В емкостных аппаратах нах-ся большой объем Ж и происходит интенс перемещивание в результате кипения.
Молекулярная Д – основана на зависимости скорости испарения в-ва от его молекулярной mприtнижеtкипения Ж и низких р. При этом длина своб пробега молекул уже соизмерима с расстояниями между поверх конденсации пара и испар Ж. При этом молекулы соударяются от-но редко и двигаются незав друг от друга. Расход и состав паровой фазы оп-ря скоростями испарения отд компонентов. Но не один из процессов не дают возможность получить продукт с опр концентрации. Для получ продукт с опр концентрацией и высоким выходом ис-ся процесс ректификации
Закон Рауля связывает давление насыщенного пара над р-ром с его составом; он формулируется следующим образом:
Парциальное давление i-ого компонента в идеальном р-ре равен произв парц р насыщенных паров, при даннойt, на мольную концентрацию компонента в жид фазе. рi=Pixi, Р нас паров каждого комп вычисляетсч по формуле АнтуанаtgP=A-B/(C+t). А,В,С опр-ся экспериментально.
Ж начинае кипеть при t, при кото рой р ее насыщ паров =р внешн
среды.
π=∑рi=рнккх`+рвкк(1-х`). получаем уравнение для построения нижней изобары х`=(π- рвкк)/ (рнкк-рвкк). По з-ну Дальтона, парц р компонента газ смеси = произв р в системе на мольную долю компонента в газ смеси. При р=const,з-н Рауля-Дальтона: рi=Pixi= πуi, получаем уравнение верхней изобары у`=(рнккх`)/ π.
Уравнение равновесия фаз: для НКК - у`=(рнккх)/ π, ВКК – (1-у`)=(р2(1-х`))/ π. если разделить, р1/р2=α-получим коэффициент летучести. Уравнение равновесия фаз бинарной смеси и устанавливает зависимость между равновесными концентрациями в жидкой и паровой фазах.у`/(1- у`)=α(x`/(1-x`)). уравнение представляет собой гиперболу, изгиб которой зависит от α.
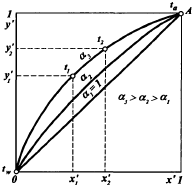
на х-у диаграмме построена кривая равновесия жидкой и паровой фазы при внешнем давление π при ta-w. полученные при разных температурtравновесные составы жидкойx` и паровойy` фаз при давление π могут быть представлены в системе координатt-x,y. по оси абсцисс отложениы концентрацииx` иy`, отвечающие разным температурамt.
![]()
