
- •Глава I. Физические основы механики
- •§ 1. Введение. Предмет физики. Методы физического исследования
- •§ 2. Роль физики в развитии техники и влияние техники на развитие физики
- •§ 3. Механика и её разделы. Система отсчета. Траектория, длина пути и вектор перемещения
- •§ 4. Скорость
- •§ 5. Ускорение и его составляющие
- •§ 6. Угловая скорость и угловое ускорение
- •Глава II. Динамика материальной точки
- •§ 7. Первый закон Ньютона.Масса. Импульс
- •§ 8. Второй закон Ньютона
- •§ 9. Третий закон Ньютона
- •§ 10. Закон сохранения импульса
- •§ 11. Принцип относительности Галилея. Преобразование Галилея
- •§ 12. Силы в механике
- •§ 13. Энергия. Работа и мощность
- •§ 14. Кинетическая и потенциальная энергия механической системы
- •§ 15. Закон сохранения и превращения энергии
- •§16. Удар абсолютно упругих и неупругих тел
- •Глава III. Механика твердого тела
- •§ 17. Момент инерции
- •§ 18. Кинетическая энергия вращения
- •§ 19. Момент силы. Основное уравнение динамики вращательного движения твердого тела
- •§ 20. Момент импульса и закон его сохранения
- •Глава IV. Основы молекулярной физики
- •§ 21. Основы молекулярно-кинетической теории газов
- •§ 22. Термодинамическое состояние тела
- •§ 23. Идеальный газ
- •§ 24. Уравнение состояния идеального газа
- •§ 25. Основное уравнение молекулярно-кинетической теории идеальных газов
- •§ 26. Скорости, характеризующие состояние газа
- •§ 27. Средняя длина свободного пробега молекул
- •§ 28. Явления переноса
- •Глава V. Основы термодинамики
- •§ 29. Внутренняя энергия термодинамической системы
- •§ 30. Число степеней свободы
- •§ 31. Первое начало термодинамики
- •§ 32. Работа газа при его расширении
- •§ 33. Теплоемкость
- •§ 34. Молярная теплоемкость при постоянном объеме
- •§ 35. Молярная теплоемкость при постоянном давлении. Уравнение Майера
- •§ 36. Применение первого начала термодинамики к изопроцессам
- •§ 37. Адиабатический процесс
- •§ 38. Политропические процессы
- •§ 39. Обратимые и необратимые процессы. Круговой процесс (цикл)
- •§ 40. Кпд кругового процесса
- •§ 41. Энтропия
- •§ 42. Второе начало термодинамики
- •§ 43. Третье начало термодинамики
- •§ 44. Тепловые двигатели и холодильные двигатели
- •§ 45. Теорема Карно.Цикл Карно
- •Глава VI. Реальные газы. Жидкости. Твердые тела
- •§ 46. Уравнение Ван-дер-ваальса
- •§ 47. Изотермы реальных газов
- •§ 48. Свойства жидкостей. Поверхностное натяжение
- •§ 49. Смачивание
- •§ 50. Капиллярность
- •§ 51. Явление капиллярности в быту, природе и технике
- •§ 52. Давление под искривленной поверхностью жидкости
- •§ 53. Кристаллические и аморфные твердые тела
- •§ 54. Изменение агрегатного состояния
- •§ 55. Фазовые переходы
- •§ 56. Диаграмма состояния
§ 55. Фазовые переходы
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
Переход вещества из одной фазы в другую – фазовый переход – всегда связан с качественными изменениями свойств веществ.
Фазовый переход первого рода – это переход, сопровождающийся поглощением или выделением теплоты (например, плавление, кристаллизация). Он характеризуется постоянством температуры, изменениями энтропии и объема.
Фазовый переход второго рода – переход не связанный с поглощением или выделением теплоты и изменением объема. Он характеризуется постоянством объема и энтропии, но скачкообразным изменением теплоемкости.
Примерами фазовых переходов второго рода: переход ферромагнитных веществ при определенных давлениях и температуре в парамагнитное состояние; переход металлов и сплавов при низких температурах в сверхпроводящее состояние; превращение обыкновенного жидкого гелия в сверхтекучий.
§ 56. Диаграмма состояния
Если система является однокомпонентной, т.е. состоящей из химически однородного вещества или его соединения, то понятие фазы совпадает с понятием агрегатного состояния.
Для наглядного изображения фазовых превращений используется диаграмма состояния, на которой в координатах (р,Т) (рис. 56.1) задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих поле диаграммы на три области, соответствующие условиям существования твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз.
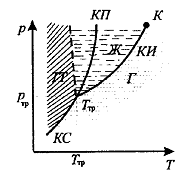
Рисунок 56.1
Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответствует условиям равновесия двух сосуществующих фаз.
Тройной точкой называется точка, в которой пересекаются кривые фазового равновесия и которая, следовательно, определяет условия (температуру Ттр и давление ртр) одновременного равновесного сосуществования трех фаз вещества.
Тройная точка воды соответствует температуре 273,16 К (или 0,010С по шкале Цельсия) и является основной реперной точкой для построения термодинамической температурной шкалы.
Анализ диаграммы состояния.
Диаграмма состояния, позволяет судит, в каком состоянии находится данное вещество при определенных риТ, а также какие фазовые переходы будут происходить в том или ином процессе.
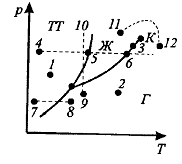
Рисунок 56.2
Например, при условиях, обозначенных: точкой 1 вещество – в твердом состоянии (ТТ), 2- в газообразном (Г), 3- одновременно в жидком (Ж) и газообразном.
При изобарном нагреве 4-5-6 в точке 5 начинается плавление, 6- кипение.
При изобарном нагреве 7-8 твердое тело превращается в газ, минуя жидкую фазу.
При изотермическом сжатии 9-10 вещество пройдет три состояния: газ-жидкость-кристалл.
Кривая испарения заканчивается критической точкой (К).поэтому возможен непрерывный переход вещества из жидкого состояния в газообразное и обратно в обход критической точки, без пересечения кривой испарения (переход 11-12),т.е. такой переход, который не сопровождается фазовымипревращениями.
Это возможно потому, что различие между газом и жидкостью является чисто количественным (оба эти состояния, например, являются изотропными).
Переход кристаллического состояния в жидкое или газообразное может быть только скачкообразным (в результате фазового перехода), поэтому кривые плавления и сублимации не могут обрываться, как это имеет место для кривой испарения в критической точке.
Кривая плавления уходит в бесконечность, а кривая сублимации идет в точкур=0 иТ=0.
ГРЕЧЕСКИЙ АЛФАВИТ
|
A |
α |
alpha |
альфа | |
|
B |
β |
beta |
бета | |
|
Г |
γ |
gamma |
гамма | |
|
Δ |
δ |
delta |
дельта | |
|
E |
ε |
epsilon |
эпсилон | |
|
Z |
ζ |
zeta |
дзета | |
|
H |
η |
eta |
эта | |
|
Θ |
θ |
theta |
тета | |
|
I |
ί |
iota |
йота | |
|
K |
κ |
kappa |
каппа | |
|
Λ |
λ |
lambda |
ламбада | |
|
M |
|
mu |
мю | |
|
N |
|
nu |
ню | |
|
|
ξ |
xi |
кси | |
|
O |
o |
omicron |
омикрон | |
|
П |
π |
pi |
пи | |
|
P |
ρ |
rho |
ро | |
|
Σ |
σ |
sigma |
сигма | |
|
T |
τ |
tau |
тау | |
|
|
υ |
upsilon |
ипсилон | |
|
|
φ |
|
phi |
фи |
|
Х |
χ |
chi |
хи | |
|
Ψ |
ψ |
psi |
пси | |
|
Ω |
ω |
omega |
омега | |


Список использованной литературы:
Савельев И.В. «Курс физики», т.1., - М.: Наука, 1989.
Трофимова Т.И. «Курс физики». – М.: Высшая школа, 2008.
Телеснин, Р.В. «Молекулярная физика»: учеб, пособие. – СПб: Лань, 2009.
