- •Глава I. Физические основы механики
- •§ 1. Введение. Предмет физики. Методы физического исследования
- •§ 2. Роль физики в развитии техники и влияние техники на развитие физики
- •§ 3. Механика и её разделы. Система отсчета. Траектория, длина пути и вектор перемещения
- •§ 4. Скорость
- •§ 5. Ускорение и его составляющие
- •§ 6. Угловая скорость и угловое ускорение
- •Глава II. Динамика материальной точки
- •§ 7. Первый закон Ньютона.Масса. Импульс
- •§ 8. Второй закон Ньютона
- •§ 9. Третий закон Ньютона
- •§ 10. Закон сохранения импульса
- •§ 11. Принцип относительности Галилея. Преобразование Галилея
- •§ 12. Силы в механике
- •§ 13. Энергия. Работа и мощность
- •§ 14. Кинетическая и потенциальная энергия механической системы
- •§ 15. Закон сохранения и превращения энергии
- •§16. Удар абсолютно упругих и неупругих тел
- •Глава III. Механика твердого тела
- •§ 17. Момент инерции
- •§ 18. Кинетическая энергия вращения
- •§ 19. Момент силы. Основное уравнение динамики вращательного движения твердого тела
- •§ 20. Момент импульса и закон его сохранения
- •Глава IV. Основы молекулярной физики
- •§ 21. Основы молекулярно-кинетической теории газов
- •§ 22. Термодинамическое состояние тела
- •§ 23. Идеальный газ
- •§ 24. Уравнение состояния идеального газа
- •§ 25. Основное уравнение молекулярно-кинетической теории идеальных газов
- •§ 26. Скорости, характеризующие состояние газа
- •§ 27. Средняя длина свободного пробега молекул
- •§ 28. Явления переноса
- •Глава V. Основы термодинамики
- •§ 29. Внутренняя энергия термодинамической системы
- •§ 30. Число степеней свободы
- •§ 31. Первое начало термодинамики
- •§ 32. Работа газа при его расширении
- •§ 33. Теплоемкость
- •§ 34. Молярная теплоемкость при постоянном объеме
- •§ 35. Молярная теплоемкость при постоянном давлении. Уравнение Майера
- •§ 36. Применение первого начала термодинамики к изопроцессам
- •§ 37. Адиабатический процесс
- •§ 38. Политропические процессы
- •§ 39. Обратимые и необратимые процессы. Круговой процесс (цикл)
- •§ 40. Кпд кругового процесса
- •§ 41. Энтропия
- •§ 42. Второе начало термодинамики
- •§ 43. Третье начало термодинамики
- •§ 44. Тепловые двигатели и холодильные двигатели
- •§ 45. Теорема Карно.Цикл Карно
- •Глава VI. Реальные газы. Жидкости. Твердые тела
- •§ 46. Уравнение Ван-дер-ваальса
- •§ 47. Изотермы реальных газов
- •§ 48. Свойства жидкостей. Поверхностное натяжение
- •§ 49. Смачивание
- •§ 50. Капиллярность
- •§ 51. Явление капиллярности в быту, природе и технике
- •§ 52. Давление под искривленной поверхностью жидкости
- •§ 53. Кристаллические и аморфные твердые тела
- •§ 54. Изменение агрегатного состояния
- •§ 55. Фазовые переходы
- •§ 56. Диаграмма состояния
Глава V. Основы термодинамики
§ 29. Внутренняя энергия термодинамической системы
Внутренняя энергияU – это энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов и т.д.) и энергия взаимодействия этих частиц.
К внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия – однозначная функция термодинамического состояния системы – в каждом состоянии система обладает вполне определенной внутренней энергией. Поэтому внутренняя энергия не зависит от того, каким образом система пришла в данное состояние.
При переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
§ 30. Число степеней свободы
Число степеней свободы – это число независимых переменных полностью определяющих положение системы в пространстве.
Число степеней свободы для идеального газа жестких молекул.
|
Число степеней свободы |
Одноатомный газ |
Двухатомный газ |
Многоатомный газ |
|
|
|
|
|
|
поступательных |
3 |
3 |
3 |
|
вращательных |
- |
2 |
3 |
|
всего |
3 |
5 |
6 |
В реальных молекулах нет жесткой связи между атомами в молекуле. Поэтому необходимо учитывать также степени свободы колебательного движения атомов внутри молекулы.
Независимо
от общего числа степеней свободы
молекулы. Три степени свободы всегда
поступательные. На каждую из них
приходится треть кинетической энергии
поступательного движения молекулы
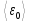 :
:
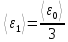 =
=
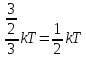 .
.
Закон
Больцмана о равномерном распределении
энергии по степеням свободы (закон
равнораспределения):для
системы, находящейся в состоянии
термодинамического равновесия на каждую
поступательную и вращательную степень
свобода приходится в среднем кинетическая
энергия, равная
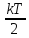 ,
а на каждую колебательную степень
свободы – в среднем энергия равнаkT.
Применим закон Больцмана к двухатомной
молекуле. Она обладает, как и одноатомная
молекула, тремя степенями свободы
поступательного движения. Но, кроме
того, она обладает еще двумя степенями
свободы вращательного движения
относительно двух взаимно перпендикулярных
осей, проходящих через центр тяжести
системы. Вращательная степень свободы
относительно оси, проходящей через
центры масс обоих атомов, не учитывается.
Так как кинетическая энергия вращения
относительно этой оси равна нулю.
,
а на каждую колебательную степень
свободы – в среднем энергия равнаkT.
Применим закон Больцмана к двухатомной
молекуле. Она обладает, как и одноатомная
молекула, тремя степенями свободы
поступательного движения. Но, кроме
того, она обладает еще двумя степенями
свободы вращательного движения
относительно двух взаимно перпендикулярных
осей, проходящих через центр тяжести
системы. Вращательная степень свободы
относительно оси, проходящей через
центры масс обоих атомов, не учитывается.
Так как кинетическая энергия вращения
относительно этой оси равна нулю.
Таким
образом, средняя энергия молекулы:
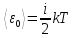 ,
,
где
i-
сумма числа поступательных, числа
вращательных и удвоенного числа
колебательных степеней свободы молекулы:
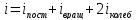 .
.
В
идеальном газе молекулы между собой не
взаимодействуют и их потенциальная
энергия равна нулю. Поэтому внутренняя
энергия одного моля идеального газа
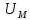 и произвольной массыm
газа U
будет соответственно:
и произвольной массыm
газа U
будет соответственно:
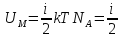 RT
RT
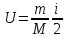 RT
=
RT
=
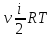 .
.
§ 31. Первое начало термодинамики
Первое начало термодинамики – это закон сохранения и превращения энергии в термодинамических процессах. Изменить внутреннюю энергию системы можно двумя способами : совершая над системой работу (например, сжимая газ в цилиндре с помощью поршня) или сообщая системе теплоту (например, нагревая газ в герметическом сосуде).
Рассмотрим замкнутую, макроскопически неподвижную систему не находящуюся во внешних силовых полях и проанализируем с энергетически точки зрения равновесный процесс перехода системы из какого-либо начального состояния 1 в другое состояние 2.
Изменение
внутренней энергии системы
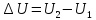 , в таком процессе равно разности между
количеством теплоты, полученным системой
и работой, совершенной системой против
внешних сил
, в таком процессе равно разности между
количеством теплоты, полученным системой
и работой, совершенной системой против
внешних сил
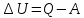 или
или
 (31.1)
(31.1)
Первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение её внутренней энергии и на совершение ею работы против внешних сил.
В
дифференциальной форме:
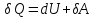 ,
(31.2)
,
(31.2)
Различие
в записи малого приращения внутренней
энергии
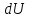 и элементарного количества теплоты δQ,
а также элементарной работы δA объясняется
следующим соображениями. Как уже
отмечалось, внутренняя энергия системы
является функцией ее состояния.Следовательно,
при любом процессе, в результате которого
система вновь возвратилась в некоторое
состояние, полное изменение ее внутренней
энергии равно нулю. Математически это
записываться в виде уравнения,
и элементарного количества теплоты δQ,
а также элементарной работы δA объясняется
следующим соображениями. Как уже
отмечалось, внутренняя энергия системы
является функцией ее состояния.Следовательно,
при любом процессе, в результате которого
система вновь возвратилась в некоторое
состояние, полное изменение ее внутренней
энергии равно нулю. Математически это
записываться в виде уравнения, 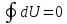 которое
является необходимым и достаточным
условием того, что внутренняя энергия
системы U представляя собой, так называемый
полный
дифференциал dU.
Работа и теплота такими свойствами не
обладают. Поэтому δQ и δА не
являются полными дифференциалами, эти
величины являются «Функциями процесса».
которое
является необходимым и достаточным
условием того, что внутренняя энергия
системы U представляя собой, так называемый
полный
дифференциал dU.
Работа и теплота такими свойствами не
обладают. Поэтому δQ и δА не
являются полными дифференциалами, эти
величины являются «Функциями процесса».
Все величины входящие в первое начало термодинамики могут быть, как положительными, так и отрицательными.
Если системе подводится теплота, то δQ>0, если от системы отводится теплота то δQ<0.