
- •Лекция 1 введение
- •1. Формальная кинетика
- •1.1. Общие понятия
- •1.2. Скорость химической реакции
- •1.3. Обратимые и необратимые реакции.
- •Лекция 2
- •Кинетическая классификация химических реакций
- •Порядок реакции
- •Реакции 1гопорядка Гомогенные реакции
- •Реакции второго порядка
- •Методы определения порядка реакции
- •Лекция 3 влияние температуры на скорость химической реакции
- •Энергия активации
- •Методы определения энергии активации:
- •Лекция 4 теория соударений
- •Теория активированного комплекса.
- •Кинетика гетерогенных химических реакций
- •Поверхность раздела
- •Лекция 5 природа поверхности раздела
- •Площадь поверхности раздела
- •Геометрия поверхности раздела
- •Лекция 6 диффузионно-кинетическая теория гетерогенного реагирования
- •Выбор моделей процессов гетерогенного реагирования
- •Лекция 7.
- •Лекция 8
- •Диффузия газа через пограничную пленку, как лимитирующая стадия процесса.
- •Лекция 9
- •Скорость процессов при уменьшении размеров сферических частиц.
- •Кинетика гетерогенных химических реакций, сопровождающихся образованием твердого продукта реакции.
- •Лекция 11.
- •Кинетические модели топохимических реакций.
- •Лекция 12 кинетические уравнения, выведенные на основании представлений о цепном механизме развития реакций
- •Реакции газ - твердое адсорбционно-химические стадии гетерогенных химических реакций
- •Лекция 13 Хемосорбция
- •Теория адсорбции лЭнгмюра.
- •Лекция 14 Методы исследования кинетики гетерогенных реакций газ – твердое.
- •Характеристика методов и их аппаратурного оформления.
- •Лекция 15
- •Техника экспериментальных термогравиметрических исследований кинетики реакций твердое - газ:
- •Неизотермическая кинетика
- •Лекция 16 Гетерогенные процессы в системе «газ –жидкость» (газожидкостные реакции)
- •Описание массопередачи между газом и жидкостью.
Лекция 11.
Точное решение Валенси.(1935-1936гг.)
В приведенных нижет уравнениях используются следующие значения:
r0– первоначальный радиус;
r1– радиус непрореагировавшего ядра;
r2–r1– толщина слоя продукта;
I– число молей реагирующего вещества, диффундирующего за время;
С – концентрация реагента;
Ci– концентрация реагента на поверхности раздела фаз;
W0– первоначальная масса;
W– масса непрореагировавшего ядра;
R – плотность реагирующего вещества;
Р– плотность продукта;
МR– молекулярная масса реагирующего вещества;
MP– молекулярная масса продукта;
N– число молей реагирующего вещества;
n– стехиометрический коэффициент;
VR– мольный объем реагирующего вещества;
VP– мольный объем продукта.
(прореагировавшая доля) = (W0–W)/W0;z= (1/n)(VP/VR).
r0


 r1
r1










 r
r
r2
Рисунок 28. Образование непористых продуктов реакции.
Из закона диффузии Фика:
![]() ;
;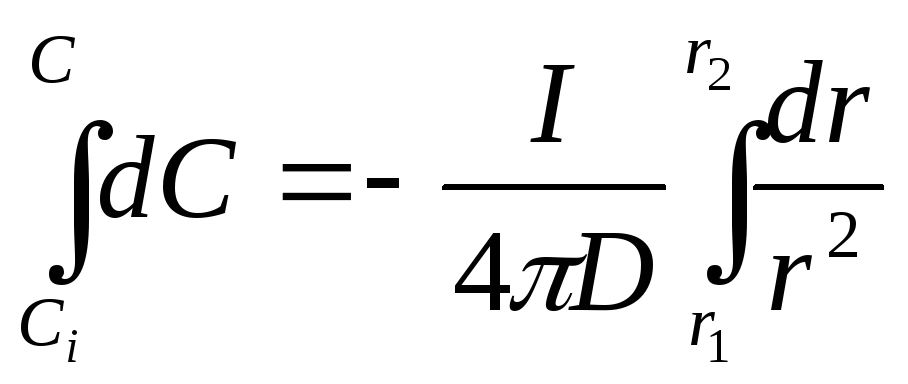
![]() ;
;![]() ,
,
Для процесса, контролируемого диффузией, Ci=0, следовательно:
![]() .
.
Если количество реагента непрерывно пополнять, то С– величина постоянная.
Скорость изменения WпропорциональнаI, потоку реагента, диффундирующего через сферическую оболочку толщинойr2 – r1:


 (117)
(117)
Количество расходующихся молекул равно числу образующихся молекул, умноженному на стехиометрический коэффициент:
 ,
,
 ,
,![]()
Следовательно:

![]() (118)
(118)
Следует отметить, что если z=1, тоr2=r0. Подставляем значениеr2из уравнения (118) в уравнение (117):
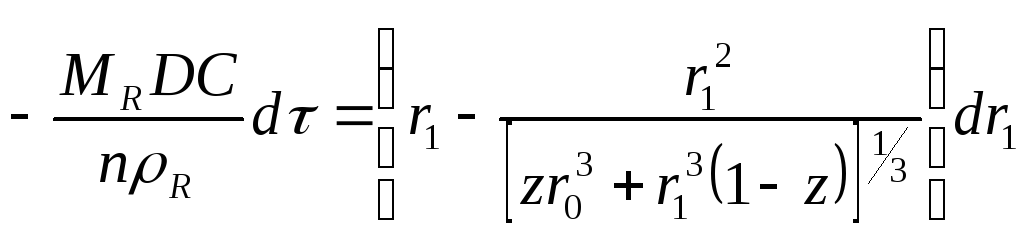 (119)
(119)
Интегрируя уравнение (119) в пределах от r0доr1для= 0 и=, получим
 ,
,
![]() ,
,
![]() (120)
(120)
 ,
,![]() .
(121)
.
(121)
Подставляя значение r1в видев уравнение (120), получим:
 (122)
(122)
Разделим уравнение (122) на r02
![]()
 (123)
(123)
График правой части уравнения (123) относительно будет представлен прямой линией. Это уравнение справедливо до полного завершения реакции.
Если z= 1, уравнение Валенси упрощается
 (124)
(124)
Упрощенное уравнение (124) было выведено Кранком (1957) и Гинстлингом и Броунштейном (1950). Случай с цилиндрической формой образца был рассмотрен Картером (1963г.).




 1,52
1,52
1
2
1,40
1,32
0 5 10 15 20 25
Время, ч
Рисунок 29. Кинетика реакции 2Ni+O2= 2NiOпо Валенси:
1 – d= 74 мкм,t= 10400C; 2 –d= 149 мкм,t= 11300C.
Итак, для реакций контролируемых диффузмей через непористый твердый продукт (реагирующее вещество имеет сферическую форму), существуют несколько уравнений:
Приближенное уравнение Яндера

Уравнение Кранка – Гинстлинга – Броунштейна, хотя и не вполне точно, применимо в большинстве случаев

Уравнение Валенси точное
![]()
Для облегчения расчетов кинетических данных для любых значений прореагировавшей доли графики функций :
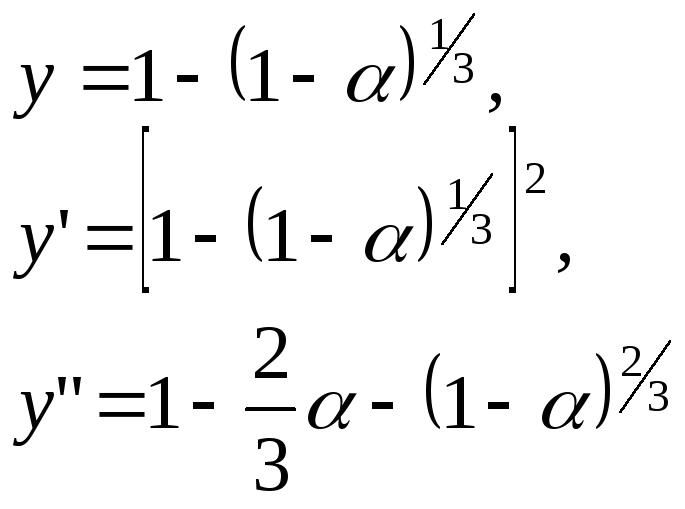
приведены на рисунке 30.


 1,0
1,0
y
0,5
 1
1
2
3
0 0,5 1,0
Прореагировавшая доля
Рисунок 30. Графики различных кинетических уравнений:

