
Ответы к экзамену 1
.pdf1. Объем, свойства и состав крови. Гематокритное число. Основные функции крови.
Объем крови – 4-6 л ( 6-8 % от массы тела ). У женщин крови приблизительно на 1-1,5 л меньше, чем у мужчин. Количество циркулирующей крови соответствует 60-70 мл/кг массы тела.
Свойства крови:
1)Все форменные элементы и большинство составных частей плазмы образуются за пределами сосудистого русла
2)Межклеточное вещество ткани является жидким
3)большая часть крови находится в постоянном движении
Физ-хим св-ва крови: Дополнительный материал
1.Цвет крови определяется наличием в эритроцитах гемоглобина.
2. Относительная плотность крови колеблется от 1.052 до 1.062 и зависит преимущественно от содержания эритроцитов. Определяется концентрацией белков и составляет 1.029- 1.032.
3.Вязкость крови определяется по отношению к вязкости воды и соответствует 4-5. Зависит от содержания эритроцитов и в меньшей степени от белков плазмы. Вязкость венозной крови больше, чем артериальной., что связано с поступлением в эритроциты СО2, благодаря чему увеличивается их размер. Может возрастать при опрожнении депо крови, повышается при обильном белковом питании.
4. Осмотическое давлениесила, которая заставляет переходить растворитель через полупроницаемую мембрану из менее в более концентрированный раствор. Равно 7.3-7.6 атм. Зависит от растворенных в ней низкомолекулярных соединений, главным образом солей.
5.Онкотическое давление зависит от содержания крупномолекулярных соединений( белков) в растворе. Зависит от альбуминов( 80%), что связано с их относительно малой молекулярной массой и большим количеством молекул в плазме. Играет важную роль в регуляции водного обмена. Чем больше величина, тем больше воды удерживается в сосудистом русле и тем меньше ее переходит в ткани. ОД влияет на образование тканевой жидкости, лимфы, мочи и всасывание воды в кишечнике. Поэтому кровезамещающие растворы должны содержать коллоидные вещества, способные удерживать воду. При снижение конц.белка в плазме развиваются отеки, т.к. вода перестает удерживаться в сосуд.русле и переходит в ткани.
6.Температура крови во многом зависит от интенсивности обмена веществ того органа, от которого она оттекает, и колеблется в пределах 37-40 градусов.
7. Концентрация водородных ионов и регуляция рН крови. В норме 7.36, слабоосновная.
Кровь выполняет следующие функции:
1)трофическую — перенос питательных веществ ко всем клеткам и тканям;
2)дыхательную — газообменную, или транспорт кислорода к тканям и удаление из организма углекислоты;
3)защитную (фагоцитоз, выработка антител);
4)гуморальную — транспорт гормонов и других гуморальных факторов регуляции;
5)гомеостатическую — поддержание физико-химического постоянства состава внутренней среды организма.
6)экскреторную – транспорт продуктов обмена
7)терморегуляционную.
Состав крови.
Кровь состоит из жидкой части ( плазмы ) и форменных элементов ( эритроцитов, лейкоцитов, тромбоцитов).
У взрослого человека: 36-46% форменных элементов, 54-64% плазмы.
Гематокритное число (ГЧ), гематокрит – количество форменных элементов крови, выраженное в процентах от общего количества крови. Гематокрит в норме при нормоцитемии (т. е. при нормальном содержании форменных элементов в крови) у мужчин равен 44-48 %, у женщин - 41-45 %.
Гематокритное число - это количество форменных элементов крови (в %) от общего объёма крови. Соотношение плазмы и форменных элементов определяется при помощи прибора гематокрита.
Средняя величина нормального гематокрита для мужчин находится в промежутке 40 – 48%, а для женщин в промежутке 36 – 46%. Норма для новорождённых 40-60%, для детей от 2-х мес до 4 лет 30-41%, с 4-х лет и старше 34-43%. У пожилых людей гематокрит достигает минимального уровня.
2.Объем, состав и свойства плазмы крови. Белки плазмы крови, их функции.
Объем плазмы 54-64% от состава крови.
Плазма – жидкая, слегка опалесцирующая часть крови желтого цвета.

Состав: соли (электролиты), белки, липиды, углеводы, продукты обмена, гормоны, ферменты, витамины и растворенные в ней газы. Электролитный состав плазмы представлен катионами Na+, K+, Ca2+, Mg2+, Fe3+, Zn2+ и Cu2+., анионами Cl-, HCO3-, HPO4-, HSO4-, органическими кислотами и анион-протеинатами.
Минеральные вещества плазмы составляют около 0,9 %. Важной составной частью плазмы являются белки, содержание которых составляет 7-8%.

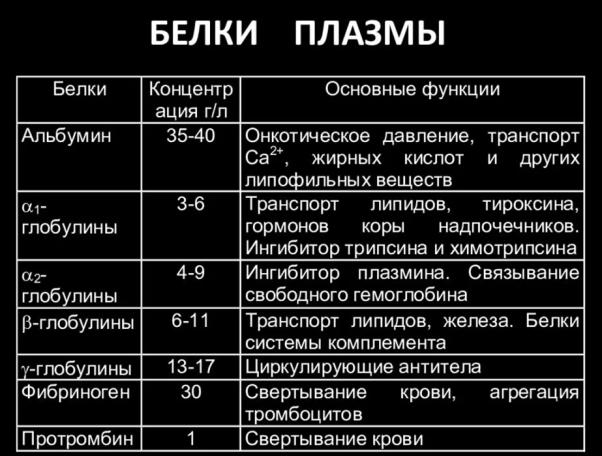
Функции белков плазмы крови:
1)регуляция водно-солевого обмена, поддержание осмотического давления и водного гомеостазиса за счет онкотического давления плазмы крови;
2)поддержание агрегатного состояния крови, ее вязкости, свертываемости, суспензионных свойств;
3)поддержание кислотно-щелочного равновесия;
4)защитная функция (антитела – иммуноглобулины);
5)питательные функции крови как резерв аминокислот;
6)регуляторная и транспортная (перенос жирных кислот, стероидных гормонов и др.).
3.Постоянство рН крови. Буферные системы крови, принципы
осуществления их |
функций. |
Постоянство pH крови поддерживается буферными системами: гемоглобиновой, карбонатной, фосфатной и белки плазмы.
Самая мощная – буферная система гемоглобина. Обеспечивает 75% буферной емкости крови.
Буферная система гемоглобина – включает восстановленный гемоглобин (HHb) и калиевую соль восстановленного гемоглобина (KHb).
Буферные свойства системы обусловлены тем, что KHb – соль слабой кислоты, отдает K+ и присоединяет при этом H+, образуя слабодиссоциированную кислоту:
H+ + KHb=K+ + HHb
Величина pH крови, притекающей к тканям, благодаря восстановленному гемоглобину, способному связывать CO2 и H+, остается постоянной. В этих условиях HHb выполняет функции основания. В легких гемоглобин ведет себя как кислота (оксигемоглобин, HHbO2, является более сильной кислотой, чем углекислота), что предотвращает защелачивание крови.
Карбонатная буферная система (H2CO3/NaHCO3) занимает второе место.
Принципы осуществления ее функций:
NaHCO3 диссоциирует на Na+ и HCO3-, и если в кровь поступает кислота более сильная, чем H2CO3, то происходит обмен Na+ c образованием слабодиссоциированной и легкорастворимой H2CO3, что предотвращает повышение концентрации H+ в крови. Увеличение концентрации H2CO3 приводит к ее распаду на воду и CO2 (фермент карбоангидраза). CO2 поступает в легкие и выделяется в окружающую среду. Если в кровь поступает основание, то оно реагирует с H2CO3, образуя натрия гидрокарбонат (NaHCO3) и воду, что препятствует сдвигу pH в щелочную сторону.
Фосфатная буферная система образована натрия дигидрофосфатом (NaH2PO4) и натрия гидрофосфатом (Na2HPO4). Первый – слабая кислота, вторая – соль слабой кислоты. Если в кровь попадает более сильная кислота, то она реагирует с Na2HPO4, образуя нейтральную соль и увеличивая количество малодиссоциируемого NaH2PO4:
Na2HPO4 + H2CO3 = NaHCO3 + NaH2PO4
При этом избыточное количество натрия дигидрофосфата будет удаляться с мочой, поэтому NaH2PO4 и Na2HPO4 не изменится.
Если в кровь ввести сильное основание, то оно будет взаимодействовать с натрия дигидрофосфатом, образуя слабоосновный натрия гидрофосфат. При этом pH крови изменится крайне незначительно. В данной ситуации избыток натрия гидрофосфата выделится с мочой.
Белки плазмы крови играют роль буфера, ибо обладают амфотерными свойствами, благодаря чему в кислой среде ведут себя как основания, а в основной – как кислоты.
Основные принципы работы белковой буферной системы:
1.Амфотерность белков: Белки являются амфотерными соединениями, то есть, они могут проявлять свойства как кислот, так и оснований. Это обусловлено наличием в их составе аминокислот, которые содержат как кислотные (карбоксильные, -COOH) группы, так и основные (аминогруппы, -NH ) группы.
2.Диссоциация аминокислот: В зависимости от pH среды, аминокислоты могут диссоциировать, образуя:
•Анионы (отрицательно заряженные): В щелочной среде (-COOH группы отдают H , становясь -COO ).
•Катионы (положительно заряженные): В кислой среде (-NH группы присоединяют
H , становясь -NH ).
3.Способность связывать ионы H :
•При избытке H (ацидоз), аминогруппы белков связывают эти ионы, образуя -NH ,
тем самым уменьшая кислотность среды.
•При недостатке H (алкалоз), карбоксильные группы белков отдают H , становясь
-COO , тем самым увеличивая кислотность среды.
Механизм действия в зависимости от pH среды:
•В кислой среде (ацидоз):
•Аминокислоты в составе белков действуют как основания, связывая избыток ионов
H .
R-NH + H R-NH
• Это ведет к уменьшению концентрации свободных ионов H и увеличению pH среды.
•В щелочной среде (алкалоз):
•Аминокислоты в составе белков действуют как кислоты, отдавая ионы H . R-COOH R-COO + H
•Это ведет к увеличению концентрации свободных ионов H и уменьшению pH среды.
Основные белки, участвующие в буферной системе:
1.Гемоглобин: Основной буфер эритроцитов. Гемоглобин обладает способностью связывать H , образующиеся при метаболизме, а также транспортирует CO , который также влияет на pH.
2.Белки плазмы крови: Альбумины, глобулины и фибриноген также участвуют в
буферном действии плазмы.
3.Клеточные белки: Внутри клеток также содержится большое количество белков,
способных связывать H .
Значение белковой буферной системы:
1.Быстрая коррекция pH: Белковая буферная система действует быстро, немедленно
реагируя на изменения pH среды.
2.Регуляция pH в крови: Особенно важную роль играет в крови, где обеспечивает поддержание pH в узком диапазоне (7.35-7.45).
3.Регуляция pH внутри клеток: Белки цитоплазмы также способствуют поддержанию pH внутри клеток.
4.Взаимодействие с другими буферными системами: Белковая буферная система взаимодействует с другими буферными системами организма, такими как
бикарбонатная, фосфатная и гемоглобиновая, обеспечивая стабильность pH.
4.Количество и функции и эритроцитов. Скорость оседания эритроцитов и факторы, влияющие на нее. Количество и функции гемоглобина, его соединения. Цветовой показатель крови.
Количество эритроцитов в норме: у мужчин в норме 4-5 х 10^12/л; у женщин не превышает 4,5х10^12/л. При беременности число может достигать 3,5 или 3,2х10^12/л
Функции эритроцитов:
1.Транспорт гемоглобина, который переносит О2 и СО2
2.Транспорт белков, гормонов, БАВ, и некоторых лекарственных средств
3.Обеспечение вязкости крови
4.Формирование иммунных свойств крови (группы крови по системе АВС и резус)
5.Регуляция эритропоэза(фосфолипиды разрушенных мембран эритроцитов активируют эритропоэз)
Гемолизом называется выход гемоглобина в плазму в результате разрыва оболочки эритроцитов. В искусственных условиях гемолиз может быть вызван помещением эритроцитов в гипотонический раствор. Степень устойчивости эритроцитов в гипотоническом растворе оценивается как их осмотическая резистентность (устойчивость). Различают минимальную и максимальную границы осмотической резистентности. Для здоровых людей минимальная граница соответствует раствору, содержащему 0,42 —0,48 % NаСl, полный же гемолиз (максимальная граница) происходит при концентрации 0,30—0,34 % NаСL.
Причины гемолиза.
Гемолиз может быть вызван химическими агентами (хлороформ, эфир, сапонин и др.), разрушающими мембрану эритроцитов. В клинике нередко встречается гемолиз при отравлении уксусной кислотой.
1.Гемолизирующими свойствами обладают яды некоторых змей (биологический
гемолиз).
2.При сильном встряхивании ампулы с кровью также наблюдается разрушение мембраны эритроцитов — механический гемолиз. Механический гемолиз иногда возникает при длительной ходьбе из-за травмирования эритроцитов в капиллярах стоп.
3.Если эритроциты заморозить, а потом согреть, то возникает термический гемолиз.
4.Наконец, при переливании несовместимой крови и наличии аутоантител к эритроцитам развивается иммунный гемолиз. Последний является причиной возникновения анемии и нередко сопровождается выделением гемоглобина и его производных с мочой (гемоглобинурия).

Гемоглобин состоит из белковой(глобин) и железосодержащей( гем) частей; на одну молекулу глобина приходится 4 молекулы гема. 130-170 у мужчин; 120-150 г/л у женщин.
Функция: транспорт О2 и СО2. Кроме того, гемоглобин обладает буферными свойствами, а также способностью связывать некоторые токсические вещества.
Гем состоит из молекулы порфирина, в центре которой расположен ион железа(2+), способный присоединять кислород. Структура белковой части гемоглобина человека неоднородна , благодаря чему белковая часть разделяется на ряд фракций. Большая часть гемоглобина взрослого человека состоит из фракции А(98%), 2% приходится на фракцию А2. Наконец в эритроцитах взрослого человека находится фетальный гемоглобин(F), содержание редко превышает 1-2%( преимущественно у плода).
Гемоглобин обладает способностью образовывать соединения с О2, СО2 и СО. Гемоглобин, присоединивший О2, называется оксигемоглобин( HHbO2); гемоглобин, отдавший О2, называется восстановленным или редуцированный гемоглобином( HHb). В артериальной крови преобладает оксигемоглобин, цвет приобритает алую окраску. В венознойредуцированный. Гемоглобин, связавший СО2карбогемоглобин, благодаря чему переносится 10-20% всего СО2.
Гемоглобин способен создавать прочную связь с СОкарбоксигемоглобин.
Сильные окислители( пероксид, ферроцианид) изменяют заряд железа на 3+, возникает окисленный гемоглобинпрочное соединение гемоглобина с О2метгемоглобин. Нарушает транспорт кислорода.
Цветовой показатель:
