- •21.Система. Фаза. Компонент. Параметры системы. Правило фаз Гиббса.
- •22. Функции состояния: внутренняя энергия и стандартная энтальпия образования химических веществ.
- •23. Первое начало термодинамики. Теплота, работа. Закон Гесса. Следствия из закона Гесса. Термохимические расчёты.
- •24. Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Теплоёмкость.
- •25. Второе начало термодинамики. Понятие об энтропии. Расчет энтропии. Изменение энтропии при химических процессах и фазовых переходах.
23. Первое начало термодинамики. Теплота, работа. Закон Гесса. Следствия из закона Гесса. Термохимические расчёты.
Первое начало термодинамики - один из трех основных законов термодинамики, представляющий собой закон сохранения энергии для систем, в которых существенное значение имеют тепловые процессы.
Согласно первому началу термодинамики, термодинамическая система (например, пар в тепловой машине) может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Энергия не может ни создаваться, ни исчезать, но может превращаться из одной формы в другую.
Первое начало термодинамики объясняет невозможность существования вечного двигателя 1-го рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Сущность первого начала термодинамики заключается в следующем:
При сообщении термодинамической системе некоторого количества теплоты Q в общем случае происходит изменение внутренней энергии системы DU и система совершает работу А:
Q = DU + A (4)
Уравнение (4), выражающее первое начало термодинамики, является определением изменения внутренней энергии системы (DU), так как Q и А — независимо измеряемые величины.
При исследовании термодинамических свойств физической систем первое начало термодинамики обычно применяется совместно со вторым началом термодинамики.
Если над системой не совершают работу, то система совершает сама.
Q = DU - A
Теплота - форма передачи энергии от одной части системы к другой вследствие неупорядоченного движения молекул, зависящая лишь от температуры частей системы. Является функцией системы.
Q>0 - подведенная теплота, Q<0 - отведенная теплота.
Работа - энергия, передаваемая одним телом другому при их взаимодействии, не зависящая от температуры и не связанная с переносом вещества от одного тела к другому.
Первое начало термодинамики - представляет собой закон сохранения энергии, для термодинамических систем, в которых необходимо учитывать термические, массообменные и химические процессы, является одним из всеобщих законов природы.
Первое начало термодинамики формулируется, полной энергией изолированной системы является постоянной; так же невозможен вечный двигатель первого рода (двигатель, совершающий работу без затраты энергии).
Первый закон термодинамики, утверждает, что изменение внутренней энергии ΔU системы, равно сумме совершаемой над системой работы A' внешних сил и количества теплоты Q, переданного системе извне.
|
|
Этот закон можно сформулировать иначе, если вместо работы A' внешних сил говорить о работе A самой системы. Поскольку A' = – A, то
|
|
таким образом, полученное системой количество теплоты равно сумме изменения ее внутренней энергии и работы, совершаемой системой над внешними телами.
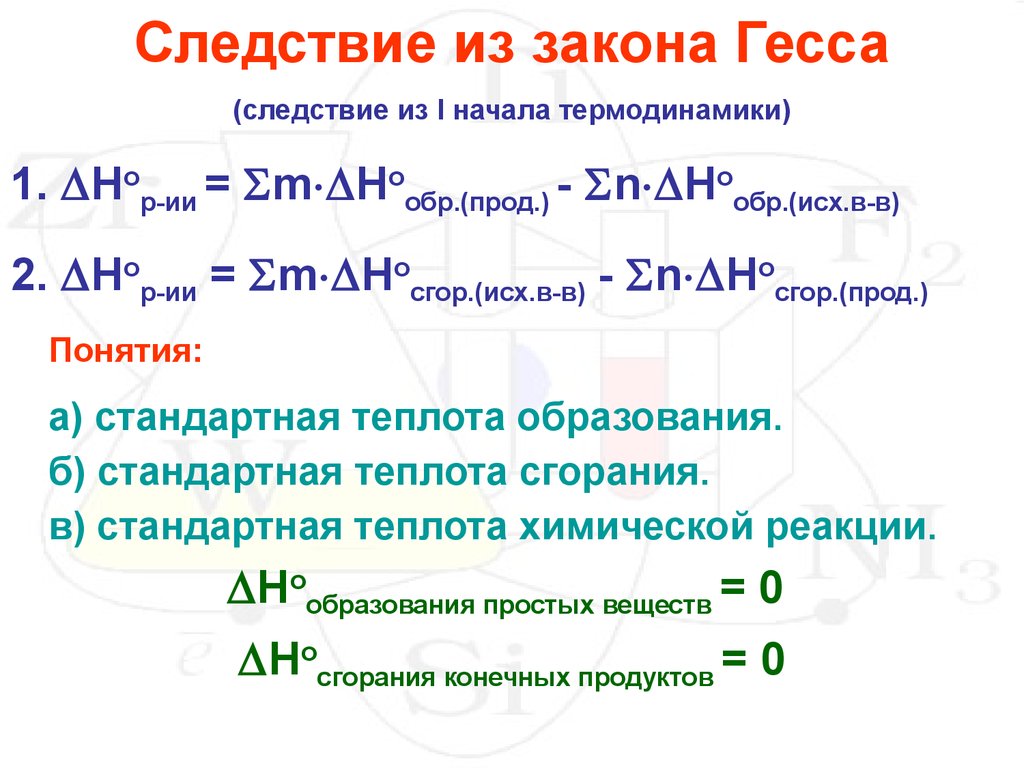
Закон Гесса (основной закон термохимии):
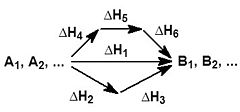
Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е от числа и характера промежуточных стадий. (общие приращения энтальпии при переходе начальных веществ в продукты реакции не зависят от того, через какие промежуточные стадии прошла реакция. Закон Гесса позволяет рассчитать тепловые эффекты или приращение энтальпии только при стандартных условиях (р = 1 атм = 105 Па, Т = 273 К + 25 = 298 К).
Первое следствие из Закона Гесса:
Тепловой эффект реакции равен разности между суммой теплот горения исходных веществ и суммой теплот горения продуктов реакции с учетом стехиометрических коэффициентов.
Теплота горения - тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов соответствующих элементов или соединений этих оксидов Теплота образования - тепловой эффект реакции образования данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию элементов при данных температуре и давлении.
Второе следствие из Закона Гесса:
Тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ с учетом стехиометрических коэффициентов.
В связи с тем, что тепловые эффекты реакции зависят от условий (температура, давление) их проведения, то в целях единообразия условились относить температуры теплот образования к температуре 298 К и давлению 1 атм.
Изменения энергии системы, при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения, называется тепловым эффектом химической реакции.
Закон Гесса – тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий.
В термохимических расчетах применяют следствие из Закона Гесса:
Тепловой эффект реакции равен сумме теплот образования (ΔH0обр) продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнениях реакции
ΔНх.р. = ∑Δ Н обр.прод.- ∑ΔН0обр.исх.(2).
Правило Гесса – основано на законе термохимии, который формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и НЕ зависит от пути её протекания. Количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий.
Закон Гесса в наши дни применяется для расчета термодинамических функций-энтальпий, которые сейчас используются для термохимических расчетов.
Пример химического процесса превращения исходных вещ-в, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi
Термохимические расчёты.
Энтальпия химических реакций равна сумме энтальпий образования продуктов реакций за вычетом суммы энтальпий образования веществ исходных с учетом их стехиометрических коэффициентов.
Тепловой эффект реакции:
bВ + dD = lL + mМ (2.11)
рассчитывается по уравнению:
ΔrН 0 = l D¦Н 0 (L) + m D¦Н 0 (M) – d D¦Н 0(D) – b D¦Н 0(B).
Термохимические уравнения – химические уравнения, записанные с указанием теплового эффекта реакции и агрегатного состояния веществ.
Стандартная энтальпия образования. Следствия из закона Гесса.
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного молявещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях
обозначается - ΔHfO.
Стандартные условия –
значения температуры и давления, при которых определяются,
или к которым
приводятся
значения различных количественных характеристик веществ, зависящих от давления и
температуры (например, электродные потенциалы, скорости звука и т. д.)
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 76 кДж/моль.
Энтальпия образования простых веществ принимается равной нулю, причем нулевое знанние энтальпииобразования относится к агрегатному состоянию, устойчивому при
T = 298K. Например, для йода вкристаллическом состоянии ΔHI2(тв)0 = 0 кДж/моль,
а для жидкого:ΔHI2(ж)0 = 22 кДж/моль.
Энтальпииобразования простых веществ при стандатных условиях являются их основными энергетическимихарактеристиками.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов исуммой теплот образования всех реагентов в данной реакции (следствие закона Гесса):
ΔHреакцииO = ΣΔHfO (продукты)
- ΣΔHfO (реагенты)
Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указаноколичество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиемя выделением тепла в окружащию среду,имеют отрицательный тепловой эффект иназываются экзотермическими.
Реакции, сопровождающиеся поглощением тепла имеют положительныйтепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю проеагировавшего исходного вещества, стехиометрический коэффициент которого максимален.
Следствия из закона Гесса:
}Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции и (закон Лавуазье — Лапласа).
![]()
Тепловой эффект химической реакции равен разности сумм теплоты образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.