
- •1. Назовите процессы, относящиеся к группе массообменных процессов. Какие из них направлены на разделение многокомпонентных систем? Принцип разделения, лежащий в основе этих процессов.
- •2. Понятие фазового равновесия. Статическое и динамическое равновесие. Основные законы фазового равновесия: правило фаз Гиббса, законы Генри, Дальтона, Рауля.
- •3. Основной закон массоотдачи. Каков физический смысл коэффициента массоотдачи?
- •4. Основные критерии диффузионного подобия и их физический смысл. Использование критериальных уравнений конвективной диффузии в расчетной практике.
- •5. Основной закон массопередачи. Физический смысл коэффициента массопередачи, расчет его величины.
- •6. Определение коэффициента распределения и его физический смысл.
- •7. Определение мольных объемов газов и жидкостей.
- •8. Расчет коэффициента диффузии газа в жидкости.
- •9. Уравнение материального баланса процесса осушки воздуха серной кислотой в скруббере.
- •10. Методика расчета минимальных расходов жидкого поглотителя компонентов газовой смеси.
- •11. Определение основных характеристик слоя насадки.
- •12. Что является движущей силой любого массообменного процесса?
- •13. Каким законом описывается молекулярная диффузия?
- •14. Каким образом можно влиять на движущую силу массообменных процессов?
- •15. Какое уравнение связывает коэффициенты массоотдачи и массопередачи?
- •16. Как влияют температура и давление на абсорбцию?
- •17. Конструктивные особенности абсорбционных колонн.
- •18. Характеристика промышленных адсорбентов.
- •19. Сущность процесса адсорбции? Уравнение материального баланса процесса.
- •Материальный баланс адсорбции
- •20. Методика определения коэффициента массоотдачи.
- •21. Критериальное уравнение для расчета скорости газового потока в адсорбере с псевдоожиженным слоем адсорбента.
- •22. Суть процесса простой перегонки. Дайте определение процесса ректификации.
- •2 3. Сформулируйте первый закон Коновалова.
- •24. Что является движущей силой процесса ректификации?
- •25. Уравнение линии рабочих концентраций верхней части колонны.
- •26. Уравнения материального баланса ректификационной колонны непрерывного действия.
- •28. Понятие флегмового числа. Уравнения для расчета минимального и рабочего флегмового числа.
- •29. Расчет высоты тарельчатой ректификационной колонны.
- •30. Определение скорости пара в насадочной ректификационной колонне.
- •31. Пути совершенствования конструкции тарелок ректификационных колонн.
- •32. Конструктивные особенности насадочных ректификационных колонн.
- •33. Изобразите графический способ определения числа тарелок ректификационной колонны.
- •34. Новые виды насадок. Требования к насадке ректификационной колонны.
- •35. Сущность процесса экстракции. Движущая сила процесса.
- •36. Расчет высоты единицы переноса в насадочном экстракторе.
- •37. Изображение изменения концентрации распределяемого компонента на у — х диаграмме. Расчет средней движущей силы.
- •3 8. Практическое использования треугольной диаграммы.
- •3 9. Как называется равновесная кривая на треугольной диаграмме состояния для экстракции?
- •40. Какой процесс называется экстрагированием? Основные конструкции экстракторов.
- •41. Пути совершенствования конструкции экстракторов.
- •42. Сущность процесса кристаллизации. Способы кристаллизации.
Вопросы к экзамену:
1. Назовите процессы, относящиеся к группе массообменных процессов. Какие из них направлены на разделение многокомпонентных систем? Принцип разделения, лежащий в основе этих процессов.
К процессам, направленным на разделение многокомпонентных систем, относятся практически все массообменные процессы. Они перечислены далее. Эти процессы характеризуются вещества из одной фазы в другую. Такие процессы называют диффузионными.
1. Абсорбция – избирательное поглощение компонентов газовой смеси жидким поглотителем (абсорбентом).
2. Адсорбция – избирательное поглощение газов, паров или растворенных в жидкости веществ поверхностью пористого твердого тела (адсорбентом). Разновидностью адсорбции является ионный обмен, основанный на способности некоторых твердых веществ (ионитов) обменивать свои подвижные ионы на ионы растворов электролитов.
3. Десорбция – процесс обратный абсорбции и адсорбции, т.е. процесс, направленный на выделение поглощенных жидкостью или твердым телом компонентов газовой смеси.
4. Перегонка и ректификация – частичное или полное разделение гомогенных жидких смесей на компоненты в результате различия их летучести и противоточного взаимодействия жидкости и пара.
5. Экстракция (в системе жидкость-жидкость) – извлечение вещества, растворенного в жидкости, другой жидкостью, практически не смешивающейся с первой.
6. Экстрагирование (в системе твердое тело-жидкость) – извлечение вещества из твердого пористого тела с помощью растворителя.
7. Кристаллизация – выделение твердой фазы в виде кристаллов из пересыщенных растворов или расплавов.
8. Растворение – переход твердой фазы в жидкую, т.е. процесс обратный кристаллизации.
9. Мембранные процессы – разделение жидких и газообразных смесей на составляющие компоненты с использованием полупроницаемых перегородок. Под мембранами в широком их понятии называют фильтрующие перегородки с размерами пор, приближающимися к размеру молекул.
2. Понятие фазового равновесия. Статическое и динамическое равновесие. Основные законы фазового равновесия: правило фаз Гиббса, законы Генри, Дальтона, Рауля.
Равновесие – такое термодинамическое состояние системы, которое при постоянной температуре и давлении не изменяется во времени или такое термодинамическое состояние системы, при котором скорости прямого и обратного процессов равны. Т.о., из данного определения следует, что равновесие может быть статическим и динамическим.
К основным законам фазового равновесия относятся правило фаз Гиббса, законы Генри, Дальтона, Рауля.
Правило фаз Гиббса характеризует условия, при которых могут сосуществовать несколько фаз. Состояние любой системы определяется следующими основными параметрами: температурой, давлением и составом.
По правилу фаз Гиббса число степеней свободы процесса С равно числу компонентов К минус число фаз плюс 2, т.е.
С = К – Ф + 2.
Здесь С – число степеней свободы, под которым понимают число независимых термодинамических параметров фаз системы, находящейся в равновесии, имеющих возможность принимать произвольные значения без исчезновения старых и без образования новых фаз.
Для
абсорбционно-десорбционных процессов
равновесие между газами и их растворами
в жидкости описывается законом
Генри.
Согласно этому закону, количество газа,
растворяющегося в жидкости при данной
температуре, прямо пропорционально
давлению газа над ней. Классическая
формулировка закона Генри звучит
следующим образом:
равновесное парциальное давление
растворяемого газа
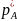 пропорционально его мольной доле
пропорционально его мольной доле
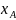 в растворе
в растворе
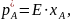
где Е – константа Генри, Па.
[Парциальное давление компонента газовой смеси – давление данного компонента газовой смеси при условии, что этот компонент занимает весь объем смеси].
Общее давление смеси газов согласно закону Дальтона равно сумме парциальных давлений составляющих ее компонентов
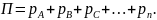
Из закона Дальтона
следует, что мольная или объемная доля
любого компонента смеси идеальных газов
равна
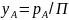 или при равновесии
или при равновесии
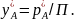
В случае идеальных смесей жидких компонентов фазовое равновесие подчиняется закону Рауля: парциальное давление компонента в паре над жидкостью равно давлению пара чистого компонента, умноженного на его мольную долю в жидкости
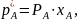
где
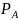 – давление насыщенного пара данного
чистого компонента при определенной
температуре (справочная величина).
– давление насыщенного пара данного
чистого компонента при определенной
температуре (справочная величина).
Если подставить
значение
из этой формулы в уравнение
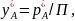 получим уравнение
Рауля-Дальтона.
получим уравнение
Рауля-Дальтона.
