
ПРОГНОЗИРОВАНИЕ
ТРУДНОГО ДЫХАТЕЛЬНОГО ПУТИ
Причины
возникновения трудного дыхательного
пути
Существуют
различные причины, способствующие
возникновению трудной масочной
вентиляции, ларингоскопии и интубации
трахеи. По данным
О. Langeron
et al. [1]
(провели анализ 1500 анестезий), частыми
причинами возникновения трудной
масочной вентиляции являются:
возраст
старше 55 лет;
индекс
массы тела (индекс Кетле) выше 26;
наличие
бороды;
отсутствие
зубов;
храп.
В.
Finucane
&
A.
Santora (2003)
[2] дополняют перечень следующими
факторами:
анатомическая
диспропорция рта или носа;
плохой
доступ извне ко рту или носу;
несоответствующее
оборудование для масочной вентиляции;
обструкция
ДП;
наличие
астмы в анамнезе;
пневмоторакс;
плевральный
выпот;
ларингоспазм;
бронхоспазм.
Поэтому
в целом причины трудной ларингоскопии
и интубации условно можно разделить:
на
клинические;
анатомические;
связанные
с патологией ВДП.
В
число клинических причин можно отнести
имевшие место интубации и трахеостомии
в анамнезе, респираторные заболевания
(синдром сонного апноэ, стридор),
нарушения гемостаза (особенно при
необходимости назотрахеальной ИТ),
сахарный диабет I типа, беременность
(III триместр), ожирение, кифосколиоз,
отсутствие возможности лежать на спине
[3-5], а также акромегалия [6].
15Часть 2
К
патологиям ВДП относят врожденные и
приобретенные заболевания костных,
хрящевых и мягкотканных структур,
окружающих ВДП. Это проблемы с зубами
(мосты, пломбы, протезы, отсутствующие
зубы); артриты (заболевания ВНС,
анкилозирующий спондилит, ревматоидный
артрит); травмы, переломы костей лицевого
черепа, шейного отдела позвоночника;
ожоги, последствия лучевой терапии
(рубцы и фиброз в области шеи), опухоли,
инфекции, отеки; а также гематомы лица,
рта, глотки, гортани и шеи [3-5].
Анатомические
особенности структур, образующих ВДП,
на этапе вводной анестезии или во
время критической ситуации могут быть
причинами непредвиденного ТДП. К ним
относятся [3-5]:
аномалии
гортани (фиксация гортани к другим
структурам шеи, костям или дну рта);
макроглоссия
(большой язык),
глубокая
узкая ротоглотка;
выступающие
вперед резцы и клыки;
короткая
и толстая шея;
микрогнатия
(маленькая нижняя челюсть);
увеличение
передней или задней глубины нижней
челюсти;
маленькое
раскрытие рта.
По
данным некоторых авторов, наличие в
основании языка эктопической ткани
щитовидной железы может стать причиной
кровотечения при ларингоскопии и
привести к трудностям с обеспечением
проходимости ДП. Эта аномалия встречается
очень редко — 1:100 000 случаев [7]. Следует
особо отметить, что популярный среди
современной молодежи пирсинг также
может являться причиной ТДП, так как
предполагает зачастую наличие в ротовой
полости различных металлических или
пластмассовых предметов [8-9]. Отек в
области складок голосовой щели в
результате хронического гастроэзофагального
рефлюкс-синДрома может осложнить
визуализацию ларингоскопической
картины при ИТ. Вероятность подобного
осложнения высока в связи с увеличением
из года в год количества больных с
абдоминальной патологией [10].
Доказано,
что частота встречаемости ТДП выше у
мужчин, тучных людей и увеличивается
с возрастом (критический возраст от 40
до 60 лет) [11].
В
акушерской практике такие факторы, как
увеличение веса и размеров молочных
желез, высокая кровоточивость слизистой
полости рта, отек глотки и гортани,
могут значительно затруднять поддержание
проходимости ВДП на всех этапах
[12].
16
Особенности анатомии ВДП |
Большой язык. Высокое стояние гортани и надгортанника. Узкий надгортанник. Угол 45° между гортанью и надгортанником. Отсутствие зубов. Узкая голосовая щель. Короткие ДП |
Черепно-лицевые проблемы |
Синдром Pierre Robin (микрогнатия, макроглоссия). Синдром Treacher Collins (нижнечелюстная и скуловая гипоплазия, арочное нёбо, нёбная расщелина). Синдром Goldenhar (окулоаурикуловертебральная дисплазия, лицевая гемигипоплазия, нижнечелюстная гипоплазия, врожденные болезни сердца, аномалия шейного отдела позвоночника). Синдром Crouzon’s (экзофтальм, гипостения, краниосиностоз с гипопластической нижней челюстью) |
Дефект лизосомального фермента |
Мукополисахаридоз (развитие прогрессирующего уплотнения тканей) |
Врожденные опухоли |
Кистозная гигрома (с вовлечением языка, гортани и шеи). Гемангиома (с вовлечением верхних и нижних отделов ДП) |
Височно- нижнечелюстные проблемы |
Болезнь Still’s (анкилоз суставов шейного отдела позвоночника). Синдром Cockayne-Touraine (преждевременное старение сустава с анкилозом) |
Приобретенная патология (ограничение открывания рта вследствие фиброза) |
Термическая травма. Абсцессы (зубной, шейный, ретрофарингеальный). Опухоли (внутриротовые или лицевые). Постлучевое поражение |
В
основе причин ТДП лежат различные
клинико-анатомические механизмы
(табл. 2.2) [14].
17
Причина |
Примеры |
Первичный механизм |
Нарушение анатомического соотношения |
ДП по Mallampati класс 3. Синдром Дауна. «Срезанный» подбородок. Очень короткое расстояние между щитовидным хрящом и подбородком. Слишком короткое расстояние между подбородком и подъязычной костью |
Диспропорция связана с увеличением размера корня языка, гортань располагается кпереди относительно к другим структурам ВДП |
Смещение, обусловленное внутренними факторами |
Опухоль гортани. Отек гортани |
Стеноз и отклонение в результате влияния внутренних или внешних факторов и/или их сочетания |
Смещение, обусловленное внешними факторами |
Зоб. Опухоль основания языка. Послеоперационная гематома шеи |
|
Снижение подвижности в челюстных суставах |
Синдром Klippel - Feil (врожденный синостоз шейных позвонков, или «человек без шеи»). Анкилозирующий спондилит. Ревматоидный артрит |
Сопротивление выравниванию оси |
Неправильный прикус |
Вероятно, является одним из важных факторов, особенно у больных с ВДП класс 2-3 по Mallampati |
Рис.
2.1.
Варианты смещения голосовых связок
(1), верхних зубов (2) и языка (3), приводящие
к нарушению визуализации голосовых
связок и трудности интубации по
классификации Cormack
&
Lehane
[15]
18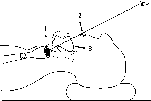
При
ларингоскопии для надежной интубации
обзор голосовых связок должен быть
четким. Трудности могут встречаться,
если голосовые связки, верхние зубы,
язык смещаются в направлениях, указанных
на рис. 2.1. Даже без патологии трудности
могут возникать из-за различных
вариантов нормальной анатомии [15].
В. Finucane
&
A.
Santora (2003)
[2] сформулировали три интегральные
причины трудной ларингоскопии и ИТ:
Ограниченный
доступ к ротоглотке или носоглотке —
любое заболевание или состояние,
которое ограничивает доступ ларингоскопа
в ротоглотку или носоглотку и может
помешать интубации.
Плохая
визуализация гортани — невозможность
визуализации голосовой щели после
введения ларингоскопа в ротоглотку и
отведения мягких тканей.
Уменьшенная
область гортани и трахеи — в некоторых
случаях, несмотря на отсутствие проблем
с открытием рта или обзором гортани,
невозможно продвинуть трубку в трахею.
Прогнозирование
возникновения трудного дыхательного
пути
Анестезиолог
должен предвидеть возникновение любых
трудностей во время анестезии или
какой-либо неотложной ситуации. Известно,
что такие стандартные мероприятия,
как подробный анализ анамнеза болезни
и жизни, внимательный, объективный
осмотр и дополнительные исследования
(при необходимости) пациента, достаточно
информативны. Выявление отдельных
признаков, указывающих на риск
возникновения ТДП, использование
тестов, их комбинаций позволяют с
определенной степенью точности
предположить те случаи, когда обеспечение
проходимости ДП может стать затруднительным.
Во время осмотра пациента отдельные
признаки можно обнаружить при
исследовании:
двигательной
функции суставов лицевого черепа;
особенностей
строения ВДП;
подвижности
шейного отдела позвоночника;
сопутствующих
заболеваний (например, сахарный диабет).
В
1991 г. J.
Davies [16]
предложил системный подход к оценке
ДП (табл. 2.3). Это эффективный подход,
позволяющий клиницистам сфокусировать
свое внимание на выявлении признаков
возможного ТДП.
19
Компоненты |
Описание |
Оценка |
Нижняя челюсть |
Длина и подвывих |
Измеряют подподбородочное расстояние и переднее смещение нижней челюсти |
Открытие рта |
Основание, симметрия, диапазон |
Оценивают и измеряют открытие рта в сантиметрах |
Нёбный язычок |
Видимость |
Оценивают и классифицируют структуры глотки и гортани |
Зубы |
Зубной ряд |
Оценивают наличие отсутствующих зубов и зубных приспособлений |
Голова и шея |
Сгибание, разгибание, ротация головы / шеи и шейного отдела позвоночника |
Оценивают все диапазоны движения |
Телосложение |
Аномалии верхней части тела, спереди и сзади |
Идентифицируют возможное воздействие на обеспечение проходимости ДП различных аномалий телосложения |
Исследование
двигательной функции ВНС помогает
определить степень раскрываемости
рта. При помещении средних пальцев рук
позади и ниже мочек уха пациента, а
указательных пальцев — впереди козелков
пациент широко открывает рот. Исследователь
должен почувствовать два движения:
первое — вращательное, а второе —
продвижение головки мыщелка (рис. 2.2).
Щелканье и крепитация указывают на
дисфункцию этого сустава [17]. Взрослый
пациент также может вставить в ротовую
полость три пальца, что соответствует
максимальному (на 50-60 мм) открытию
нижней челюсти [18]. Если взрослый
пациент может вставить в рот не более
2 пальцев, то налицо ограничение раскрытия
рта и максимальное (менее 30 мм) открытие
нижней челюсти. Данный признак
предполагает трудную ларингоскопию и
интубацию [2].
Также
двигательную функцию ВНС можно проверить
тестом «выпячивание нижней челюсти».
По просьбе врача пациент максимально
выдвигает вперед нижнюю челюсть, затем
картина классифицируется следующим
образом:
20
Класс
А: Нижние резцы достают выше уровня
верхних резцов.
Класс
В: Нижние резцы достают только до уровня
верхних резцов.
Класс
С: Нижние резцы не достают до уровня
верхних резцов.
Рис.
2.2.
Исследование двигательной функции ВНС
(Finucane &
Santora,
2003)
Отрицательный
тест может быть связан с трудной
ларингоскопией и трудной масочной
вентиляцией [1,19].
Иранские
авторы предложили идентичную классификацию
[20]:
Класс
1: Резцы нижней челюсти достают выше
ярко-красной каймы верхней губы.
Класс
2: Резцы нижней челюсти достают ниже
ярко-красной каймы верхней губы.
Класс
3: Резцы нижней челюсти не достают
верхнюю губу.
Соответствие
теста классу 2-3 предполагает трудную
ИТ. Размеры и форма нижней челюсти
имеют большое значение в прогнозировании
ТДП.
При
ретрогнатии и микрогнатии (врожденные
синдромы Treacher
Collins и
Pierre
Robin) расстояние
от симфиза до угла нижней челюсти может
быть менее 9 см, что является признаком
предстоящей трудной интубации [3-5].
21
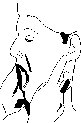
Измерение
расстояний от подбородка до щитовидного
хряща и грудины также информативно.
Признаки предстоящей трудной интубации:
тиро- ментальное расстояние по средней
линии (индекс Патила) при полностью
разогнутом атлантозатылочном суставе
менее 6,5 см (или менее 3 поперечных
пальцев) [21], стерноментальное расстояние
у взрослых пациентов менее 12,5 см [22], а
у беременных менее 13,5 см [23].
Степень
подвижности трахеи влияет на визуализацию
голосовой щели. Относительная
неподвижность трахеи может стать
причиной трудной интубации [24], а
неподвижность гортани и подъязычной
кости в результате кальцификации
может помешать поднять надгортанник
клинком Макинтоша [25-27].
Деформации,
сокращение длины шейного отдела
позвоночника (синдром Klippel
—
Feil
или
уменьшение количества шейных позвонков)
делают прямую ларингоскопию трудной
или невозможной [24]. Короткая, мускулистая,
толстая шея с ограниченным диапазоном
движения гораздо хуже поддается
разгибанию, чем нормальная податливая
или удлиненная шея [2]. Подвижность
в атлантоокципитальном сочленении в
норме соответствует углу более 35°, если
угол менее 30° — возможны трудности
[28,29]. Оценку подвижности атлантозатылочного
сочленения можно сделать, оценив угол
пересечения зубов верхней челюсти при
разогнутой шее (рис. 2.3) [28].
Рис.
2.3.
Оценка подвижности атлантозатылочного
сочленения (Finucane
&
Santora,
2003)
У
пациентов с сахарным диабетом в 30-40%
случаев возникает синдром ограничения
подвижности суставов из-за гликолизации
белковой ткани вследствие хронической
гипергликемии [30]. Частота трудных
интубаций у пациентов, длительно
страдающих сахарным диабетом, в 10 раз
выше, чем у нормальных, здоровых
пациентов, и связана с ограничением
подвижности суставов лицевого черепа
и шейного отдела позвоночника. Для
определения данного синдрома
необходимо выполнить простой тест:
ладони пациента путем соприкосновения
формируют «жест просящего» (рис. 2.4).
При этом пациент не может выпрямить
межфаланговые суставы четвертого
22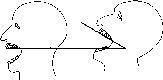
и
пятого пальцев. При изучении отпечатков
ладони выявлена прямая зависимость
выраженности отпечатка и ларингоскопической
картины (рис. 2.5) [31]. Прогностическая
значимость метода определения отпечатка
ладони пациентов с сахарным диабетом
— 100% [32].
Рис.
2.4.
«Жест просящего» (Finucane
&
Santora,
2003)
л
Л
Г'»
Г'»
9
а
и
Рис.
2.5.
Зависимость ларингоскопической картины
от отпечатка ладони пациента с сахарным
диабетом по Е. Reissell,
1990
[31]
Примечание:
А — полный отпечаток ладони пациента,
ларингоскопия легкая; Б — дефицит в
межфаланговых областях четвертого и
пятого пальцев, условия ларингоскопии
по Cormack
&
Lehane
соответствуют
степени I; В — изменения распространены
на межфаланговые области второго и
третьего пальцев, условия ларингоскопии
по Cormack
&
Lehane
—
степени II; Г — отпечаток ладони,
показывающий только кончики пальцев
(степень III
по
Cormack
&
Lehane),
в
этом случае для интубации может
понадобиться несколько попыток
ларингоскопии и проводник для
эндотрахеальной трубки.
Широко
распространена и популярна шкала,
предложенная S.
Mallampati в
1983 г. [33] и модифицированная затем Samsoon
&
Young
в
1987 г. [34]. Тест предусматривает классификацию
анатомии ВДП по степени визуализации.
Выполняется просто: осматривают
структуры ротовой полости
23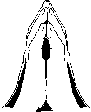

пациента,
который сидит прямо с максимально
широко раскрытым ртом и высунутым
вперед языком (рис. 2.6). Трудная интубация
предполагается при классе 3-4.
Рис.
2.6.
Визуализация анатомических структур
ротовой полости по Mallampati
в
модификации Samsoon
& Young
[33, 34]
Примечание:
Класс 1 — видны мягкое нёбо, зев, язычок,
миндалины; Класс 2 — видны мягкое нёбо,
зев, язычок; Класс 3 — видны мягкое нёбо,
основание язычка; Класс 4 — мягкое нёбо
не видно.
К
сожалению, прогностическая значимость
шкалы Mallampati
низка.
По последним сведениям, анатомия ВДП
по шкале Mallampati
класса
3 соответствует ларингоскопической
картине по Cormack
&
Lehane
степени
III-IV
не
более чем в 21 % случаев, а класс 4 по
Mallampati
—
IV степени по Cormack
&
Lehane
не
более чем в 4,7% [2]. Поэтому в прогнозировании
ТДП полагаться только на шкалу Mallampati
нельзя.
В
последние десятилетия не прекращаются
исследования в систематизации причин
ТДП, поиске путей решения проблемы
безошибочного прогнозирования
трудной интубации. Составляются и
внедряются различные комбинированные
шкалы, учитывающие совокупность
различных анатомических признаков
и тестов. Высокая эффективность и
прогностическая значимость их доказана
на практике. Наиболее распространенные
шкалы предложены М. Wilson
(1988),
A.
El-Ganzouri (1996),
ASA
(1996,2002,2003),
М. Janssens
(2001),
G.
Iohom (2003).
M.
Wilson et al. [35], проанализировав
1500
интубаций,
разработали и ввели шкалу прогнозирования
трудной ИТ, состоящую из пяти факторов
риска. К ним относятся: масса тела
пациента, способность выдвижения вперед
нижней челюсти, разгибаемость шеи в
атлантоаксиальном сочленении,
степень недоразвития нижней челюсти,
наличие или отсутствие выступающих
передних зубов. При предоперационном
осмотре каждый имеющийся фактор риска
оценивается в 1-2 балла. При 3 баллах
предполагается риск трудной ИТ до
75 % случаев, при 4 — до 90 %. В большинстве
случаев данная шкала предсказывает
трудную интубацию, но часто
Класс
1
Класс
2
Класс
3
Класс
4
24
Компонент осмотра |
Факторы риска |
Длина верхних резцов |
Слишком длинные |
Резцы верхней и нижней челюсти при обычном закрытии |
«Избыточный» прикус |
Взаимоотношения между резцами челюстей при выдвижении нижней челюсти вперед резцов верхней |
Неспособность выдвинуть резцы нижней челюсти |
Расстояние между резцами при полном открытии рта |
< 3 см |
Визуализация язычка при осмотре полости рта |
Язычок не виден |
Форма нёба |
Высокое, сводчатое или узкое |
Растяжимость нижнечелюстного пространства |
«Одеревеневшее», занятое образованиями или неэластичное |
Тироментальное расстояние (индекс Патила) |
< 3 поперечных пальцев |
25
Компонент осмотра |
Факторы риска |
Длина шеи |
Короткая |
Толщина шеи |
Толстая |
Объем движений головы и шеи |
Ограничен вперед-назад |
Предлагаемая
М. Janssens
et al. [39]
балльная шкала также призвана
объективизировать ожидаемые
трудности при поддержании проходимости
ВДП (табл. 2.5). Эта шкала предполагает
суммацию отдельных показателей
от 4 до 15 баллов по пяти признакам
трудной ИТ. Результат от 8 и более
баллов свидетельствует о возможной
трудной ИТ. В настоящее время проводятся
исследования с целью доказательства
клинической ценности данной концепции.
Таблица
2.5
Рейтинговая
шкала оценки воздухоносных путей по
М. Janssens
[39] |
Баллы |
||
1 |
2 |
3 |
|
Индекс Патила, см |
>6 |
5-6 |
<5 |
Класс по Mallampati |
1 |
2 |
3-4 |
Раскрытие рта, см |
4 |
2-3 |
1 |
Подвижность шеи |
В норме |
Снижена |
Фиксированное сгибание |
Верхние резцы |
Отсутствуют |
В норме |
Выступающие |
Недавнее
исследование 212 интубаций [22] предполагает
100% трудную ИТ при наличии у пациентов
комплекса следующих признаков:
анатомия
ДП класса 3-4 по Mallampati;
тироментальное
расстояние менее 6,5 см;
стерноментальное
расстояние менее 12,5 см;
ограничение
разгибания шеи менее 35°.
Определить
их достаточно просто при предоперационном
осмотре, но нельзя забывать, что по
отдельности указанные признаки имеют
низкую ценность.
В
определении предвестников трудной ИТ
информативны дополнительные методы
исследования. Осмотр отоларинголога
путем непрямой ларингоскопии
(включающий осмотр гортани при помощи
ларингеального
26
зеркала
или фиброоптического ларингоскопа
перед анестезией) позволяет определить
характер и степень любого анатомического
отклонения и наличие заболевания.
Непрямая ларингоскопия позволяет
прогнозировать трудную интубацию
с высокой точностью. Проведенная
непрямая ларингоскопия у 6000 пациентов
перед ИТ показала специфичность этого
метода в 98,4% случаев [40]. При УЗИ-исследовании
мягких претрахеаль- ных тканей было
установлено, что толщина их свыше 28 мм
коррелирует с трудной ларингоскопией
[41]. Рентгенография лицевой части черепа,
шейного и грудного отдела позвоночника,
а также компьютерная (КТ) и
магнитно-резонансная томография (МРТ)
расширяют диагностические возможности
определения признаков предстоящей
трудной ИТ [29, 42].
Перед
предстоящей интубацией очень важно
провести полную оценку ВДП, хотя при
чрезвычайных обстоятельствах это не
всегда возможно. Из- за недостаточной
прогнозирующей способности большинства
тестов перед анестезиологом стоит
задача выбора: использовать один или
несколько? Полная оценка ДП не всегда,
а только в 98% случаев может предсказать,
какой будет интубация. Непредвиденный
ТДП — критическая ситуация, приводящая
(если не действовать быстро и правильно)
к инвалидизации и смерти [2, 43].
Каждое
лечебное подразделение или отдельный
анестезиолог должны иметь клинические
и организационные решения для ведения
ТДП и возможность альтернативы, даже
если для этого придется задерживать
операцию. Выработка правильного
плана поддержания проходимости ВДП
возможна только после полной оценки
ДП. Наличие оборудования и навыков
обращения с ним, знание и выполнение
алгоритмов выхода из различных
ситуаций — основа безопасности жизни
пациента и юридической защиты врача.
На сегодняшний день известно до 22
способов и устройств поддержания
проходимости ВДП [44], а также различные
варианты алгоритмов ведения ТДП.
Список
основной литературы
Langeron
О.
et
al.
Prediction of difficult mask ventilation//Anesthesiology. 2000; 92
(5):
1229-1236.
Principles
of airway management/Eds. В.
T.
Finucane, A. H. Santora. Springer-Verlag.
2003.
P. 214-255.
Miller
R. D.
ed. Anesthesia. 2nd ed. New York: Churchill-Livingstone. 1986. P.
233-234.
Gordon
R. A.//Int.
Anesthesiol. Clin. 1972; 10: 37.
Liu
P. L.
Principles and Procedures. Philadelphia: JB Lippincott. 1992.
Schmitt
H. et al.
Difficult intubation in acromegalic patients//Anesthesiology. 2000;
93:
110-114.
27
Buckland
R.W., Pedley J.
Lingual thyroid a threat to the airway// Anesthesia. 2000; 55:
1103-1105.
Brown
D. C.
Anesthetic considerations of a patient with a tongue piercing and a
safe solution//Anesthesiology. 2000; 93: 307.
Rosenberg
A. D. et al.
Tongue rings: just say no//Anesthesiology. 1998; 89: 1279.
Stevens
L. Chronic gastroesophageal reflux disease and its effect on
laryngeal visualization and intubation: a case report//AANA J.
2002; 70 (5): 373-375.
Rose
D. К.,
Cohen
М.
M.
The Airway: Problems And Predictions In 18500 Patients// Can. J.
Anaesth. 1994; 41 (5): 372-383.
Бирнбах
Д.
Дж.
Анестезия у рожениц высокой группы
риска//Актуальные проблемы
анестезиологии и реаниматологии. Вып.
8/Под ред. Э. В. Недашковского. Архангельск:
Правда Севера, 2003. С. 208-216.
Cardwell
М.,
Walker
R. W.
М.
Management
of the difficult paediatric airway//British Journal Anaesthesia
2003; 3. (6): 167-170.
Карманный
справочник анестезиолога/Под ред. В.
А. Гологорского, Б. Р. Гельфан- да. М.:
Медицина, 1998.
Cormack
R. S., Lehane J.
Difficult intubation in obstetrics//Anaesthesia. 1984; 39:
1105-1111.
Davies
J.
MOUTHS//Can.
J. Anaesth. 1991; 38: 687-688.
Block
C., Brechner
V. L.
Unusual problems in airway management: the influence of the
temporomandibular joint, the mandible and associated structures and
endotracheal intubation//Anesth. Analg. 1971; 50: 114.
Posselt
U.
Physiology of Occlusion and Rehabilitation. 2nd ed. Oxford:
Blackwell, 1968.
Colder
I.у
Calder
J., Crockard H. A.
Difficult direct laryngoscopy in patients with cervical spine
disease//Anaesthesia. 1995; 50: 756-763.
Khan
Z. H., Kashfi A., Ebrahimkhani E.
A comparison of the upper lip bite test (a simple new technique)
with modified Mallampati classification in predicting difficulty in
endotracheal intubation: a prospective blinded study//Anesth.
Analg. 2003; 96 (2): 595-599.
Patil
V. U., Stehling
L. C., Zaunder
H.
L. Fiberoptic Endoscopy in Anesthesia. 1st ed. Chicago: Year Book,
1983.
Iohom
G., Ronayne
М.,
Cunningham
A. J.
Prediction of difficult tracheal intubation// European Journal of
Anaesthesiology. 2003; 20: 31-36.
Ramadhani
S. A. L. et al.
Sternomental distances a sole predictor of difficult laryngoscopy
in obstetric anesthesia//Br. J. Anaesth. 1996; 77: 312-316.
Keenan
M. A., Stiles С.
М., Kaulman
R. L.
Acquired laryngeal deviation associated with cervical spine disease
in erosive polyarticular arthritis//Anesthesiology. 1983; 58: 441.
Sherwood-Smith
G. H.
Difficulty in intubation: calcified stylohyoid ligament//
Anaesthesia. 1976; 31: 508-510.
Akinyemi
О.
O.,
Elegbe
E. O.
Difficult laryngoscopy and tracheal intubation due to calcified
stylohyoid ligaments//Can Anaesth. Soc. J. 1981; 28: 80-81.
Walls
R. D. et al.
Difficult intubation associated with calcified stylohyoid
ligament// Anaesth. Intens. Care. 1990; 18: 110-126.
Bellhouse
C. P., Dore
C.
Criteria for estimating likelihood of difficulty of endotracheal
intubation with Macintosh laryngoscope//Anaesth Intensive Care.
1988; 16: 329-337.
Norton
M. L, Wilton
N., Brown A.
C. D. The difficult airway//Anesthesiology Review. 1988; 15: 25-28.
28
Salazarulo
Н.
Я., Taylor
L. A.
Diabetic Stiff Joint Syndrome as a cause of difficult endotracheal
intubation//Anesthesiology. 1986; 64: 366-368.
Reissell
E. et al.
Predictability of difficult laryngoscopy in patients with long term
diabetes mellitus//Anaesthesia. 1990; 45: 1024-1027.
Nadal
J. L. Y. et al.
The palm print as a sensitive predictor of difficult laryngoscopy//
Acta Anaesthesiol. Scand. 1998; 42: 199-203.
Mallampati
S. R.
Clinical signs to predict difficult tracheal intubation
[hypothesis] //
Can
Anaesth. Soc J. 1983; 30: 316-317.
Samsoon
G. L. Т.,
Young
J. R. B. Difficult tracheal intubation: a retrospective study//
Anaesthesia. 1987; 42.
Wilson
М.
E.
et al.
Predicting difficult intubation//British Journal of Anaesthesia.
1988; 61: 211-216.
Wilson
М.
E.
Predicting difficult intubation [editorial]. Br. J. Anaesth.
1993;71:333-334.
El-Ganzouri
A. R. et al.
Preoperative airway assessment: predictive value of a multivariate
risk index//Anesth. Analg. 1996; 82: 1197-1204.
Practice
Guidelines for Management of the Difficult Airway. An Updated
Report bay the American Society Anesthesiologists Task Force on
Management of the Difficult Airway//Anesthesiology. 2003; 98 (5).
Janssens
М.,
Hartstein
G. Management of difficult intubation//European Journal of
Anaesthesiology. 2001; 18 (1): 3-12.
Yamamoto
K. et al.
Predicting difficult intubation with indirect laryngoscopy//
Anesthesiology. 1997; 86: 316-321.
Ezri
T. et al.
Prediction of difficult laryngoscopy in obese patients by
ultrasound quantification of anterior neck soft
tissue//Anaesthesia. 2003; 58 (11): 1111-1114.
Hastings
R. H., Marks J. D.
Airway management for trauma patients with potential cervical spine
injuries//Anesth Analg. 1991; 73: 471-482.
Morris
S.
Management of difficult and failed intubation in obstetrics//Br. J.
Anaesth. 2001; 4: 117-121.
Ezri
T. et al.
Difficult airway management patterns among attending anaesthetists
practicing in Israel//European Journal of Anaesthesiology. 2003;
20: 619-623.
Часть
З
ОСЛОЖНЕНИЯ
ИНТУБАЦИИ ТРАХЕИ И ТРУДНЫЙ ДЫХАТЕЛЬНЫЙ
ПУТЬ
К
осложнениям ИТ относятся все
неблагоприятные изменения и эффекты,
связанные с ларингоскопией и интубацией,
представляющие угрозу для здоровья и
жизни пациента (табл. 3.1). В данной главе
мы остановимся на описании осложнений
ларингоскопии и интубации, приводящих
к возникновению ситуации ТДП.
Таблица
3.1
Осложнения
ИТ, приводящие к возникновению ТДП
Осложнения
интурбации трахеи
Травма
Гипоксемия
Трудный
дыхательный путь
Эпидемиология
осложнений интубации трахеи
Частота
осложнений анестезии, связанных
непосредственно с дыхательной
системой, приведших к повреждению ЦНС
и смерти, по данным ASA,
составила
в 1999 г. — 38%, в 2000 г. — около 27 % случаев
от общего количества всех осложнений
анестезии [1]. В Дании за период 1994-1998
гг.
30
Вид осложнения |
% от общего количества осложнений |
Общее количество осложнений |
Автор |
Интубация пищевода |
18,00 |
- |
Caplan, 2000 |
5,00 |
- |
Dimitriou et al., 1999 |
|
4,50 |
4459 |
Miller, 2000 |
|
1,70 |
6000 |
Petty, 2000 |
|
0,90 |
2000 |
Williamson et al., 1993 |
|
0,30 |
1005 |
Asai et al., 1998 |
|
Позывы на рвоту |
0,10 |
Asai et al., 1998 |
|
Неадекватная масочная вентиляция |
38,00 |
- |
Caplan, 2000 |
7,00 |
4459 |
Miller, 2000 |
|
6,80 |
6000 |
Petty, 2000 |
31
Вид осложнения |
% от общего количества осложнений |
Общее # количество осложнений |
Автор |
Артериальная десатурация |
0,75 |
2000 |
Williamson et al., 1993 |
1,10 |
1005 |
Asai et al., 1998 |
|
6,00 |
431 |
Gray et al., 2000 |
|
Центральный цианоз |
0,35 |
2000 |
Williamson et al., 1993 |
Кашель |
1,50 |
1005 |
Asai et al., 1998 |
Бронхоспазм |
0,25 |
2000 |
Williamson et al., 1993 |
4,00 |
431 |
Gray et al., 2000 |
|
Введен не тот препарат |
4,00 |
4459 |
Miller, 2000 |
Рефлюкс-синдром |
0,35 |
2000 |
Williamson et al., 1993 |
Ларингоспазм |
0,20 |
Williamson et al., 1993 |
|
0,40 |
1005 |
Asai et al., 1998 |
|
<1,00 |
— |
Dimitriou et al., 1999 |
|
Обструкция ВДП во время интубации |
11,40 |
6000 |
Petty, 2000 |
2,00 |
431 |
Gray et al., 2000 |
|
Эндобронхиальная интубация |
3,40 |
6000 |
Petty, 2000 |
0,10 |
2000 |
Williamson et al., 1993 |
|
1,00 |
431 |
Gray et al., 2000 |
|
Безуспешная интубация |
2,90 |
6000 |
Petty, 2000 |
Случайная экстубация |
2,20 |
Petty, 2000 |
|
Общее количество повреждений ВДП |
6,00 |
4460 |
Domino et al., 1999 |
1,20 |
6000 |
Petty, 2000 |
|
Носовое кровотечение |
0,05 |
2000 |
Williamson et al., 1993 |
Разрыв манжетки ЭТТ |
0,05 |
Williamson et al., 1993 |
|
Признаки ишемии миокарда по ЭКГ |
0,05 |
Williamson et al., 1993 |
|
Остановка сердца |
0,05 |
Williamson et al., 1993 |
32
Вид осложнения |
Количество |
Летальность |
Аспирационный синдром |
6 |
2 |
Многократные попытки интубации |
4 |
2 |
Травмы ДП |
4 |
1 |
Бронхоспазм |
3 |
— |
Анафилаксии |
10 |
2 |
Отек легких |
13 |
— |
Итого |
40 |
7 |
Гипоксемия
Самым
неблагоприятным исходом многих
осложнений ИТ, безусловно, можно считать
возникновение гипоксемии или низкого
напряжения кислорода в крови. При
появлении трудностей с вентиляцией
пациента и при начальных признаках
гипоксемии необходимо немедленно
выяснить причину. Это может быть
неадекватное положение ЭТТ, нарушение
подачи кислорода из-за поломки
источника, разгерметизация дыхательного
контура, неадекватные параметры
вентиляции. Необходимо помнить
о возможности
обструкции ЭТТ вследствие скручивания
трубки, пережатия зубами, появления
грыжевого выпячивания манжеты, обтурации
инородным телом (слизь, кровь, пищевые
массы), иных производственных дефектов
[7].
Физиологическая
потребность в кислороде у взрослых —
3,5 мл/кг/мин, у детей— 7 мл/кг/мин [8].
Недостаток кислорода вызывает нарушение
метаболической деятельности мозговых
клеток и ишемию, что в свою очередь
приводит к острой гипоксической
энцефалопатии. Степень повреждения
бывает вариабельной и непредсказуёмой.
Чаще кислородное голодание в течение
3-5 мин и больше приводит к стойкому
повреждению мозга [9]. Поэтому любой
эпизод гипоксии должен быть предотвращен.
33
Если
у пациента после ИТ внезапно начинают
ухудшаться жизненные показатели,
необходимо исключить интубацию пищевода.
Это осложнение остается ведущей
причиной гипоксемии, повреждения мозга
или смерти во время анестезии. Интубация
пищевода составляет 27 % случаев всех
дыхательных осложнений ИТ [1]. При анализе
163240 анестезий за 15-летний период было
зарегистрировано 27 остановок сердца,
обусловленных анестезией, и 4 из них
(15%) — из-за интубации пищевода [10].
Попадание ЭТТ в верхний отдел
пищеварительного тракта наблюдается
чаще всего у пациентов старше 39 лет
[11].
Случайную
интубацию пищевода можно считать
простительной ошибкой, если она
обнаруживается вовремя — до развития
повреждения мозга. Правильно размещенная
ЭТТ может сместиться, случайная
экстубация может произойти во время
изменения положения пациента на
операционном столе, особенно во
время движений головы или шеи, ЭТТ может
скользить вверх и вниз в трахее (до 5 см
согласно рентгенологическим изучениям).
Пациент может быть случайно экстубирован
во время попыток введения назогастрального
зонда. Поэтому необходимо постоянно
проводить аускультацию в подмышечных
и эпигастральной областях. Но даже
наличие дыхательных шумов во время
аускультации не дает гарантию того,
что трубка находится именно в трахее.
Например, дыхательные звуки в
эпигастральной области могут отсутствовать
у пациентов с резекцией желудка, несмотря
на тот факт, что трубка находится в
пищеводе.
Признаки
интубации пищевода или смещения трубки
обычно становятся очевидными в
течение 1-2 мин или даже позже, если
пациент хорошо преоксигенирован.
Появляется острое растяжение желудка
и кишечника после нескольких минут
инсуффляции воздушной смеси со скоростью
приблизительно 5 л/мин. Есть многочисленные
сообщения о позднем распознавании
интубации пищевода [12]. Известна ситуация,
во время которой интубация пищевода
была диагностирована спустя 40 мин после
начала вмешательства [13].
На
сегодняшний день капнометрия признана
самым надежным методом верификации
правильного размещения ЭТТ в трахее.
В некоторых случаях, особенно когда
интубация была трудной, пациент с
«полным» желудком или страдает
ожирением, у врача может возникнуть
нежелание удалить ЭТТ. Однако, если
есть сомнения — выньте трубку, и лучше
как можно раньше принять это решение
[12].
Если
имел место эпизод гипоксии, необходимо
минимизировать повреждение мозга.
Кровообращение и оксигенация пациента
должны быть восстановлены как можно
скорее. Для уменьшения отека мозгового
вещества рекомендуются режим
гипервентиляции и применение стероидных
препаратов. При возникновении судорог
эффективны антиконвульсан- ты. Известно,
что барбитураты уменьшают мозговую
метаболическую
34
потребность
и поэтому рекомендуются некоторыми
авторами для углубления седации и
анестезии [14, 15].
В
результате случайной эндобронхиальной
интубации также может возникнуть
гипоксемия. Из-за анатомического
расположения трахеи и главных бронхов
ЭТТ часто попадает в правый главный
бронх, который расположен на 2,5 см
ниже киля. Поэтому интубация правого
бронха очень часто приводит к коллапсу
левого легкого и правой верхней доли.
Эндобронхиальную интубацию можно
заподозрить с появлением следующих
признаков: двигательной реакции на
продвижение ЭТТ, асимметрии в экскурсии
грудной клетки, акроцианоза, снижения
Sp02,
необходимости
повышения концентрации ингаляционных
анестетиков для поддержания анестезии
[12].
Интубация
гортани также является осложнением ИТ
и причиной гипоксе- мии во время вводной
анестезии. Заподозрить интубацию
гортани можно по заметной утечке
воздушной смеси изо рта, выступанию
большей части ЭТТ выше зубов. При
повторной ларингоскопии в ротовой
полости визуализируется манжета в
виде большого шаровидного и прозрачного
предмета. Если вовремя не устранить
проблему, возникает опасность полной
экс- тубации, регургитации и аспирации
желудочного содержимого в ДП [12].
Бронхоспазм
— состояние, при котором возникает
опасная для жизни гипоксемия. Бронхоспазм
может появиться в результате повышения
тонуса гладких мышц бронхов, что приводит
к сужению бронхов и бронхиол. Отмечено,
что бронхоспазм может быть первым
проявлением пнев- монита после аспирации
кислого желудочного содержимого.
Диагноз ставится, если во время
аускультации грудной клетки выслушиваются
высокотональные хрипы по всем полям
легких. При малейшем подозрении на
бронхоспазм хирургическое вмешательство
должно быть отложено, потому что он
может усилиться во время анестезии,
возможно, из-за повышенной секреции
бронхиальных желез и повышенного
бронхомоторного тонуса. Риск бронхоспазма
высок у астматиков ввиду их чувствительности
к любым манипуляциям.
Предоперационная
подготовка, включающая применение
аэрозольных бронходилататоров,
антихолинергических препаратов и
стероидов, уменьшает возможность
возникновения осложнения. Эндотрахеальная
интубация должна выполняться на фоне
глубокой анестезии [12].
Рвота
и аспирация
Во
время проведения анестезии всегда
существует опасность рвоты и последующей
аспирации в ДП желудочного содержимого,
крови, зубов, фрагментов костной и
мягкой ткани, мелких частей инструментария.
Аспирация желудочного содержимого в
трахеобронхиальное дерево — осложнение,
влекущее за собой опасную для жизни
гипоксемию. Риск
35
Ситуации |
п — 158 |
% |
Индукция в анестезию |
67 |
42 |
Поддержание анестезии |
28 |
18 |
Неотложные состояния |
17 |
11 |
Связанные с родовспоможением |
33 |
21 |
Трудная интубация |
20 |
13 |
Давление на перстневидный хрящ |
17 |
11 |
В анамнезе рефлюкс-синдром |
4 |
3 |
У
детей риск регургитации и аспирации
может быть больше, но это редко
приводит к пневмонии [21, 22]. Частота
возникновения регургитации
36
Автор, период изучения |
Метод оценки. Пациенты, количество анестезий |
Общее количество аспираций (на 10000) |
Факторы, увеличивающие риск аспирации |
Olsson, (1986), 1967-1970, 1975-1985 |
Ретроспективное изучение базы данных из Karolinska Hospital, Sweden. Взрослые и дети, 185 358 |
87 (4,7) |
|
Warner, (1993), 1985-1991 |
Ретроспективное изучение базы данных из Mayo Clinic, Rochester, New York. Взрослые, 215488 |
67(3,1) |
|
Brimacombe, (1995), 1988-1993 |
Метаанализ 101 публикации по ЛА. Взрослые и дети, 12 901 |
3 (2,3) |
|
Mellin-Olsen, (1996), 1989-1993 |
Проспективное изучение базы данных из Trondheim University Hospital, Norway. Взрослые и дети, 85 594 |
25 (2,9) |
|
Borland, (1998), 1988-1993 |
Проспективное изучение базы данных из Children’s Hospital of Pittsburgh, Pennsylvania. Дети, 50 880 |
52(10,2) |
|
37
Автор, период изучения |
Метод оценки. Пациенты, количество анестезий |
Общее количество аспираций (на 10000) |
Факторы, увеличивающие риск аспирации |
Ezri, (2000), 1979-1993 |
Ретроспективное изучение госпитальной базы данных (за исключением акушерских пациентов). 1870 |
1 (5,3) |
— |
Warner, (1999), 1985-1997 |
Проспективное изучение базы данных из Mayo Clinic, Rochester, New York. Дети, 63180 |
24 (3,8) |
|
Lockey, (1999), 1999 |
Проспективное изучение базы данных из London Helicopter Emergency Medical Service. Взрослые, 53 |
18(3,37) |
с высоты |
С. Mendelson
в
1946 г. [25] первым заговорил, что аспирация
желудочного содержимого в течение
акушерской анестезии является одной
из ведущих причин материнской
смертности. С тех пор, несмотря на
качественное совершенствование
анестезиологического пособия, Это
осложнение остается одним из самых
грозных. Частота возникновения аспирации
у небеременных женщин — приблизительно
7 случаев на 10 000 [18, 26], но у беременных
женщин во время анестезии намного выше
— от 1,3 до 22,8 случаев на 10 000 [27-29] со
смертностью до 6%
[30]. Данные других авторов, упоминающих
по 1 случаю аспирации у 1431, 1547 и 900
пациенток с кесаревым сечением,
подтверждают высокую частоту аспирации
в популяции [31-33].
Ключевыми
моментами в патофизиологии осложнений
и аспирации желудочного содержимого
являются следующие [21]:
Осложнения,
частично связанные с аспирацией:
острая
обструкция ДП,
выраженная
гипоксемия,
риск
возникновения смерти.
38
Осложнения,
связанные с влиянием кислоты (они
происходят
в
две стадии):
непосредственное
повреждение тканей,
более
поздний воспалительный ответ.
Бактериальные
осложнения:
глоточное
и желудочное содержимое обычно содержит
бактерии.
Профилактика
аспирации заключается в назначении
пациентам перед операцией голодания,
кислотонейтрализующих препаратов, в
проведении быстрой индукции анестезии
и эндотрахеальной интубации с применением
приема Селлика [34].
Во
Франции (как по данным 1988 г., так и по
данным 1999 г.) соблюдение режима голода
является строгим правилом в акушерской
анестезиологии [35]. S.
Michael et al. сообщают,
что в Великобритании пациенткам
запрещают есть только твердую пищу,
а полное голодание практикуется редко
[36]. Аналогичная тактика, используемая
в Канаде [37], Норвегии [38] и США [39], не
увеличивает риск аспирации, но увеличивает
комфорт пациентов и предотвращает
возникновение кетоза [40].
Предоперационная
профилактика заключается в применении
антацидов, блокаторов Н2-рецепторов
и метоклопрамида. Нетаблетированные
анта- циды (цитрат натрия и бикарбонат),
данные пациенту внутрь за 30 мин до
операции, эффективно повышают pH
желудочного содержимого до 2,5 и выше
[41, 42]. Чаще для профилактики используются
шипучие формы ранитидина и циметидина,
которые обладают большой продолжительностью
действия — до 8 ч [35].
Антагонисты
Н2-рецепторов
не только повышают pH желудочного сока,
они также уменьшают секреторную
активность желудочной стенки [43]. Однако
время начала действия этих препаратов
(45-60 мин после в/в инъекции и 240-360 мин
после перорального приема) ограничивает
их использование в экстренных
случаях. Широко применяется метоклопрамид,
который ускоряет желудочную эвакуацию
и увеличивает давление нижнего
пищеводного сфинктера, хотя и не
воздействует на секрецию соляной
кислоты в желудке [44]. Однако, по мнению
Т. Engelhardt
et al., нет
никаких данных, демонстрирующих 100%
эффективность блокаторов Н2-рецепто-
ров и ингибиторов протонной помпы,
эффективность данных препаратов в
группах риска сомнительна [21].
Продолжается
широкое использование деполяризующего
миорелаксанта (МР) сукцинилхолина при
быстрой индукции во время операции
кесарева сечения. В Великобритании
66% врачей используют в своей практике
только сукцинилхолин, остальные —
рокурониум, недеполяризующий
39
МР
с быстрым началом действия [45]. Участие
подготовленного помощника анестезиолога
и прием Селлика при ИТ считаются
общепринятым обязательным стандартом
в британских клиниках.
Во
Франции, Германии [46] и Новой Зеландии
[47] анестезиологи редко ставят
назогастральный зонд в течение общей
анестезии при операции кесарева
сечения. В Норвегии, напротив,
назогастральный зонд ставят 50% пациенток
[38]. Постановка назогастрального зонда
перед концом операции долго
рекомендовалась в Великобритании [48].
При
РА во время операции кесарева сечения
эпидуральное введение 100 мкг фентанила
[49] нарушает эвакуацию содержимого
желудка. Доза фентанила 50 мкг эпидурально
не вызывает подобного эффекта [50].
Поэтому, если после эпидуральной
анальгезии предстоит общая анестезия,
это необходимо учитывать.
Если
все-таки
аспирация
произошла, рекомендуются следующие
меры [12]:
оксигенация
100 % кислородом через лицевую маску;
положение
пациента с опущенным головным концом
на 30° (положение Тренделенбурга);
удаление
всего желудочного содержимого из
ротоглотки и трахеи;
ИТ,
туалет ВДП через ЭТТ;
вентиляция
под положительным давлением с ПДКВ;
продолжение
100 % оксигенации;
контроль
артериальных газов крови.
ГемЬдинамические
реакции
Ларингоскопия
и интубация — мощные стимулы для
возникновения гипертонии, тахикардии,
даже в условиях анестезии. Оротрахеальная
интубация с использованием ларингоскопа
требует поднятия надгортанника и
обнажения голосовой щели путем
продвижения клинка ларингоскопа вперед
и вверх. Эти действия ведут к рефлекторным
гемодинамическим сдвигам [51-53].
Транзиторные гемо
динамические
изменения практически не имеют
последствий у здоровых людей, но могут
быть опасны для пациентов с сопутствующей
артериальной гипертонией [54, 55].
Самый
существенный стимул возникает во время
введения ЭТТ в трахею. Если
пациенту-гипертонику не проведена
предоперационная антигипер- тензивная
терапия, индукция мощными анестетиками
и анальгетиками с использованием
вазодилататоров, то может возникнуть
выраженное повышение АД, ЧСС, а также
нарушение сердечного ритма. Возникновение
гипертонии и тахикардии во время
интубации, вероятно, связано с
систематической стимуляцией
сосудодвигательного центра, активацией
40
симпатической
нервной системы и выбросом катехоламинов
[7, 56-58]. Введение ЭТТ через интубационную
ЛМ также приводит к аналогичным
гемодинамическим сдвигам, как и при
ларингоскопии и интубации [59].
Гемодинамические
ответы на интубацию у детей отличаются,
особенно в младших возрастных группах.
У них часто во время интубации возникает
брадикардия, генез которой, вероятно,
связан со стимуляцией блуждающего
нерва [60-63]. Профилактика гемодинамических
осложнений ИТ заключается в проведении
анестезии адекватной глубины для
каждого случая.
Эндотрахеальная
интубация часто вызывает существенное
повышение ВЧД. Повышение которого
потенциально опасно у пациентов с
внутричерепной аневризмой, отеком
мозга, внутричерепным кровотечением.
Минимизация изменений ВЧД достигается
гипервентиляцией, контролем АД,
профилактикой кашля и двигательных
реакций на ИТ, применением анестетиков
(например, тиопентала и ксикаина),
уменьшающих ВЧД [12, 64, 65].
Травма
верхних дыхательных путей
Травмы
ВДП — частые осложнения ПЛ и ИТ (табл.
3.6). Большинство из них может привести
к ТДП.
Во
время 404 анестезий травмы ВДП отмечены
при проведении ИТ у 6,9% пациентов, начиная
от мелких порезов слизистой до переломов
зубов и угрожающих жизни разрывов
мягких тканей [66]. При анализе 4 460 случаев
осложнений, связанных с дыхательной
системой, по данным ASA,
266
(6%) — повреждения ВДП [78]. По предыдущим
данным, из 2000 зафиксированных
осложнений анестезии отмечено 4 (0,2%)
случая разрывов языка, пищевода и
повреждения зубов во время ИТ [86].
Небрежная
ларингоскопия — причина повреждения
верхней губы с образованием гематом,
разрывов и формированием отпечатков
зубов. В течение ларингоскопии
верхняя губа часто ущемляется между
ларингоскопическим клинком и зубами.
Эту проблему можно избежать, если
сместить верхнюю губу от ларингоскопического
клинка [12, 67].
В
течение ларингоскопии клинком можно
повредить слизистую в области миндалин.
Это осложнение — причина воспалительных
явлений в горле, часто наблюдаемых в
послеинтубационном периоде. Частота
фарингита после общей анестезии
изучалась у 5 264 амбулаторных пациентов
и составила 12,1% в течение 24 ч после
операции. Фарингит отмечен у 45%
пациентов после ИТ, у 18% — после
использования ЛМ и у 3% — после вентиляции
лицевой маской [68]. Другие авторы говорят
о возникновении фарингита в 14-64% случаев
41
Осложнение |
Из общего количества осложнений, % |
Травма гортани (включительно), % |
33 |
- паралич голосовых связок - 34 |
|
- возникновение гранулёмы - 17 |
|
- вывих черпаловидных хрящей - 8 |
|
- возникновение гематомы - 3 |
|
Травма трахеи (включительно), % |
15 |
- после трахеостомии - 64 |
|
- перфорация - 33 |
|
- инфекция-3 |
|
Травма глотки (включительно), % |
19 |
- перфорация - 37 |
|
- разрывы и ушибы-31 |
|
- локальная инфекция - 12 |
|
- воспаление слизистой без повреждения - 12 |
|
Травма ВНС |
10 |
Травма носа |
5 |
Травма пищевода |
18 |
Повреждение
зубов — единственное распространенное
осложнение, заканчивающееся судебным
иском против анестезиологов в западных
странах. Так, 10-летнее изучение 598904
процедур обнаружило 132 случая (1:4
500) повреждения зубов, которые требовали
неотложного вмешательства [75]. Почти
половина этих повреждений произошла
во время ларингоскопии и ИТ. Частота
повреждения зубов составляет 1 : 2805
интубиро- ванных пациентов против 1 :
7390 неинтубированных пациентов.
Шатающиеся зубы, оротрахеальная
интубация, трудная интубация (в том
числе и в анамнезе), ограничение
движения в шейном отделе позвоночника,
42
анатомические
аномалии развития лицевого скелета —
факторы, повышающие риск повреждения
зубов и попадания их в ВДП [75].
Оценка
ДП должна всегда включать полную оценку
зубного риска. Лучше избегать ларингоскопии
у пациентов, которые имеют коронки.
Если пациент особенно уязвим,
необходимо прибегнуть к альтернативным
методам поддержания проходимости ВДП,
вплоть до рассмотрения альтернативных
методов анестезии. Широкое распространение
ЛМ уменьшает количество повреждений
зубов [75, 76].
Травма
мягких тканей гортани более серьезна
и может привести к подкожной эмфиземе,
формированию напряженного пневмоторакса
или пневмомедиастинума. Подкожная
эмфизема — грозный признак, при котором
анестезиолог должен заподозрить
напряженный пневмоторакс и
пневмомедиастинум. Как можно раньше
необходимо провести рентгенографию
грудной клетки и немедленно начать
внутривенное введение антибиотиков.
У таких пациентов очень опасно проведение
вентиляции под положительным давлением.
Сообщается об изъязвлении слизистой
длиной около 5 мм в ротоглотке, вызванном,
вероятно, перегретой лампочкой
ларингоскопа. Ларингоскоп был в «рабочем»
положении на протяжении нескольких
минут до ларингоскопии [12, 77].
Повреждения
гортани происходят во время интубации,
но обнаруживаются после экстубации
или еще позже. Это паралич голосовых
связок, гранулёма, вывих черпаловидных
хрящей, гематома. К самым распространенным
повреждениям глотки относятся:
перфорация, разрывы и ушибы, локальная
инфекция, катаральные явления без
признаков повреждения. Больше чем 50%
всех повреждений глотки и 68% перфораций
связаны с трудной интубацией. По данным
К. Domino
et al. (1999),
в 50 % случаев причинами перфорации
стали неаккуратное использование
назогастрально- го зонда, аспирационных
катетеров и струйной вентиляции. В
остальных случаях причина перфорации
не была определена. Из-за развившегося
медиастенита [78] смерть произошла в 81
% случаев перфораций глотки.
Перфорация
пищевода — самое частое повреждение,
связанное с трудной интубацией
(62%). Такая интубация чаще всего происходит
у женщин и/или пациентов старше 60
лет. Инструменты, приводящие к перфорации
пищевода, — это назогастральные зонды,
пищеводные дилататоры, пищеводный
стетоскоп и ларингоскоп. Смертность
среди пациентов, получивших повреждение
пищевода, может достигать 19% [78]. Перфорации
глотки и пищевода трудно диагностировать.
Ранние признаки перфорации — пневмоторакс
и подкожная эмфизема — могут
присутствовать приблизительно в 50%
случаев. Рентгенографию грудной клетки
желательно выполнить во всех случаях
трудной интубации и по возможности
спустя 24 ч повторно. Типичные поздние
признаки глоточно-пищеводной
перфорации: выраженные воспалительные
43
явления
в горле, сильная боль в груди или шее,
повышение температуры, не связанное
с оперативным вмешательством [78].
Травмы
трахеи или бронха, связанные с
эндотрахеальной или эндоброн- хиальной
интубацией, — редкие и серьезные
осложнения. В большинстве случаев это
результат трахеостомий при трудной
интубации [78] или эн- добронхиального
введения ЭТТ [79-81]. Чаще это перфорация
и инфекционные воспаления. В
отечественной и зарубежной литературе
описаны случаи разрыва трахеи после
эндотрахеальной интубации, вызванные
перераздуванием манжетки.
Предрасполагающими
факторами к разрыву трахеи или бронха
являются: травма, возраст, болезни
трахеи и бронхов, диффузия закиси азота,
слабость стенок трахеи и бронхов [12].
Своевременно выявить осложнение иногда
бывает затруднительно. Необъяснимая
утечка воздушной смеси, снижение
легочного комплайнса, появление крови
в ВДП, подкожная эмфизема, напряженный
пневмоторакс и хирургически выявленный
дефект трахеи или бронха подтверждают
диагноз [82]. Фиброоптическая бронхоскопия
— надежный метод верификации правильного
размещения трубки внутри трахеи и
диагностики разрывов. Если осложнение
все-таки
произошло,
то в первую очередь необходимо напряженный
пневмоторакс перевести в открытый
путем введения иглы большого диаметра
ниже второго ребра на пораженной
стороне. При обширных разрывах
рекомендуется наложение трахеостомии
[83].
Профилактика
трахеобронхиальных разрывов проста:
никогда не применять силу при введении
ЭТТ, осторожно использовать стилеты и
проводники, не раздувать манжету
чересчур сильно, контролировать давление
в манжете с помощью манометра, при
использовании закиси азота периодически
спускать манжету, то же самое делать
во время эзофагоскопии [12, 84, 85].
Травма
легких — редкое осложнение ларингоскопии
и интубации. Чаще всего пневмоторакс
— результат чрезмерной ручной или
механической вентиляции нормальных
легких или механической вентиляции
легких с имеющейся патологией.
Эндобронхиальная интубация — фактор
риска возникновения баротравмы
нормальных и патологических легких
[12].
Список
основной литературы
Caplan
R. A.
The ASA Closed Claims Project: lessons learned//ASA Refresher
Course #265. 2000; 1-7.
Rosenstock
C. et
al.
Complaints related to respiratory events in anaesthesia and
intensive care medicine from 1994 to 1998 in Denmark//Ada
Anaesthesiol. Scand. 2001; 45: 53-58.
44
Miller
С.
G.
Management of the difficult intubation in closed malpractice
claims// ASA Newsl. 2000; 64 (6): 13-19.
Morray.
J. P. et al.
Anesthesia-related cardiac arrest in children//Anesthesiology.
2000; 93(1): 6-14.
Sinclair
M. et al.
Incidents in obstetric anaesthesia and analgesia: an analysis of
5000 incident reports//Anaesth. Intensive Care. 1999; 27(3):
275-281.
Каверина
К. П., Братищев И. В.
Структура осложнений анестезии и
интенсивной терапии в акушерстве:
Материалы 2-й науч.-практ. конф.
«Безопасность больного в
анестезиологии-реаниматологии».
Москва, 29-30 июня 2004 г. М.: ГЕОС, 2004.
С. 17-18.
(Каталог участников выставки).
Трудности
при интубации трахеи: Пер. с англ./Под
ред. И. П. Латто, М. М. Роузен. М., 1989. С.
68-89.
Cardwell
М.,
Walker
R. W. М.
Management
of the difficult paediatric airway//British Journal Anaesthesia.
2003; 3 (6): 167-170.
Mahla
M.
Nervous system. In Gravenstein N (ed.): Manual of Complication
During Anesthesia, J. B. Lippincott, New York, 1991. P. 383.
Keenan
R. L.,BoylanC. P.
Cardiac arrest due to anesthesia//JAM A. 1985; 253: 2373- 2377.
Caplan
R. A. et al.
Adverse respiratory events in anaesthesiology: a closed claims
analysis//Anesthesiology. 1990; 72: 828-833.
Principles
of airway management/Eds. В.
T.
Finucane, A. H. Santora. Springer-Verlag, 2003. P. 255-303.
Conrardy
Goodman L. R.f
Lainge F., Singer М.
M.
Alteration of endotracheal tube position. Flexion and extension of
the neck//Crit Care Med. 1976; 4: 7-12.
Katz.
F.
Management of intra-operative ventilatory emergencies, In Annual
Refresher Course Lectures. American Society of Anesthesiologists,
Park Ridge, IL, 1988. P. 265.
Weinstein
P., Faden
A.
Protection of the Brain From Ischemia. Williams & Wilkins,
1990.
Blitt
C. D. et al.
Silent regurgitation and aspiration during general anesthesia//Curr
Res. 1970,49:707.
Cheney
F. W.
Aspiration: a liability hazard for the anesthesiologist//ASA
Newsletter. 2000; 64(6): 5-26.
Olsson
G. L., Hallen B., Hambraeus-Jonzon K.
Aspiration during anaesthesia. A computer-aided study of 185 358
anaesthetics//Acta Anaesthesiologica Scandinavica 1986; 30: 84-92.
Warner
M. A., Warner М.
E.,
Weber J. G.
Clinical significance of pulmonary aspiration during the
perioperative period//Anesthesiology. 1993; 78: 56-62.
Mellin-Olsen
J., Fasting S., Gisvold S. E.
Routine preoperative gastric emptying is seldom indicated. A study
of 85 594 anaesthetics with special focus on aspiration
pneumonia//Acta Anaesthesiologica Scandinavica. 1996; 40:
1184-1188.
Engelhardt
Т.,
Webster
N. R.
Pulmonary aspiration of gastric contents in anaesthesia//
Br.
J. Anaesth. 1999; 83(3): 453-460.
Phillips
S., Dabom A. K, Hatch D. J.
Preoperative fasting for paediatric anaesthesia// British Journal
of Anaesthesia. 1994; 73: 529-536.
Borland
L. M. et al.
Pulmonary aspiration in pediatric patients during general
anesthesia: incidence and outcome//Journal of Clinical Anesthesia.
1998; 19: 95-102.
Tiret
L. et al.
Complications related to anaesthesia in infants and children.A
prospective survey of 40 240 anaesthetics//British Journal of
Anaesthesia 1988; 61: 263-269.
45
Mendelson
С.
L.
The aspiration of stomach contents into the lungs during obstetric
anesthesia//Am. J. Obstet Gynecol 1946; 52: 191-205
Cameron
J.
L, Mitchell
W. М.,
Zulema
C. D.
Aspiration pneumonia. Clinical outcome following documented
aspiration//Arch. Surg. 1973; 106: 49-52.
Crawford
J. S.
The anaesthetist’s contribution to maternal mortality//Br. J.
Anaesth. 1970; 42: 70-73.
Hunter
A. R., Moir D. D.
Confidential inquiry into maternal death [Editorial]//Br. J.
Anaesth. 1983; 55: 367-369.
Ezri
T. et al.
Peripartum general anaesthesia without endotracheal intubation:
incidence of aspiration pneumonia//Anaesthesia. 2000; 55: 421-426.
Kranz
M. L.f
Edwards W. L.
The incidence of nonfatal aspiration in obstetric patients//
Anesthesiology 1973; 39: 359.
Dindelli
М.,
La
Rosa М.,
Rossi
R.
Incidence and complications of the aspiration of gastric contents
syndrome during cesarean section in general anaesthesia//Annali Di
Ostetricia, Ginecologica, Medicina Perinatale (Milano). 1992; 112:
376-384.
La
Rosa M. et al.
Aspiration syndrome in Cesarean section. Our experience from 1980 to
1990//Minerva Anestesiologie. 1992; 58: 1213-1220.
Soreide
E.t
Bjornestad E., Steen P. A.
An audit of perioperative aspiration pneumonitis in gynecological
and obstetric patients//Acta Anaesthesiologica Scandinavica. 1996;
40: 14-19.
Kallar
S. K., Everett L. L.
Potential risks and preventive measures for pulmonary aspiration:
new concepts in preoperative fasting guidelines//Anesth. Analg.
1993; 77: 171-182.
Hagberg
C., Ezri
Т.,
Abouleish
E.
Etiology and Incidence of Endotracheal Intubation Following Spinal
Anesthesia for Cesarean Section//IMAJ. 2001; 3.
Michael
S., Reilly C. S.
Policies for oral intake during labour: a survey of maternity units
in England and Wales//Anaesthesia. 1991; 46: 1071-1073.
Breen
T. W., McNeil Т.,
Dierenfield
L.
Obstetric anesthesia practice in Canada//Can. J. Anaesth. 2000; 47:
1230-1242.
Soreide
E.f
Holst-Larsen H., Steen P. A.
Acid aspiration syndrome prophylaxis in gynaecological and obstetric
patients: a Norwegian survey//Ada Anaesthesiol. Scand. 1994;
38:863-868.
Hawkins
J. L. et al.
Oral intake policies on labor and delivery: a national survey//Clin.
Anesth. 1998; 10: 449-451.
Kubli
M. et al.
An evaluation of isotonic ‘sport drinks’ during labor//Anesth.
Analg. 2002; 94: 404-408.
Faure
E. A. M. et al.
Sodium bicarbonate buffers gastric acid during surgery in obstetric
and gynecologic patients//Anesthesiology. 1987; 67: 274-277.
Gibbs
C. P., Spohr
L., Schmidt
D.
The effectiveness of sodium citrate as an antacid// Anesthesiology.
1986; 57: 44-46.
McCaughey
W. et al.
Cimetidine in elective cesarean section//Anaesthesia. 1981; 36:
167-172.
Howard
F. A., Sharp D. S.
Effects of metoclopramide on gastric emptying during labour//Br. Med
J. 1973; 1: 446.
Maltby
J. R., Beriault М.
T.
Science, pseudoscience and Sellick//Can. J. Anaesth. 2002; 49:
443-447.
Schneck
H. et al.
Anaesthesia for cesarean section and acid aspiration prophylaxis: a
German survey//Anesth. Analg. 1999; 88: 63-66.
Kluger
М.
Т., Willemsen
G. Anti-aspiration prophylaxis in New Zealand: a national
survey//Anaesth. Intensive Care. 1998; 26: 70-77.
Deaths
associated with anaesthesia. In: Report on Confidential Enquiries
into Maternal Deaths in the United Kingdom, 1988-1990. London, UK:
HMSO, 1994: 80-96.
Wright
P. M.
et al.
Gastric emptying during lumbar extradural analgesia in labour:
effect of fentanyl supplementation//Br. J. Anaesth. 1992; 68:
248-251.
Kelly
М.
C.
et al.
A comparison of the effect of intrathecal and extradural fentanyl
on gastric emptying in laboring women//Anesth. Analg. 1997; 85:
834-838.
Prys-Roberts
C. et
al.
Studies of an aesthesia in relation to hypertension: haemodyna- mic
consequences of induction and endotracheal intubation//Br. J.
Anaesth. 1971; 43: 531-547.
Martin
D. E., Rosenberg H., Aukburg S. J. et al.
Low-dose fentanyl blunts circulatory responses to tracheal
intubation//Anesth. Analg. 1982; 61: 680-684.
Nishikawa
Т.,
Namiki
A.
Attenuation of the pressor response to laryngoscopy and tracheal
intubation with intravenous verapamil//Acta Anaesthesiol. Scand.
1989; 33: 232-235.
Omote
K. et al.
Effects of nicardipine on the circulator’ responses to tracheal
intubation in normotensive and hypertensive patients//Anaesthesia.
1992; 47: 24-27.
Fujii
Y. et al.
Effects of calcium channel blockers on circulatory response to
tracheal intubation in hypertensive patients: nicardipine versus
diltiazem//Can. J. Anaesth. 1995; 42: 785-788.
Harris
T. et al.
Blood pressure experience and risk of cardiovascular disease in the
elderly//Hypertension. 1985; 7: 118-124.
Splinter
W. M. et al.
Haemodynamic responses to laryngoscopy and tracheal intubation in
geriatric patients: effects of fentanyl, lidocaine and
thiopentone//Can. J. Anaesth. 1989; 36: 370-376.
Kovac
A. L.
Controlling the hemodynamic response to laryngoscopy and
endotracheal intubation//J. Clin. Anesth. 1996; 8: 63-79.
Shimoda
O. et al.
Reflex Responses to Insertion of the Intubating Laryngeal Mask
Airway, Intubation and Removal of the ILMA//Anaesth. Intensive.
Care. 2002; 30: 766-770.
Jativa-Porcar
M. R. et al.
Extreme reflex bradycardia during laryngoscopy//Rev. Esp.
Anestesiol. Reanim. 2003; 50(2): 111-113.
Fox
E. J. et al.
Complications related to the pressor response to endotracheal
intubation//Anesthesiology. 1977.47: 524-525.
Moffit
E. A. et al.
Effects of intubation on coronary blood flow and myocardial
oxygenation//Can. Anesth. Soc. J. 1985. 32: 105-111.
Edwards
D. N. et al.
Myocardial ischaemia during tracheal intubation and extubation//
Br. J. Anaesth. 1994 73: 537-539.
Hemandez-Palazon
J. et al.
Cardiovascular response to tracheal intubation in patients with
intracranial tumor. Comparative study between urapidil and
lidocaine//Rev. Esp. Anestesiol. Reanim. 2000; 47(4): 146-150.
Yamamoto
K. et al.
Left-molar Approach Improves the Laryngeal View in Patients with
Difficult Laryngoscopy//Anesthesiology. 2000; 92: 70-74.
Fung
B. K.f
Chan M. Y.
Incidence of oral tissue trauma after the administration of general
anaesthesia//Acta Anaesthesiologica Sinica. 2001; 39: 163-167.
Pandey
K., Badola R., Kumar S.
Time course of intraocular hypertension produced by
suxamethonium//Br. J. Anaesth. 1972; 44: 191.
47
Higgins
P.
P., Chung
F., Mezei G.
Postoperative sore throat after ambulatory surgery// British
Journal of Anaesthesia. 2002; 88: 582-584.
Joshi
G. P., Inagaki
Y., White
P. F. Use of the laryngeal mask as an alternative to the tracheal
tube during ambulatory surgery//Anesthesia and Analgesia. 1997; 85:
573-577.
Kloub
R.
Sore throat following tracheal intubation//Middle East Journal of
Anesthesiology. 2001; 16: 29-40.
Splinter
W. M. et al.
Postoperative sore throat in children and the laryngeal mask
airway//Canadian Journal of Anesthesia. 1994; 41: 1081-1083.
Dingley
J., Whitehead M. J., Wareham J.
A comparative study of the incidence of sore throat with the
laryngeal mask airway//Anaesthesia. 1994; 49: 251-254.
7
3. Oczenski
W. et al.
Complications following the use of the Combitube, tracheal tube and
laryngeal
mask airway//Anaesthesia. 1999; 54: 1161-1165.
Christensen
A. M. et al.
Postoperative throat complaints after tracheal intubation// British
Journal of Anaesthesia. 1994; 73: 786-787.
Warner
М.
E.
et al.
Perianesthetic dental injuries: frequency, outcomes, and risk
factors//Anesthesiology. 1999; 90: 1302-1305.
St.
Paul Fire & Marine Insurance Company. Summary Report,
1980-1985.
Koh
T. H.y Coleman R.
Oropharyngeal burn in a newborn baby: new complication of
light-bulb laryngoscopes//Anesthesiology. 2000. 92: 277-279.
Domino
К.
B.
et al.
Airway injury during anesthesia//Anesthesiology. 1999; 91 (6):
1703-1711.
7
9. Kumar
M. S., Pandey S. K, Cohen P. J.
Tracheal laceration associated with endotracheal
anesthesia//Anesthesiology.
1977; 47: 298.
Wagener
D.
L., Gamage
G. W., Wong M. L.
Tracheal rupture following the insertion of disposable double lumen
endotracheal tube//Anesthesiology. 1985; 63: 700.
Foster
J. M.
G., Lao
O. J., Alimo E. D.
Ruptured bronchus following endobronchial intubation//Br. J.
Anaesth. 1983; 55: 697.
Marty-Ane
С.
H.
et al.
Membranous tracheal rupture after endotracheal intubation// Ann.
Thome Surg. 1995; 60 (5): 1367-1371.
Bernard
B. Baez et al.
Thoracic Trauma.//Thoracic Anaesthesia. Ed. J. A. Kaplan, P. D.
Shinger. Churchill Livingstone. 2003. P. 318.
Ти
H.
N. et al.
Nitrous oxide increases endotracheal cuff pressure and the
incidence of tracheal lesions in anesthetized patients//Anesth.
Analg. 1999; 89 (1): 187-190.
Karasawa
F. et al.
Deflationary phenomenon of the nitrous oxide-filled endotracheal
tube cuff after cessation of nitrous oxide administration//Anes.
Analg. 2001; 92: 145-148.
48
Функциональные |
|
Угнетение ЦНС:
|
Различные травмы и заболевания периферической НС:
|
Механические |
|
Аспирация инородного тела. Инфекции:
Кровотечения и гематомы:
Травмы:
|
Отеки гортани:
Различные причины:
и трахеобронхиальная карцинома,
|
49
их
можно разделить на функциональные (с
вовлечением ЦНС) и механические
(обтурация в просвете, в стенке, извне
ВДП). Обструкция может произойти выше
голосовых связок, непосредственно в
области связок и ниже [3].
Внешняя
обструкция инородным телом — частая
причина острой ОВДП. Пожилые и дети
более всего подвержены данной патологии.
Ношение зубных протезов, прием
алкоголя и седативных препаратов
увеличивают риск обструкции. Частота
попадания пищи в ДП с последующим
смертельным исходом составляет 0,66 на
100000 населения [4].
В
США в 1997 г. асфиксия была признана
наиболее частой причиной смерти детей
раннего возраста [5]. Этиология — округлые
мелкие плоды, леденцы, маленькие
пластмассовые игрушки, попадающие в
ВДП, когда ребенок играет, смеется или
ест [6]. Самый плохой прогноз — при
обструкции несколькими предметами
или предметами цилиндрической формы
[7].
ОВДП
и кровотечение — грозные осложнения,
сопровождающие тупые или проникающие
травмы челюстно-лицевой области и шеи.
Они бывают изолированными или частью
политравмы. В 97% случаев всех челюстно-
лицевых травм тупое повреждение —
самый распространенный механизм.
Несчастные случаи, автокатастрофы
составляют 75% тупых травм; падения,
физические нападения, контактные
спортивные состязания и несчастные
случаи на производстве — 25%; смертность
при этом может достигать 13% [8].
Травма
лица в 20% случаев бывает опасна для
жизни, включает в себя закрытые
повреждения лица (15%), обструкцию ВДП
(3,5%), контузию легких и/или аспирацию
(1,5%) [9, 10]. Возрастная группа риска —
молодые люди 20-25 лет, подавляющее
большинство пострадавших составляют
мужчины [8]. Частота переломов лицевых
костей: верхняя челюсть — 23%, орбитальная
область — 22%, скуловая кость — 16%, носовые
кости — 15%, нижняя челюсть — 13%, зубы —
8%, альвеолярный край — 2%, ВНС — 1% [11, 8].
Частота повреждения головы с
челюстно-лицевой травмой вариабельна
от 15 до 80% случаев, повреждения шейного
отдела позвоночника могут достигать
11% [3]. Прямая травма гортани и трахеи
встречается редко, в крупных мегаполисах
— менее 1% [12,13].
Патофизиологические
механизмы ОВДП у детей обусловлены
некоторыми анатомическими
особенностями. У новорожденных 42% всего
сопротивления в ДП приходится на
носовую часть, поэтому дети должны
дышать обязательно через нос. Надгортанник
должен быть длиннее, U-образный
и гибкий, визуализацию гортани и
интубацию с поднятием надгортанника
проще осуществить прямым клинком
(например, клинком Миллера), чем изогнутым.
Гортань у новорожденных расположена
выше, на уровне С3
4,
имеет наклон кпереди. Эта анатомическая
особенность сглаживается в течение
первых 3 лет жизни и снова появляется
на уровне Сб
в период
50
Уровень |
Новорожденные |
Младенцы до года и дети |
Нос |
Атрезия хоан |
— |
Ротоглотка |
|
|
Гортань |
|
|
Клинические
признаки обструкции
Характерными
клиническими признаками при частичной
обструкции являются удушье,
слюнотечение, на расстоянии слышатся
шумное дыхание и хрипы, пациент не может
говорить, пытается сделать вдох (табл.
4.3). При частичной обструкции в ближайшие
минуты и часы декомпенсируется
дыхательная функция; уменьшение
дыхательных движений и потеря сознания
— поздние признаки гипоксемии и
гиперкапнии; брадикардия и гипотония
— результат декомпенсации
сердечно-сосудистой деятельности [3].
51
Симптомы |
Признаки |
Диспноэ |
Храп |
Кашель |
Фырканье |
Ортопноэ |
Бульканье |
Хрипы |
Стридор |
Слабость |
Удушье |
Дисфагия |
Сокращения грудной клетки |
Кровохарканье |
Отек слизистой носа |
Фарингит |
Цианоз |
Истощение |
Слюнотечение |
Тошнота |
Тахипноэ |
Рвота |
Бессознательное состояние |
Полная
ОВДП характеризуется быстрым
прогрессированием удушья. Универсальный
признак приступа удушья — пациент
держится за горло большим и указательным
пальцами [15]. Отмечаются волнение и
паника, больной не может дышать,
говорить или кашлять, нарастает цианоз
на фоне энергичных попыток сделать
вдох. Потеря сознания и смерть наступают
в течение нескольких минут, если
обструкция не разрешится или если не
оказать помощь [3].
Стридор
(учащенное дыхание с помехами, приводящими
к возникновению потока турбулентного
воздуха с шумом) — в большинстве случаев
первое проявление обструкции у детей.
Родители обращают внимание на появление
учащенного, шумного дыхания и на
втягивание стенок грудной клетки при
вдохе. По характеру дыхания и звукам
можно предположить степень и уровень
обструкции. Обструкция носа приводит
к нарушению дыхания через нос, ребенок
дышит ртом. Ротоглоточная обструкция
вызывает изменение голоса (дети
гундосят), надглоточная обструкция
характеризуется приглушенным
голосом. Дети с обструкцией на уровне
глотки хрипят или вообще не способны
говорить.
Ретракция
грудной клетки развивается по мере
прогрессирования обструкции.
Пароксизмальные движения грудной
клетки у детей менее выражены, чем
у новорожденных, в связи с более
стабильной структурой грудной клетки.
По мере прогрессирования обструкции
тахипноэ нарастает за счет активизации
вспомогательной мускулатуры. Повышение
температуры и
52
лихорадка
усиливают даже незначительную по объему
обструкцию, независимо от ее степени.
Дети и подростки могут компенсировать
увеличившуюся работу дыхания,
недоношенные и доношенные новорожденные
быстро истощаются с последующим
развитием эпизодов апноэ.
Аускультация
шеи и гортани позволяет определить
локализацию обструкции. Например,
инородное тело в ДП часто дает механический
или хлопающий звук. При значительной
и полной обструкции дыхание может быть
ослабленным или вовсе не выслушиваться.
У ребенка с ОВДП первоначально
развивается тахипноэ и тахикардия,
затем при неблагоприятном развитии
событий уменьшаются дыхательные
движения, стридор, частота дыхания,
напряжение мускулатуры, нарастает
бледность, цианоз, брадикардия, угнетение
сознания (схема 4.1, см. прил. к ч. 4) [3].
Неотложные
мероприятия при обструкции
Первые
мероприятия при обструкции должны
немедленно проводиться квалифицированным
специалистом уже в приемном отделении.
Осмотр пациента должен дополняться
(если есть время и технические
возможности) инструментальными
методами исследования (рентгенография,
прямая и непрямая ларингоскопия,
фиброоптическая бронхоскопия). Как
можно раньше необходимо начать
непрерывный контроль АД, ЧСС, Sp02,
оксиге-
нацию 100% кислородом, обеспечить венозный
доступ. Врачом должен быть выработан
план поддержания проходимости ДП во
время транспортировки в профильное
отделение. При невозможности обеспечения
безопасных условий в течение
транспортировки стоит подумать о
проведении интубации трахеи под местной
или общей анестезией [16].
Полная
обструкция, апноэ, ухудшение и потеря
сознания являются прямыми показаниями
для эндотрахеальной интубации или
любого другого способа поддержания
проходимости ВДП [3].
Индукция
ингаляционными анестетиками, то есть
— метод выбора при ИТ в этих ситуациях.
Ингаляционная анестезия должна быть
медленной при верхней ОВДП и более
быстрой — при нижней ОВДП. Используемые
препараты должны позволять проведение
ИТ на фоне поверхностной анестезии на
случай внезапной обструкции. Не
рекомендуется применение МР. Во
время индукции в анестезию желательно
иметь под рукой аспиратор, а также
ассортимент интубационных трубок и
соответствующих тонких зондов.
Ларингоскопия
и интубация ребенка выполняется только
при наступлении глубокой анестезии,
например приблизительно на 8- 10-й мин
ингаляции 4% галотана (или 6-8%
севофлюрана) и кислорода. Также эффективно
53
Возраст |
Размер трубки, мм |
До 6 мес |
3,0 |
От 6 мес до 2 лет |
3,5 |
От 2 до 5 лет |
4,0 |
Старше 5 лет |
4,5 |
Поддержание
проходимости ВДП при обструкции
инородным телом
Н. Heimlich
так
описывает методику удаления инородного
тела, попавшего в ВДП: спасатель, стоя
сзади, руками обхватывает пострадавшего,
помещает большой палец одного кулака
между пупком и нижним краем грудины,
кулак захватывается другой рукой, после
чего производится толчок по направлению
внутрь и вверх. У беременных и пациентов
с ожирением применяются грудные толчки:
руки спасателя, стоящего сзади,
охватывают грудь пострадавшего,
кулак помещается поверх середины
грудины, затем делается толчок по
направлению внутрь и вверх. Необходимо
помнить о возможности возникновения
рвоты, аспирации, перелома ребер,
баротравмы и разрыва органов [15].
Методика
удаления инородного тела, попавшего в
гортань и глотку, у младенцев спорна
и трудна. Американская академия педиатров
предлагает следующее: разместить
ребенка ничком, развести ноги, и удерживая
его на одной руке головой вниз, произвести
удар другой рукой между лопатками.
Прием Heimlich
не
рекомендуется применять у младенцев,
но может быть полезен у детей старше 1
года. Если мероприятия неудачны,
необходимо попробовать произвести
осевые сдавления грудной клетки или
пальцевое исследование глотки.
Нельзя забывать, что последний маневр
может привести к проникновению
инородного тела в гортань. Эффективный
54
Проблема |
Решение |
Кровотечение/осколки:
|
|
Отек мягких тканей, гематома:
|
|
55
Проблема |
Решение |
Двустороннний перелом тела/угла нижней челюсти: - смещение языка назад |
- тракция вперед за язык или челюсть |
Височно-нижнечелюстное повреждение:
|
|
Среднелицевой перелом:
|
- вытягивание вперед подвижного сегмента |
Перелом основания черепа:
к назотрахеальной интубации,
|
- оротрахеальная интубация трахеи |
Повреждение шейного отдела позвоночника |
с иммобилизацией позвоночника,
|
При
челюстно-лицевых травмах ИТ также
является эффективным и надежным
методом поддержания проходимости ВДП.
Перед проведением интубации оборудование
и инструментарий для хирургического
доступа в ВДП должны быть под рукой.
Выбор техники защиты ДП зависит от вида
обструкции, предполагаемых трудностей
при ПЛ (степень раскрытия рта,
выраженность анатомической деформации,
кровотечение, опыт врача). Если пациент
возбужден или необходима срочная
интубация, не ожидается трудная
ларингоскопия, то показана быстрая
индукция в анестезию. Если ПЛ
предполагается быть трудной или
невозможной, необходимо выполнить
интубацию под местной анестезией с
сохранением спонтанного дыхания
(схема 4.5, см. прил. к ч. 4). Техника местного
обезболивания в виде ингаляции или
распыления 4% раствора лидокаина на
заднюю стенку глотки и инъекции 2%
раствора лидокаина через перстневидную
мембрану позволяет осуществить процедуру
проведения ЭТТ без существенного
дискомфорта для пациента. Дополнительно
предлагается провести блокаду
верхнегортанного и языкоглоточного
нерва [3, 19, 20].
При
переломах основания черепа, подозрении
или наличии повреждения шейного отдела
позвоночника необходима иммобилизация
головы и шейного отдела позвоночника.
Рекомендуется
выполнение интубации методом, наиболее
доступным врачу. Это может быть ПЛ,
фиброоптическая интубация через нос
или рот, использование светящегося
проводника-стилета, «слепая» назальная
или
56
ретроградная
интубация [21,22]. Из-за выраженного
кровотечения попытка выполнения
фиброоптической интубации может
оказаться бесполезной. При неудачной
интубации рекомендуется экстренная
коникотомия, если предполагается
длительная ИВЛ — трахеостомия (например,
при множественных переломах лицевых
костей с повреждением головного мозга)
[3].
Несвоевременное
выявление повреждений глотки, гортани
и трахеи, сопровождающих челюстно-лицевую
травму, может привести к летальному
исходу [23, 24]. Различают тупую, проникающую
и комбинированную ларинготрахеальную
травму.
Общие
причины: автокатастрофы, нападения и
удушение, прямые удары,
сгибательно-разгибательные движения
шеи с разрывом трахеи, огнестрельные
ранения. Травмы гортани выше перстневидного
хряща составляют приблизительно
треть всех повреждений ВДП, проявляясь
отеком, контузией, гематомой, разрывом,
отрывом, дислокационным переломом,
повреждением щитовидной железы и
черпаловидных хрящей. Собственно
перстневидный хрящ повреждается в 15%,
что часто приводит к дисфункции
возвратного и гортанного нерва.
Проникающие травмы шеи в 25—50% случаев
сопровождаются повреждениями сонной
артерии, яремной вены, подключичных
сосудов, позвоночных артерий. Также
ларинготрахеаль- ной травме сопутствуют
повреждения глотки и пищевода (30%),
нервов спинного мозга, плечевого
сплетения (12%), верхушек грудной клетки
(10%) [11, 12,23-26].
Признаки
ларинготрахеального повреждения:
ненормальный
контур гортани,
подкожная
эмфизема,
шейные
экхимозы,
кровохаркание,
дыхательная
недостаточность,
хрипота,
дисфония,
кашель,
стридор,
шумное
дыхание,
дисфагия.
При
рентгенографии и компьютерной томографии
шеи можно обнаружить воздух в мягких
тканях, пневмомедиастинум, пневмоторакс,
перелом шейного отдела позвоночника,
повреждение хрящей и мягких тканей;
при ларингоскопии — паралич голосовых
связок, разрывы слизистой, хрящей,
гематомы, рваные раны.
Манипуляции
на ВДП при ларинготрахеальной травме
могут привести к ухудшению состояния
пациента. Из-за неправильного введения
ЭТТ или
57
повреждения
слизистой оболочки во время «слепой»
интубации может случиться полная
обструкция ДП [27]. Давление на перстневидный
хрящ противопоказано, так как оно может
привести к ларинготрахеальному разрыву.
Вентиляция под положительным давлением
может очень быстро ухудшить прохождение
воздуха, и по возможности надо всегда
сохранять спонтанное дыхание пациента
до тех пор, пока трубка не будет размещена
дистальнее места повреждения. Выполнение
коникотомии не рекомендуется, так
как она может повредить гортань. При
проникающих ранениях ДП допустимо
проведение ИТ под прямой визуализацией
в ожидании последующего оперативного
вмешательства [24]. Таким образом,
оптимальным методом интубации
является трахеостомия под местной
анестезией (схема 4.6, см. прил. к ч. 4).
Ларингоспазм
Ларингоспазм
— функциональная обструкция ВДП,
патофизиологический механизм которой
еще до конца не известен. Ларингоспазм
возникает внезапно во время индукции
в анестезию и после экстубации трахеи.
Чаще отмечается в раннем возрасте, у
детей до 9 лет — 17,4 случаев на 1000
анестезий, тогда как у взрослых и детей
в совокупности — не более 8,7 случаев.
Самая высокая частота ларингоспазма
наблюдается у детей с сопутствующими
инфекциями ДП — 95,8 случаев на 1000 детей
[28, 29]. Ларингоспазм — грозное осложнение
анестезии, в литературе имеются
многочисленные сообщения коллег об
остановке сердца, вызванном данным
осложнением [30].
Неадекватная
анестезия, наличие назогастрального
зонда, аспирация, бессознательное
состояние и преждевременная экстубация
— факторы, раздражающие ВДП и
способствующие возникновению
ларингоспазма [28].
Клиника
спазма появляется внезапно и быстро,
характеризуется напряженными
дыхательными усилиями, подобными тем,
которые наблюдаются во время удушья,
стремительно снижается сатурация,
нарастает цианоз кожных покровов.
Ларингоспазм обычно прекращается либо
при наступлении глубокой гипоксии,
либо после медикаментозного лечения.
Введение небольших доз лидокаина (1-1,5
мг/кг), атропина (0,01 мг/кг), сукцинил-
холина (4-6 мг/кг) или рокурония (0,4 мг/кг)
с одновременной масочной вентиляцией
под положительным давлением купирует
ларингоспазм без последствий. Сообщается
об эффективном устранении осложнения
после внутривенного введения
нитроглицерина в дозе 4 мкг/кг [31]. За
2-3 мин перед экстубацией рекомендуется
введение лидокаина в дозе 2 мг/кг с целью
предотвращения ларингоспазма [28].
58
Список
основной литературы
Safar
P.
Cardiopulmonary Cerebral Resuscitation. 1st ed. Philadelphia: WB
Saunders, 1981.
Kastendieck
J.
Airway management. In: Rosen P., Barkin R. М.,
Levy
R. et al. eds. Emergency Medicine: Concepts and Clinical Practices.
3rd ed. St. Louis: CV Mosby Co; 1992: 86.
Joynt
G. M.
Airway management and acute upper airway obstruction//Oh’s
Intensive Care Manual, Eds. A.D. Bersten., N. Soni — Butterworth
Heinemann, 2003. P. 283-296.
Mittleman
R. E., Wetli
С.
V.
The fatal cafe coronary: foreign body airway
obstruction/Am.
Med. Assoc. 1982; 247: 1285-1288.
Injury
Chart Book, Health in the US 1996-1997. Washington, D.C.: National
Center for Health Statistics. 1997: 25-26.
Harris
C. S.
et al.
Children asphyxiation by food: a national analysis and overview//
JAMA. 1984; 251:2231.
Lima
J.
Laryngeal foreign bodies in children: a persistent,
life-threatening problem// Laryngoscope. 1989; 99: 415-420.
Hogg
N. J. et al.
Epidemiology of maxillofacial injuries at trauma hospitals in
Ontario, Canada, between 1992 and 1997/Trauma. 2000; 49: 425-432.
Gwyn
P. P., Carraway J.
H.,
Horton С.
E.
Facial fractures: associated injuries and complications//Plast.
Reconstr. Surj. 1971; 47: 225-230.
Luce
E. A., Tubb T. D., Moore A. M.
Review of 1000 major facial fractures and associated
injuries//Plast. Reconstr. Surtj. 1979; 63: 26-30.
Miller
R. H., Duplechain J. K.
Penetrating wounds the neck//Otolaryngologic Clin . North. Am.
1991; 24: 15-29.
Gussack
G. S., Jurkovich G. J., Luterman F.
Laryngo-tracheal trauma: a protocol approach to a rare
injury//Laryngoscope. 1986; 96: 660-665.
Crosby
R.
The difficult airway 2//Anesthesiol. Clin. North Am. 1997; 13:
495-749.
Badgwell
J. М.,
McLeod
М.
E.,
Friedberg J.
Airway obstruction in infants and children// Can. J. Anaesth. 1987;
34: 90-98.
Heimlich
H. J.
A life saving maneuver to prevent food-choking//J. Am. Med. Assoc.
1975; 234: 398-401.
Bogdonoff
D. L., Stone D. J.
Emergency management of the airway outside the emergency room//Can.
J. Anaesth. 1992; 39: 1069-1089.
American
Academy of Pediatrics committee on accident and poison prevention.
First aid for the choking child//Pediatrics. 1988; 81: 740-742.
Neal
M. R., Groves J., Cell I. R.
Awake fibreoptic intubation in the semi-prone position following
facial trauma//Anaesthesia. 1996; 51: 1053-1054.
Gotta
A. W., Sullivan C. A.
Superior laryngeal nerve block: an aid to intubating the patient
with a fractured mandible//Trauma. 1984; 24: 83-85.
Webb
A. R. et al.
Local anaesthesia for fibreoptic bronchoscopy: transcricoid
injection or the spray as you go technique//Thorax. 1990; 45:
474-477.
Verdile
V. P., Chang J.
L., Bedger
R.
Nasotracheal intubation using a flexible lighted stylet//Ann.
Etnerg. Med 1990; 19: 506-510.
King
H., Huntington
C., Wooten
D.
Translaryngeal guided intubation in an uncooperative patient
with maxillofacial injury: a case report//Trauma. 1994; 36:
885“’886.
Mathison
D. J., Grillo H.
Laryngotrachcal trauma//Ann. Thome. Surg. 1987; 43: 254-263.
59
Cicala
R. S. et al.
Initial evaluation and management of upper airway injuries in
trauma patients//Clin. Anesth. 1991; 3: 91-98.
Trone
Т.
H.,
Schaefer S. D., Carder H. M.
Blunt and penetrating laryngeal trauma: a 13 year
review//Otolaryngol. Head. Neck. Surg. 1980; 88: 257-261.
Sacco
J. J., Holliday D. W.
Submucosa epiglottic emphysema complicating bronchial
rupture//Anesthesiology. 1987; 66: 555-557.
Manson
P. N., Hoopes J. E., Su С.
T.
Structural pillars of the facial skeleton: an approach to the
management of Lc Fort fractures//Plast. Reconstr. Surg. 1980; 66:
54-61.
Principles
of airway management/Eds. В.
T.
Finucane, A. H. Santora. Springer-Verlag, 2003. P. 255-303.
Roy
W.
L., Lerman
J.
Laryngospasm in paediatric anaesthesia//Can. J. Anaesth. 1988; 35
(1): 93-98.
Morray
J. P. et al.
Anesthesia-related cardiac arrest in children//Anesthesiology.
2000; 93(1): 6-14.
Sibai
A. N., Yamout I.
Nitroglycerin relieves laryngospasm//Acta. Anaesthesiol. Scand.
1999; 43 (10): 1081-1083.
60
Приложение
к части 4
Схема
4.1.
Прогрессирующая обструкция у детей
[3]
61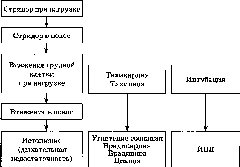
Схема
4.2.
Алгоритм действий
при неполной обструкции ВДП у взрослых
[3]
62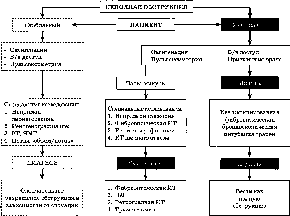
Схема
4.3.
Алгоритм действий
при полной обструкции ВДП у взрослых
[3]
63
Схема
4.4.
Алгоритм действий
при полной обструкции ВДП у взрослых
[14]
64
Схема
4.5.
Алгоритм действий
в целях
поддержания проходимости ВДП при
челюстно-лицевых травмах [3]
65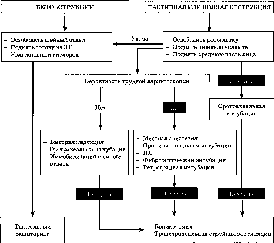
Схема
4.6.
Алгоритм поддержания
проходимости ДП
при
ларинготрахеальном повреждении [3]
66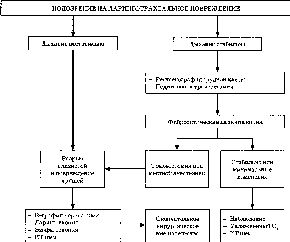
1. |
Устройство, способное подавать 100% кислород, включая мешок и маску. |
2. |
Отсос, способный создавать отрицательное давление до 25 см Н20. |
3. |
Две ларингоскопические рукоятки и разные прямые и изогнутые клинки. |
4. |
Языкодержатель. |
5. |
Воздуховоды. |
6. |
Различные эндотрахеальные трубки. |
7. |
Иглы и шприцы. |
8. |
Проводник. |
9. |
Гибкие катетеры для аспирации. |
10. |
Щипцы Мэджилла. |
11. |
Лейкопластырь. |
12. |
Полотенце. |
13. |
Местный анестетик. |
14. |
Ларингеальные маски разных размеров. |
Отмечается,
что оба ларингоскопа должны функционировать,
манжеты трубок должны быть проверены
на предмет целостности, трубка — хорошо
смазана гелем.
67
1. |
Ригидные бронхоскопы разных видов и размеров. |
2. |
Ларингоскоп Bullard. |
3. |
Резиновые эластические бужи. |
4. |
Фиброоптическое оборудование для взрослых и детей. |
5. |
Интубационная ЛМ. |
6. |
Пищеводно-трахеальная комбинированная трубка Combitube. |
7. |
Набор для чрескожной коникотомии. |
8. |
Набор для транстрахеальной струйной вентиляции. |
Акушерскими
анестезиологами используется аналогичный
перечень оборудования, причем
использование инвазивных методов
поддержания проходимости ВДП —
только в крайних случаях [5]:
Набор
ларингоскопов Макинтоша (короткие и
длинные клинки).
Ларингоскоп,
снабженный гибким наконечником (McCoy).
Оральные
и носовые воздуховоды.
Различные
эндотрахеальные трубки.
Эластический
буж.
Классические
и интубационные ларингеальные маски
(размер 3-4).
Волоконно-оптический
ларингоскоп.
Набор
для коникотомии и оборудование для
вентиляции.
Выбор способов поддержания проходимости ВДП в трудных ситуациях зависит от фактической ситуации, анатомических особенностей строения шеи, подготовки анестезиолога и включает в себя следующие методы [2, 4, 6]:
Применение назальных, оральных, фарингеальных и ларингеальных воздуховодов.
Использование классической JIM.
Интубация назо- или оротрахеальным способом «в сознании».
Введение интубационной JIM с последующей интубацией.
Фиброоптическая интубация.
Введение пищеводно-трахеальной комбинированной трубки Combitube.
Интубация вслепую светостержневым устройством (Lightwand).
68
При трудной вентиляции |
При трудной интубации |
|
|
По
мнению Bersten
&
Soni
[4],
стоит учитывать не только создавшуюся
ситуацию, но и состояние пациента, в
котором он находится (табл. 5.2).
О преимуществе
альтернативных методов при наличии
признаков ТДП сообщают Т. Asai
et al. [8].
Так, при анализе 1005 интубаций ПЛ,
проведенная 958 пациентам, была с
затруднениями в 11,7% случаев, в остальных
47 интубациях, где применялись
альтернативные методы (фиброоптическая
бронхоскопическая ИТ, ретроградная
ИТ, «слепая» назальная ИТ), затруднения
отмечались лишь в 0,6% случаев.
Проведенный
среди израильских анестезиологов опрос
показал, что при ТДП предпочтение
отдается ЛМ и фиброоптическому методу
ИТ, а также, в зависимости от клинической
ситуации, активно применяются другие
альтернативные методы (табл. 5.3, 5.4) [9].
69
Состояние пациента |
При трудной масочной вентиляции |
При трудной интубации прямой ларингоскопией |
В сознании |
|
|
В анестезии |
- ЛМ |
- вентиляция мешком/маской |
Без сознания и «пустым» желудком |
|
|
Без сознания, с «полным» желудком |
- чрескожная коникотомия |
с давлением на перстневидный хрящ,
|
Таблица
5.3
Предпочитаемые
способы поддержания проходимости
ВДП при ТДП среди анестезиологов
Израиля [9] |
1-й выбор |
2-й выбор |
3-й выбор |
Ожидаемая трудная ИТ |
РА в 70% |
ФОИТ в 23% |
ЛМ в 7% |
Непредвиденная неудавшаяся ИТ, адекватная масочная вентиляция |
ЛМ, затем ИТ ЭТТ в 29% |
Пробуждение, затем ФОИТ в 27% |
Пробуждение, затем ФОИТ в 24% |
Непредвиденная неудавшаяся ИТ, трудная или невозможная масочная вентиляция |
ЛМ в 83% |
Коникотомия в 10% |
Трахеостомия в 7% |
Примечание.
РА - регионарная анестезия, ЛМ -
ларингеальная маска, ИТ - интубация
трахеи,
ФОИТ
- фиброоптическая ИТ.
Необходимо
отметить, что применение РА вместо
общей анестезии при ожидаемой трудной
ИТ — не решение проблемы поддержания
проходимости ВДП. Приемлемым этот
способ является только в условиях
оснащенности операционной оборудованием
для проведения адекватной вентиляции
и выполнения интубации в любой момент
[7].
70
Ситуация |
Предпочитаемые способы по степени убывания |
||
Ангина Людвига |
Трахеостомия в 43% |
ФОИТ в сознании в 35% |
ПЛ в сознании в 22% |
Перелом верхней челюсти Le Fort III |
Трахеостомия в 58% |
ПЛ в сознании в 22% |
Ретроградная ИТ в 20% |
Переломы нижней челюсти |
Вентиляция маской в 39% |
ФОИТ в сознании 28% |
Назальная ИТ «вслепую» в 20% |
Ревматический артрит, анкилозирующий спондилит |
ФОИТ в сознании в 64% |
ПЛ в сознании в 36% |
- |
Кровотечение в ротовую полость |
ПЛ в сознании в 62% |
Ретроградная ИТ в 38% |
- |
Девиация, компрессия трахеи |
ПЛ в сознании в 66% |
ФОИТ в сознании в 34% |
- |
Ожидаемая трудная ИТ, противопоказания к РА |
ФОИТ в сознании 73% |
ПЛ в сознании в 27% |
- |
Примечание.
РА - регионарная анестезия, ЛМ -
ларингеальная маска, ИТ - интубация
трахеи, ЭТТ - эндотрахеальная трубка,
ФОИТ - фиброоптическая ИТ, ПЛ - прямая
ларингоскопия.
Для
того чтобы врач справился в определенной
критической ситуации, ему необходимо
«попасть в нее» приблизительно 29 раз
[11]. Опыт успешного выполнения
интубации ПЛ за 30 с в 90% случаев приходит,
по данным С. Konrad
et al. [12],
в среднем после 57 (47 ±11)
попыток, что подтверждается исследованиями
J.
Mulcaster et al. [13].
Анестезиолог, включающий в свой план
поддержания проходимости ВДП те или
иные альтернативные методы, должен ими
владеть и уметь выполнить за максимально
короткое время (таблица 5.5). При наличии
соответствующего оборудования
ретроградную интубацию можно провести
за
мин.
[14], коникотомию — за 30-40 с [15-19].
71
Методы |
Необходимость опыта |
Время для проведения |
Метод окончательный |
Неинвазивные |
|||
Вентиляция мешком и маской |
+ |
секунды |
- |
ЛМ |
- |
менее 1 мин |
- |
Combitube |
- |
менее 1 мин |
+ |
Инвазивные (нехирургические) |
|||
Эндотрахеальная интубация |
|||
ПЛ |
+ |
вариабельно |
+ |
Бронхоскопия |
+ |
минуты |
+ |
Ретроградная интубация |
- |
минуты |
+ |
Инвазивные (хирургические) |
|||
Струйная вентиляция |
- |
менее 1 мин |
- |
Коникотомия |
|||
чрескожная |
- |
вариабельно |
± |
хирургическая |
+ |
минуты |
+ |
Трахеостомия |
|||
чрескожная |
+ |
минуты |
+ |
хирургическая |
+ |
минуты |
+ |
Приемы
и алгоритмы ведения трудного дыхательного
пути
При
наличии признаков или подозрении на
возникновение ситуации ТДП анестезиолог
обязан информировать пациента (его
представителя) о возможных осложнениях
и предполагаемых манипуляциях. При
подготовке инструментария и оборудования
для конкретной клинической ситуации
необходимо помнить об эффективности:
правильной
укладки пациента на операционном
столе;
преоксигенации
лицевой маской перед анестезией;
манипуляций
на гортани (приемы Селлика, BURP,
ретромолярный
доступ).
В
конце IX — первой половине XX века [20-23]
предположили, что оптимальное положение
головы и шеи во время ПЛ— позиция со
сгибанием шеи и разгибанием в
атлантозатылочном сочленении, иначе
известная, как «принюхивающееся»
положение. Отмечается, что плохое
положение пациента — самая частая
причина неудач при обеспечении
72
проходимости
ВДП [24]. Неспособность в сгибании шейного
отдела позвоночника и затылочном
разгибании в атлантозатылочном
сочленении препятствует выравниванию
осей гортани, глотки и рта (рис. 5.1).
Сгибание шеи или шейного отдела
позвоночника легко достигается
размещением валика ниже затылка (рис.
5.2). Разгибание в атлантозатылочном
сочленении легко достигнуть наклонением
головы назад вручную (рис. 5.3) или
вытягиванием вверх за нижнюю челюсть.
Состоятельность
этой теории методами лучевой диагностики
доказали P.
Bannister et al. [23]
и F.
Adnet et al. [25], продемонстрировав,
что «принюхивающееся» положение
выравнивает оси гортани, глотки и рта
таким способом, что ДП становятся
видимыми при ларингоскопии.
Способ
оптимизации позиции предлагается Н.
Schmitt
et al. [26]:
ассистент анестезиолога левой рукой
надавливает на перстневидный хрящ и
одновременно с этим правой рукой
поднимает голову пациента выше положения
«принюхивания». При этом улучшается
визуализация ларингоскопической
картины.
Однако
вместе с тем чрезмерное переразгибание
шеи на 12 мин и более — потенциальный
фактор гемодинамических нарушений и
пусковой механизм в патогенезе
интраоперационного инсульта. В 6% случаев
развитие инсульта во время анестезии
связано с трудной ИТ, летальность у
лиц, имеющих в анамнезе эпизоды нарушений
мозгового кровообращения может достигать
60% [27]. Изменение положения головы может
привести к изменению давления и объема
манжеты эндотрахеальной трубки, что
неблагоприятно влияет на стенки трахеи
[28].
Рис.
5.1.
Обычное положение головы
Рис.
5.2.
«Улучшенное» положение по Джексону
Рис.
5.3.
«Принюхивающееся» положение
73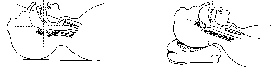
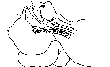
Важнейший
элемент вводного этапа анестезии —
преоксигенация. Она позволяет создать
кислородный резерв в организме на
случай затянувшейся интубации, если
учесть, что физиологическая потребность
в кислороде у взрослых — 3,5 мл/кг/мин,
у детей — 7 мл/кг/мин [29]. Традиционные
методы оксигенации: вдыхание на
протяжении 3 мин 100% кислорода со скоростью
5 л/мин [3], выполнение 8 глубоких вдохов
в пределах 60 с при скорости потока не
менее 10 л/мин [30] или глубокое дыхание
в течение 1,5-2 мин при потоке 10 л/мин
[31].
Обеспечение
оксигенации достигается масочной
вентиляцией одной или двумя руками с
одновременным применением наружного
ручного «тройного» приема: разгибания
шеи, выдвижения нижней челюсти вперед
и вниз (рис. 5.4, 5.5) [32]. Однако она будет
неэффективной, если отсутствует опыт
в проведении такой вентиляции, размеры
маски и лица не соответствуют друг
другу или у больного имеется борода
[6]. При неадекватной вентиляции поток
воздуха может инсуффлировать в желудок
с возникновением риска рвоты,
аспирации и сердечно-сосудистых
нарушений.
О
давлении на перстневидный хрящ впервые
упоминается в 1774 г.: д-р Monro
использовал
этот прием для предотвращения растяжения
желудка во время раздувания легких
у людей после утопления [33]. В 1961 г. В.
Sellick
ввел
прием давления на перстневидный хрящ
в анестезиологическую практику, и
с тех пор это важнейший элемент алгоритмов
обеспечения проходимости ВДП.
Проведение приема предотвращает
аспирацию и регургитацию желудочного
содержимого в течение индукции в
анестезию, улучшает визуализацию
гортанных структур [34, 35].
Рис.
5.4.
Вентиляция лицевой маской с применением
наружного ручного «тройного» приема
74
Рис.
5.5.
Вентиляция лицевой маской одной или
двумя руками
Правильное
выполнение приема Селлика [34]:
Надавливание
на перстневидный хрящ производится
помощником анестезиолога.
Манипуляция
начинается в момент потери пациентом
сознания.
Большой и средний пальцы помещаются с обеих сторон перстневидного хряща, а указательный палец — выше хряща, тем самым предотвращается его боковое движение.
Ошибки при проведении приема [36, 37]:
Хрящ пальпаторно не распознается — неправильно выбрано время проведения приема и/или направление давления.
Прилагается слишком маленькая или слишком большая сила давления — может привести к таким серьезным осложнениям, как невозможность обеспечения проходимости ВДП, рвота, аспирация, гипоксия, прямая травма тканей шеи, разрыв пищевода [35, 38, 39].
Канадскими анестезиологами был апробирован и введен в практику прием BURP (backward, upward, and rightward pressure on the thyroid cartilage): давление на щитовидный хрящ в сторону шейного отдела позвоночника (назад), максимально вверх и вбок (вправо) [40]. Прием эффективно улучшает видимость голосовых связок при ПЛ, поэтому рекомендуется во всех случаях трудной интубации [41-43].
Давление на щитовидный хрящ в некоторых случаях может помешать введению ларингоскопа, продвижению бужа-интродьюсера, размещению ЛМ, поэтому манипуляцию желательно проводить осторожно при полном взаимодействии анестезиолога и его опытного помощника [37, 44].
Дополнительное улучшение обзора связок также может быть достигнуто легким поворотом головы влево, клинок ларингоскопа следует вводить от правого угла рта (ретромолярный доступ) при одновременном проведении
75
приема
BURP
[45].
Замечено, что введение ларингоскопа
со стороны левого моляра также улучшает
визуализацию гортанных структур у
пациентов с трудной ларингоскопией
(рис. 5.6) [46].
Рис.
5.6.
Ретромолярный доступ
За
период с 1973 по 1991 г. тема трудной интубации
упоминалась в мировой литературе
приблизительно до 2000 раз [47]. Клиницисты
продолжают поиск универсального решения
проблемы, и на сегодняшний день
существует множество рекомендаций
и алгоритмов поддержания проходимости
ВДП, изданных различными клиниками и
национальными анестезиологическими
обществами.
Алгоритмы
— свод правил или рекомендуемых
последовательных мер, цель которых
заключается в облегчении работы
анестезиолога при трудностях
поддержания проходимости ВДП и уменьшении
неблагоприятных исходов [48]. Алгоритмы
структурно схожи между собой, но имеют
некоторые различия, обусловленные
областью применения, возникшей
ситуацией, состоянием пациента
(схема 5.1, см. прил. к ч. 5). В этой главе
будут описаны некоторые из них.
Первый
алгоритм действий при неудачной
интубации был предложен М. Tunstall
в
1976 г. [49] и состоял из общих рекомендаций
по ведению пациента во время вводной
анестезии, предупреждению и купированию
возможной аспирации (схема 5.2, см.
прил. к ч. 5).
76
В
1991 г. J.
Benumof возобновил
полемику по проблеме алгоритмизации
действий при трудной интубации [50],
впоследствие ASA
разработала
и выпустила в свет (в 1993 г.) алгоритм
действий при ТДП [51], который позже
неоднократно усовершенствовался.
Последняя версия алгоритма представлена
в 2003 г. в рамках «Рекомендаций по ведению
трудного дыхательного пути» [7].
Параллельно в Канаде Е. Crosby
et al. провели
обширный систематический обзор по
данной теме [52]. Северо-амери- канские
рекомендации принципиально не отличались
от таковых, выпущенных ASA.
В
алгоритме ASA
последовательно
рассматриваются две ситуации: проблемные
ДП у пациента в сознании и без сознания
(схемы 5.3. А, Б, см. прил. к ч. 5). При неудачной
попытке интубации в сознании рекомендуется
(примечание а)
продолжение операции и анестезии с
использованием лицевой маски или
JIA,
под
местной инфильтративной анестезией
или регионарной блокадой при отсутствии
проблем с масочной вентиляцией. Под
инвазивным доступом подразумеваются
коникотомия и чрескожная трахеостомия
(примечание Ь). Из альтернативных методов
(примечание с) предпочтение отдается
специальным ларингоскопическим клинкам
(например Маккоя), JIM
—
как проводнику для последующей
ларингоскопической или фиброоптической
интубации, стилетам, проводникам,
светостержневым устройствам,
ретроградной интубации, «слепой»,
оральной/ назальной и ретроградной
интубации.
При
безуспешных попытках интубации и
возможности пробуждения пациента
рекомендуется интубация в сознании
либо отмена операции (примечание
d).
Варианты
для экстренной неинвазивной вентиляции
ДП включают в себя использование
ригидного бронхоскопа,
пищеводно-трахеаль-
ной комбинированной трубки Combitube
или
транстрахеальной струйной вентиляции
(примечание е).
Алгоритм,
предложенный R.
Georgi et al. в
1991 г., относится преимущественно к
проблеме неожиданного ТДП (схема 5.4,
см. прил. к ч. 5). Рассматриваются две
ситуации: адекватная и неадекватная
масочная вентиляция [53]. При адекватной
масочной вентиляции немецкими докторами
рекомендуются к использованию
проводники, эластичный буж, любые
специальные ларингоскопические
клинки, позволяющие провести интубацию
без прямой визуализации голосовой
щели, или ригидный бронхоскоп
Воп-
fils,
кончиком
которого можно достичь связок. Если
связки не визуализируются (опухоль,
отек), но голову можно разогнуть,
эффективно введение экстренного
трахеоскопа для вентиляции с последующим
наложением трахеостомы или применение
фиброоптической техники. Если нет
крайней необходимости в эндотрахеальной
интубации, допустимо введение классической
и интубационной ЛМ.
Алгоритм
Georgi
прост,
но пригоден для экстренной медицины.
Предусматривает в обеих ситуациях
владение интубационным трахеоскопом
77
Bonfils,
ригидным
вентиляционным трахеоскопом, что
ограничивает применение алгоритма
как стандарта в наших условиях.
Европейским
советом по оживлению (ERC)
[54]
в середине 1990-х гг. опубликован
алгоритм поддержания проходимости ВДП
у пациентов, находящихся в критическом
состоянии (или в апноэ) (схема 5.5, см.
прил. к ч. 5). Первоначально алгоритм
являлся компонентом сердечно-легочной
реанимации. В настоящее время
рекомендуется как самостоятельная
процедура в догоспитальных условиях.
В
алгоритме акцентируется внимание на
правильной укладке пациента для
анатомического выравнивания ДП, на
осторожности обращения с шейным отделом
позвоночника, приеме Селлика и
оксигенации.
Рекомендуется
интубация в условиях ПЛ, из альтернативных
способов — JIM
и
Combitube,
причем
предпочтение отдается эндотрахеальной
интубации, как наиболее надежному
способу. С 2000 г. в дополнение к
альтернативным методам допускается
применение в алгоритме интубационной
JIM
и
ларингеальной трубки [55]. Инвазивные
методы, как крайние меры помощи,
представлены чрескожной и хирургической
коникотомией.
План
действий в неотложной ситуации,
адаптированный для экстренной медицины,
предлагается специалистами университетской
клиники им. Йо- ганна Гуттенберга (г.
Майнц, Германия) [56]. Алгоритм предусматривает
ситуации, когда по тем или иным причинам
резко ухудшается состояние пациента
и имеются показания к экстренной
интубации: угнетение сознания по
шкале Глазго свыше 8 баллов, Sa02
менее
90%, ЧДД менее 9 или более 30 в мин (схема
5.6, см. прил. к ч. 5).
В
той же клинике практикуется внутрибольничный
усовершенствованный алгоритм поддержания
проходимости ВДП для плановой хирургии
[56]. Данный алгоритм является
последовательностью процедур и методов,
разделенных на шесть секций различных
ситуаций, которые могут произойти во
время анестезии (схемы 5.7. А-Е 6 шт., см.
прил. к гл. 5).
Ситуации,
освещенные в алгоритме:
Общий
осмотр, обнаружение признаков трудного
обеспечения проходимости ВДП.
Интубация
или вентиляция невозможна (часть А).
Интубация невозможна, но возможна масочная вентиляция (часть В).
