
1 курс / Психология / Диагностика_и_лечение_психических_и_наркологических_расстройств (4)
.pdfтолькотонкимслоемволоконтапетума. Описанныевышеанатомическиеособенностирасположенияпроводящихпутейвстволевисочнойдолиимеютрешающее значениедлядвухнейрохирургическихдоступов:трансcильвиевогодоступакмедиальным отделам височной доли и височного трансоперкулярного доступа к темпоро-инсулярным глиомам. При обоих доступах происходит пересечение стволависочнойдоли,чтоособенноважноучитыватьвдоминантномполушарии.
2.2.2. Функциональная МРТ
Одной из приоритетных задач нейроофтальмологии и лучевой диагностики является оценка функционирования различных участков зрительной коры. Сложность организации зрительного анализатора привела к поиску нейровизуализационных методик, позволяющих адекватно оценивать зрительное восприятие и механизмы переработки полученной зрительной информации.
Функциональная магнитно-резонансная томография (фМРТ) — одна из наиболее перспективных методик оценки корковых представительств зрительного анализатора. Структурные изменения при повреждении коры головного мозга могут быть неочевидны, поэтому нейровизуализационные исследования головногомозгаупациентовс поражениемзрительнойкорыподразумевают подсобой исследование его функциональной сохранности [26, 27,28].
ФМРТ как метод возникла в 1990 году в лаборатории AT&T Bell (США) под руководством С. Огавы, который применил к МРТ магнитные свойства оксигенированной и дезоксигенированной крови, открытые в 1936 году Л. Полингом иЧ.Кориеллом.Тогдаже,в1990году,С.ОгаваописалBOLD-контраствэкспери- ментахнагрызунах,помещенныхвсильноемагнитноеполе[21].В1992годубыли опубликованы первые исследования с фМРТ на людях. В этих экспериментах ис- пользовалисьМР-сканерыссилоймагнитногополяв1,5Тл.К.Квонгиегокол- леги смогли добиться активации зрительной коры человека, используя последовательность EPI (Echoplanar imaging) с градиентным эхом и инверсионным восстановлением при силе магнитного поля в 1,5 Тл. Дж. Белливо и его команда доказали, что как кровоток, так и объем крови локально увеличивались при активности нервной ткани. С. Огава и коллеги, проведя аналогичное исследование с использованием более сильного магнитного поля (4,0 Тл), показали, что BOLD-сигнал зависит от потери сигнала T2*.
Выполнение фМРТ при различных патологических состояниях позволяет не только оценить организацию и функциональную специализацию зрительной корыголовногомозга,ноисделатьвыводыовзаимосвязимеждузонамизрительной коры и специфическими когнитивными функциями [22]. На сегодняшний день сравнительные исследования, проводимые на здоровых добровольцах и пациентах с патологическими изменениями, помогают судить о функциональной организации коры головного мозга [19, 20, 24].
Магнитные поля, последовательности импульсов, а также процедуры и методы, которые были использованы в первых исследованиях, применяются и всовременнойфМРТ.Насегодняшнийдень,сразвитиемтехнологии,естьвоз-
409
можность собирать данные из большего количества срезов и подвергать их тщательной предварительной обработке и статистическому анализу.
Виды фМРТ исследований условно можно разделить на 2 блока:
1.Картирование функционально значимых зон (ФЗЗ) (task-fMRI), при котором обследуемый выполняет определенные задания. Получаемые данные подвергаются процессу постпроцессинга, и результатом являются цветные карты активации, наложенные на анатомические изображения головного мозга.
2.ФМРТ состояния покоя (resting state fMRI) — исследование спонтанной нейрональной активности или состояния покоя. Этот подход позволяет исследовать функциональную связность различных участков головного мозга между собой при разного рода заболеваниях ЦНС.
ФМРТ состояния покоя
Исследование нейронных сетей покоя является одним из перспективных направленийисследованиявсовременнойнейрорадиологии[18].Функциональная нейровизуализация в покое подтверждает динамическую активность головного мозга медленными (<0,1 Гц) колебаниями BOLD-сигнала (Blood Oxygen Level Dependent), которые топографически организуются в нейронные сети покоя. Функционально объединенные совокупности нейронов отличаются стабильностью в отношении своих структурных составляющих, однако могут изменять покрытие входящих в их состав зон, в зависимости от состояния или повреждения головного мозга.
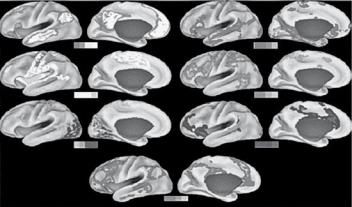
Первая выявленная сеть покоя (B. Biswal et al.) состояла из первичной моторной коры правого и левого полушарий большого мозга и в настоящее время известна как первичная моторная сеть покоя. В дальнейшем были выделены первичная зрительная СП, слуховая СП и др. (рис. 3).
a |
0 |
1 |
d |
0 |
1 |
|
|
||||
b |
0 |
1 |
e |
0 |
1 |
|
|
||||
c |
0 |
1 |
f |
0 |
1 |
|
|
g
0 1
Рис. 3. Поверхностные графики сетей в состоянии покоя, полученные из алгоритма нечетких c-средних(Leeetal.2012a):(а)сетьпассивногорежима работы;(b)соматомоторнаясеть;(c) визуальнаясеть;(d)языковаясеть;(e)дорсальнаясетьвнимания;(f)вентральнаясетьвнимания;
(g) сеть фронтопариетального контроля
411
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Определение связанности нейронов между собой достигается тщательным структурно-анатомическим исследованием и качественной математической постобработкой полученных данных, которая позволяет выявить наличие и оценить выраженность функциональных связей между различными зонами интереса. В процессе построения и анализа сетей используются эффективные коннективности, которые в совокупности могут представить полную картину функционированиязрительныхструктур.ПрипомощиэтогометодаобработкиданныхфМРТ становится возможным определение структуры функциональных взаимоотношениймеждузрительныманализаторомидругимифункциональнымиструктурами головного мозга. Понимание изменений внутри зрительных нейронных сетей и качество связи между различными их элементами может иметь важное клиническое значение для оценки функциональной целостности зрительного пути.
Картирование функционально значимых зон
Для выполнения фМРТ со зрительной парадигмой вначале используется стандартный протокол обследования головного мозга с выполнением импульсной последовательности3D-MPRAGE.Далееиспытуемомупредъявляетсястимульный материал, в зависимости от задач исследования. Так, для оценки остроты зрения в качестве зрительных стимулов используются изображения, составленные из элементов Габораразличной ориентации, соответствующих рецептивным полям первичных клеток зрительной коры. Для достижения активации испытуемому поочередно предъявляются различные изображения: в покое — неподвижные матрицы, в период активации — матрицы с вращающимися элементами Габора.
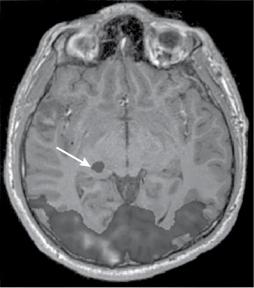
Рис. 4. МРТ зрительной коры головного мозга со стимуляцией. Стрелкой показана активация наружного коленчатого тела
410
Приоценкеполейзренияпроводитсямонокулярноеисследованиесозрительной стимуляцией в виде шахматных паттернов, изменяющихся от центра к перифериипропорционально кортикальному фактору магнификации.В периодпокоя испытуемомупредъявляется«неподвижнаякартинка».Стимуляцияосуществляется путем реверсирования шахматных паттернов с частотой, оптимальной для восприятия головным мозгом. В ходе математической постобработки полученных данных строятсястатистические t-карты,отражающие активациювответ на предъявление стимульного материала. В конечном итоге исследования визуализируютсяучасткикорыголовногомозга вобластишпорнойбороздызатылочной доли, ответственные за конечное восприятие изображениязрительным центром [23,25].Взависимостиот наличияилиотсутствияактивированных участковзрительной коры выносится заключение о функциональном состоянии зрительного анализатора (рис. 4).
Однако, не смотря на достигнутые успехи, фМРТ пока не позволяет определять кортикальные механизмы на уровне отдельных нейронов. В целом же, данный вид исследованияявляетсяобъективной, высокоэффективной инеинвазивной методикой современной нейровизуализации и может успешно использоваться в клинической офтальмологической практике.
Список литературы
1.Хьюбел Д. Х. Глаз, мозг, зрение. М.: Мир, 1982; 278 с.
2.Фейнман Р.Ф. Квантовая механика. Механизм зрения. М.: Мир, 173–240.
3.Кононова Е.П. Руководство по неврологии. Кн. 1. Анатомия и гистология нервной системы. М., 1959; 429–445.
4.Кононова Е.П. Руководство по неврологии. Кн. 2. Анатомия и гистология нервной системы. М., 1959; 185–191.
5.Хьюбел Д.Х., Визел Т.Центральныемеханизмызрения.Мозг.М.:Мир,1982;166–197.
6.Трон Е. Ж. Заболевания зрительного пути. Л.: Медгиз, 1956; 388 с.
7.Ярбус А. Л. Роль движений глаз в процессе зрения. М.: Наука, 1965; 173 с.
8.Сентаготаи Я. Единая теория мозга: утопия или реальность? Журнал Венгерской академии наук. 1979; 8–9: 601–616.
9.Скоромец А. А., Скоромец А.П., Скоромец Т. А. Топическая диагностика заболеваний нервной системы. СПб.: Политехника, 2012; 623 с.
10.Burgess N. The 2014Nobel Prize in Physiology or Medecine a spatial model for cognitive neuroscience. Neuron. 2014; 84(6): 1120–5.
11.Коржова В. Нобелевская премия по физиологии и медицине 2014 года. URL: biomolecula.ru. 2014.
12.Балунов О. А., Дубинина Е. Е., Шефер В. Ф. Современные представления о патогенезе заболеваний головного мозга, протекающих с деменцией. Психоневрология в современном мире. СПб., 2007; 135–137.
13.Грегори Р. Разумный глаз. М.: Мир, 1972; 216 с.
14.Табакаев И. Как построить глаз (Теория зрения Ременко С.Д.). Техника молодежи.
1981; 7: 21–28.
15.Белов Д. Р., Степанова Д. А., Колодяжный С.Ф. Движущая волна ЭЭГ человека при произвольных движениях руки. Журнал Высшей нервной деятельности им. И. П. Пав-
лова. М., 2014; 2: 166.
412
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
16.Баев А. А., Погосбекян Э. Л., Захарова Н. Е., Пицхелаури Д. И., Баталов А. И., Шкатова А. М., Шульц Е. И., Быканов А. Е., Маряшев С. А., Конакова Т.А., Пронин И. Н. Маг-
нитно-резонансная трактография на основе вероятностных алгоритмов разложения по сферическим функциям у пациентов с глиомами зрительных путей. Альманах клинической медицины. 2021; 49(1): 11–20. doi: 10.18786/2072-0505-2021-49-009.
17.Amaro Jr. E., Barker G.J. Study design in fMRI: Basic principles. Brain Cogn. 2006; 3 (60): 220–232.
18.Bae Y., Kumarasamy K., Ali I. M., Korfiatis P., Akkus Z., Erickson B. J. Differences Between
SchizophrenicandNormalSubjectsUsingNetworkPropertiesfromfMRI.J.Digit.Imaging. 2018; 31: 252–261. DOI 10.1007/s10278-017-0020-4.
19.Filippi M. fMRI techniques and protocols. Humana press, 2009;25.
20.Huettel S. A., Song A. W., McCarthy G. Functional Magnetic Resonance Imaging (2 ed.). Massachusetts: Sinauer, 2009: 503.
21.Ogawa S., Lee T.M., Nayak A. S., Glynn P. Oxygenation-sensitive contrast in magnetic resonance image of rodent brain at high magnetic fields. Magnetic Resonance in Medicine. 1990; 1 (14): 68–78. doi:10.1002/mrm.1910140108.
22.Salomatina T.,Akhmerova L., Andreev E., Ananieva N., Parfenova A. Functional brain mapping
ofspeechareasandtracts in pre-surgicalpreparingof patientswith braintumors.Neurobiology OfSpeechAndLanguage.Proceedingsofthe3rdInternationalConference.2019;60–61.
23.American Society of Functional Neuroradiology (ASFNR). Functional Imaging Paradigms (2007).URL:http://www.asfnr.org/wp-content/uploads/ASFNR-BOLD-Paradigms.pdf(visual paradigms on pp. 37–40).
24.DeYoe E.A., Ulmer J.L., Mueller W.M. et al. Imaging of the functional and dysfunctional visual system. SeminUltrasound CT MRI. 2015; 36: 234–248.
25.Drobyshevsky A., Baumann S.B., Schneider W. A rapid fMRI task battery for mapping of visual, motor,cognitive and emotional function. NeuroImage. 2006; 31: 732–744.
26.EngelS.A.,Glover G.H., WandellB.A.Retinotopic organization in human visual cortex and thes patial precision of functional MRI. CerebCortex. 1997; 7: 181–192.
27.Mishkin M., Ungerleider L.G., Macko K.A. Object vision and spatial vision: two cortical pathways. Trends Neurosci. 1983; 6: 414–417.
28.Warnking J., Dojat M., Guérin-Dungué A. et al. fMRI retinotopic mapping — step by step. NeuroImage. 2002; 17: 1665–1683.
410
УДК: 616.74-009:616.742.7-009.24-07-08(075.4)
Диагностика и лечение оромандибулярной дистонии
Д. В. Захаров, Ю. В. Коцюбинская, В. А. Михайлов
ВВЕДЕНИЕ
Вторичные краниальные дистонии
Краниальная (лат. cranium «череп») дистония — дистония, локализованная в пределах одной анатомической области — черепа, при которой в патологический процесс вовлекается жевательная и/или мимическая мускулатура лица. Это заболевание часто остается незамеченным, особенно у лиц с выраженным когнитивным снижением, значительным ограничением дееспособности или пожилых пациентов, возможно в связи с тем, что длительное время может протекать без грубых функциональных нарушений и не вызывать значимой инвалидизации, ограничиваясь лишь эстетическим дефектом. И только те пациенты, у которых избыточные движения в области лица приводят к выраженным расстройствам (расстройства речи, невозможность пережевывания пищи или затруднения глотания, потеря зрительного контроля и др.), попадают в поле зрения специалиста, причем не всегда профильного — нередко диагностический путь начинается с офтальмологов, стоматологов и пр.
Среди форм краниальной дистонии выделяют блефароспазм, оромандибулярную дистонию, тризм, ларингеальную дистонию, спастическую дисфагию, лингвальную дистонию и их сочетания. Нередко заболевание, начинаясь в одной группе мышц,распространяется надругие.Впервые блефароспазм ииныеформы краниальной дистонии описал в 1887году американский врач H.C.Wood[15]. Позже, в 1910 году французский невролог H. Meige сообщил о 10 пациентах с двусторонними сокращениями мышц лица, глотки, челюсти, дна ротовой полости
иязыкаиназвалэтосостояние «срединный лицевойспазм».Посколькудистонии
игиперкинезы могут самостоятельно уменьшаться и исчезают во время сна,
H. Meige пришел к выводу, что они носят психогенный характер, и одновременно предположил, что мышечные спазмы, за исключением мышц лица, могут быть результатом раздражения в стволовой области. Таким образом, H. Meige был первым, кто предположил вторичную природу краниальной дистонии. В 1972 году G. Paulson привел 3 случая сочетания блефароспазма иоромандибулярной дистониииназвалего «синдромМейжа».Чутьпозже,в1976году,C.D.Marsdenсообщилеще о 39 подобных наблюдениях, но далэтому состоянию другое наименование —«синдром Брейгеля». Это была его дань доктору R.E. Kelly,который первым обратил внимание на то, что мужчина, изображенный на картине «Зевака» Питера Брейгеля Старшего, страдает краниальной дистонией [18]. Позже, в 1983 году, J. Jankovic и J. Ford использовали термин «синдром Мейжа» для характеристики
414
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
сочетания блефароспазма и орофациальной или орофациоцервикальной дистонии у 100 пациентов.
Точных данных о распространенности краниальной дистонии нет. Это связано
сбольшимфенотипическимразнообразиемзаболеванияиегонедостаточнойдиагностикой.Сведенияопредставленностикраниальнойдистониикрайнезанижены [24]. Вторичный синдром Мейжа может быть проявлением поздней (тардивной) дистонииилидругого неврологическогозаболевания.Использованиенейролептиков ассоциировано с развитием тардивной дистонии с вовлечением краниоцервикальной мускулатуры в 10–20% случаев. Вероятность ее возникновения увеличиваетсяприпримененииэтихпрепаратовболеегода.Предполагается,чтовоснове развитиявторичногосиндромаМейжалежитповреждениефункциидофаминовых рецепторов с формированием их гиперчувствительности. Некоторые авторы полагают, что в возникновении индуцированных нейролептиками двигательных расстройств могут играть роль генетические факторы. Провоцировать развитие краниоцервикальной дистонии могут и другие препараты. К ним относятся противорвотныесредства(метоклопрамид),агонистыдофамина(леводопа,бромокриптин), редко — атипичные антипсихотики (оланзапин). В ряде исследований показано, что антидепрессанты и селективные ингибиторы обратного захвата серотонина,атакжеантигистаминныепрепараты,влияющиенацентральнуюдофаминергическую и холинергическую передачу, также способны вызывать развитие лицевых дискинезий [22]. Встречаются указания на взаимосвязь синдрома Мейжа
стравмойголовы,гипербилирубинемией,инсультомилидемиелинизациейвобластиствола,нормотензивнойгидроцефалией,билатеральнойталамотомией,опухолью,энцефалитомицеребральной гипоксией[21].Синдром Мейжаописанвструктуре многих неврологических заболеваний, сопровождающихся двигательными расстройствами. Так, J. Jankovic и J. Ford (1983), обследовав 100 пациентов с блефароспазмом и оромандибулярной дистонией, выявили эссенциальный тремор у 33 из них, симптомы паркинсонизма присутствовали у 9 больных, нёбным миоклонусом,хореей, рассеяннымсклерозом и акатизиейстрадали по 2 пациента.
Естьмнение,чтоблефароспазмиоромандибулярнаядистониямогутразвиться в болезнь Паркинсона, так как в основе этих заболеваний лежит дисфункция базальных ганглиев. F.Micheli etal. [19]сравнивали группы пациентовс краниальной дистонией и здоровых испытуемых, в каждой группе было по 105 человек. Болезнь Паркинсонаразвилась у 11 пациентовиз первойгруппы и толькоу 2 из второй. Однакосогласноданным другого исследования, основанного на опросе 99 пациентов с блефароспазмом, болезнь Паркинсона возникла лишь в 2 случаях.
Краниальные, а точнее лицевые, дискинезии являются важной клинической проблемой. Наши многолетние наблюдения свидетельствуют о чрезвычайно высокомпроцентедиагностическихошибокприэтойпатологии,чтообусловленоне только дефицитом теоретических знаний о патогенезе лицевых дискинезий, но иотсутствиемрубрификаций,детальныхописанийклиническихпроявленийэтих синдромов. В ряде работ вопросы классификации обсуждаются, но они, как правило, ограничиваются нозологической рубрификацией какого-либо отдельного
415
семиотического типа дистоний, например нозологической классификацией блефароспазма [11]. Вместе с тем существуют дистонии, встречающиеся только на одной половине лица (лицевой гемиспазм) или только в верхней (блефароспазм) или нижней его части (орофациальная дискинезия и др.). Наконец, целесообразно учитывать гиперкинезы, ограничивающиеся лицевой локализацией или первичновозникающиевлице,игиперкинезы,первичновозникающиевдругихчастях тела,нонапоследующихэтапах заболеваниявовлекающиемышцылица.
Однако детальных описаний вторичных форм лицевых дистоний крайне мало, анаибольшееколичество работлишьсвязано снейролептическиморолингвомастикаторным синдромом.
Анатомическаяклассификациядистоний,локализующихсявобластилица,на нашвзгляд,требуетобсуждения.Традиционнофокальныминазываютдистонии, локализующиеся в пределах одной части тела, например блефароспазм или оролингвальныедистонии[1].Однаковформированииоролингвальныхдискинезий одновременно могут участвовать мышцы, имеющие точки прикрепления, как
вобласти головы, так и шеи (m. platyzma, digastricusи т. д.).
Инаконец,вдистониикраниальнойобластивовлекаютсянетолькомимиче-
ские,но ижевательныемышцы,приводяв действие нижнюючелюсть, формально не являющуюся частью головы.Современные положения,разработанные коллективом авторов во главе с А.Albanese по проблеме дистонии и опубликованные в2013году,относятсиндромМейжаксегментарнымкраниальнымдистониям[4].
Оромандибулярная дистония (ОМД) — одна из форм фокальной краниальной дистонии,сопровождающаясянепроизвольнымидвижениямиимышечнымнапряжением в нижней половине лица и области рта [3]. В дистоническийпроцесс наиболеечастововлекаютсякруговаямышцарта,мышцыязыка,жевательныемышцы, подкожная мышца шеи. ОМД встречается как изолированно (фокально), таки можетбытьоднимизсимптомовсегментарнойилигенерализованнойформдистонии, когда в гиперкинез вовлечено нескольких частей тела (например, сочетание ОМД и спастической кривошеи или ОМД и дистонии верхней конечности) [12].
Рисунок гиперкинеза при ОМД у пациентов разнообразен. Так, R. Tinther,
J.Jankovic выделили 7 типов ОМД:
•периоральная дистония — дистония губ (perioral dystonia);
•дистоническое сведение челюстей (jaw-closingdystonia);
•дистоническое разведение челюстей (jaw-openingdystonia);
•дистоническоесмещение нижней челюсти (jaw-deviation dystonia);
•лингвальная дистония (lingual dystonia);
•фарингеальная дистония (pharyngeal dystonia); комбинированные формы
ОМД (combination) [7].
В качестве возможных факторов риска наибольшее значение в современной литературе отводится травматическому фактору. Так, в анамнезе у пациентов с ОМД часто имеются свидетельства травматического воздействия в области полости рта, такие как длительное стоматологическое вмешательство с долгим чрезмерным открытием рта, экстракция нескольких зубов, травмы нижней челюсти,
416
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
неправильноепротезирование.Внастоящеевремясчитается,чтотравматическое воздействие, в том числе стоматологическое вмешательство, является одним из провоцирующихдебютзаболеванияфакторов,механическоевоздействиеприводиткухудшениюпроприоцептивнойафферентацииикпоследующему развитию дистонии [8]. Вместе с тем в литературе нет свидетельств связи данного фактора и развития вторичной ОМД.
Наибольшее количество наблюдений вторичной ОМД связано с длительным приемомлекарственныхсредств[13].Распространенностьлекарственноиндуцированной дистонии у пациентов, получающих длительное лечение нейролептиками,составляетот5до20%.Данныедвигательныенарушениястойкосохраняются после отмены препарата, по меньшей мере в течение одного месяца, а порой нескольких месяцев или лет [5].
Впервые клинические проявления нейролептического синдрома описали
в1956 году немецкие врачи С.Kulenkampff и G.Tarnow,и в литературе данный синдром встречается под названием синдром Куленкампфа–Тырнова [17], хотя
всовременных источниках данный синдром чаще встречается под названием «букколингвомастикаторный синдром».
Факторамирискадляразвитияпозднейдистонииявляютсяпожилойвозраст, наличие аффективных расстройств, когнитивных нарушений [23]. По данным J.Jankovic,упожилыхженщинвдваразабольшешансовнаразвитиерасстройства. Механизм развития заболевания связан со способностью определенных лекарственных средств (не только нейролептиков) блокировать дофаминовые рецепторывобластибазальныхганглиев[16].Описанытакжеслучаилекарственной дистониинафонеприемаселективныхингибиторовобратногозахватасеротонина (флуоксетин, сертралин и циталопрам), резерпина, амиодарона, циметидина, препаратов вальпроевой кислоты [10, 17]. Иногда употребление наркотиков, таких как кокаин и метамфетамин, 3,4-метилендиокси-метамфетамине (экстази), также может вызывать дистонический гиперкинез [6], однако нередко пациенты скрывают сам факт употребления этих психоактивных веществ.
H. A. Jinnah и S. A. Factor описывали как наиболее часто встречающийся вариантсведениечелюстей,анавторомместеповстречаемостидистоническоеразведение челюстей [11]. Вместе с тем C.D.Esperet al. описывали как характерные для поздней нейролептической дискинезии гиперкинезы лица (преимущественно оральной его части) с непреодолимым стремлением к раскрыванию рта, высовыванию языка, своеобразные сокращения мимической и жевательной мускулатуры, напоминающие причмокивание и гримасничанье [9].
Еще одним мало описанным клиническим проявлением ОМД является бруксизм (от греческого слова brygmós — скрежет зубов). Американская академия по орофациальной боли в 2008 году определила бруксизм как дневное или ночное бессознательное сжимание, скрежетание, стирание и повреждение зубов. Считается, что 85–90% от общей численности населения скрежещут зубами в какие-то моментыжизни,хотятолькоу 5% из них развиваетсяклиническоесостояние бруксизма.Вторичныйбруксизм может развиватьсянафонежелтухи, приема ан-
417
типсихотических препаратов, наркотиков [4]. Выделяют две формы бруксизма: в состоянии бодрствования и во время сна (Ella B. et al., 2017). У некоторых людей бруксизм проявляется в дневное время в моменты стресса, у других он возникает во сне, возможно сочетание обеих форм [20]. Диагноз «бруксизм», как правило, клинический и в основном базируется на анамнестических сведениях, а также на наличии повышенной стираемости коронок зубов и нарушении целостности окклюзионной поверхности зубов [17].
Выраженное неудобство причиняет больным также слюнотечение, часто сопровождающее ОМД.Помимоэстетических проблем нафонегиперсаливации может появляться мацерация кожных покровов подбородочной области. Трудности возникают с процессом чистки зубов, умыванием; для женщин становится практически невозможным нанесение макияжа, выполнение любых косметологических процедур; для мужчин травмоопасным становится бритье.
Общая характеристика клинических наблюдений
В исследование включены 371 пациент с вторичными дистониями согласно определению Fahn, Marsden и Calne (1987), находившиеся на стационарном и амбулаторномнаблюдениинабазеФедеральногогосударственногобюджетногоучреждения «Национальный медицинский исследовательский центр психиатрии и неврологии им. В. М. Бехтерева» Министерства здравоохранения Российской Федерации [2].
Вошедшие в исследование 81 пациент с поздней нейролептической (тардивной) дистонией имели верифицированный диагноз «Шизофрения, параноидная форма, становление ремиссии»; диагноз и состояние ремиссии подтверждались врачом-психиатром непосредственно перед включением в данное исследование. В данную группу были отобраны пациенты с синдромальной ремиссией эндогенного заболевания. Данное состояние предполагает стабильное отсутствие позитивных симптомов, завершенность обратного развития проявлений острого периодаиисчерпываетсядефицитарнойнегативнойсимптоматикой.Всепациенты находилисьподамбулаторнымнаблюдением;состояниеремиссииотмечалосьне менее 6 месяцев. Все больные принимали только один нейролептик в средней терапевтической дозировке. Клиническая картина дистоний была представлена преимущественно краниальными дистониями и в меньшей степени дистониями в шее, туловище и конечностях, распределенными примерно поровну. У всех пациентовранеевкачествекорректоровтардивныхдистонийприменялисьхолинолитики, амантадины, миорелаксанты и пр. без существенных результатов. Пациенты с ранними (острыми) нейролептическими дистониями в исследовании участиянепринималииз-зауспешноститерапевтическихкорректоров,скоротеч- ности клинической картины и отсутствия стойкого двигательного паттерна.
При клиническом обследовании пациентов с вторичными дистониями обнаруженомногообразиеклиническихпроявленийдистонийкакмеждуэтиологическими группами, так и в пределах одной нозологии, что совпадает с мнением
418
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
