
6 курс / Клинические и лабораторные анализы / Гематология_Национальное_руководство
.pdf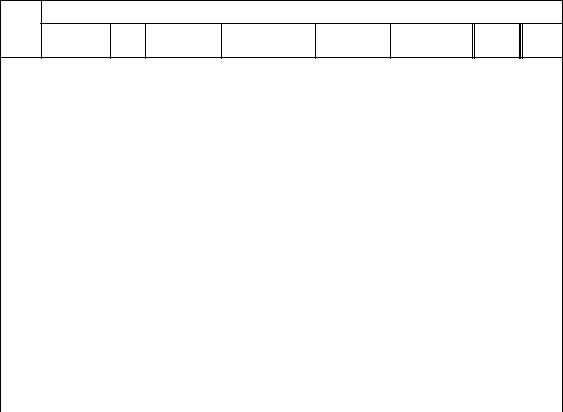
клеточные лимфомы, NK-клеточные лимфопролиферативные заболевания и плазмоклеточные опухоли.
Зрелые (периферические) В-клеточные лимфомы соответствуют злокачественным аналогам нормальных зрелых В-клеток - наивным клеткам и их потомкам. Классификация ВОЗ (2008) зрелых В-клеточных лейкозов и лимфом следует концепции поиска нормального аналога злокачественных клеток на основе определения их соответствия клеткам зародышевого центра или более поздним этапам активации и созревания В-клеток.
Отбор каркасных маркеров для иммунодиагностики периферических В-клеточных лимфом представляет непростую задачу. Это обусловлено тем, что хорошо известны варианты аберрантно низкой экспрессии ряда антигенов CD20 при В- хроническом лимфолейкозе, CD19 при фолликулярной лимфоме, диффузной В- крупноклеточной лимфоме и мантийноклеточной лимфоме. Аберрантность CD22 и CD37 известна при некоторых B-клеточных лимфомах. Наиболее приемлемой парой каркасных антител явились CD19 и CD20 (89-98% случаев), добавление к этой панели CD22 позволяло идентифицировать В-клетки во всех случаях. Таким образом, в качестве каркасных антител отобраны CD19, CD20, а также CD45. CD45 позволяют провести отличие от эритроидных предшественников, негемопоэтических клеток, выявить доминирующую популяцию среди лейкоцитов.
Маркеры дифференциальной диагностики B-клеточных лимфом включают наряду с хорошо известными также новые антигены CD200, CD305 (LAIR), CD185 (CXCR5).
Таблица 6.3. Иммунодиагностика лимфом из периферических В- и Т-лимфоцитов, NK-клеточных лимфопролиферативных заболеваний и плазмоклеточных опухолей
титела и флуорохромы |
|
|
|
|
обы cB |
cO C |
rCPCy5. 5 Cy7 |
C |
CH7 |
ммунологический скрининг зрелоклеточных лимфопролиферативных заболеваний
|
4+ CD20 |
45 |
8 и smigX |
56+ smIgK |
5 |
19+ TCRyδ |
CD3 |
38 |
ммунодиагностика лимфом из периферических В-лимфоцитов |
|
|
||||||
|
20 |
45 |
23 |
10 |
79b |
19 |
200 |
43 |
|
20 |
45 |
31 |
305 (LAIR1) |
11c |
19 |
IgM |
81 |
|
|
|
|
|
|
|
185 |
|
|
20 |
45 |
103 |
95 |
22 |
19 |
|
49d |
|
|
|
|
|
|
|
XCR5) |
|
|
20 |
45 |
62L |
39 |
A-DR |
19 |
27 |
|
ммунодиагностика лимфом из периферических Т-лимфоцитов |
|
|
||||||
|
4 |
45 |
7 |
26 |
CD3 |
2 |
28 |
8 |
|
4 |
45 |
27 |
197 (CCR7) |
CD3 |
45RO |
45RA |
8 |
|
4 |
45 |
5 |
25 |
CD3 |
A-DR |
TCL1 |
8 |
|
4 |
45 |
57 |
30 |
CD3 |
|
11c |
8 |
|
4 |
45 |
-Perforin |
-Gra-nzymeB |
CD3 |
16 |
94 |
8 |
|
4 |
45 |
|
- CD279 |
CD3 |
|
|
8 |
Медицинские книги
@medknigi

ммунодиагностика NK-клеточных лимфопролиферативных заболеваний
|
|
45 |
|
|
CD3 |
56 |
|
19 |
|
2 |
45 |
7 |
26 |
CD3 |
56 |
5 |
19 |
|
16 |
45 |
57 |
25 |
CD3 |
56 |
11c |
19 |
|
A-DR |
45 |
Per-forin |
Gran-zymeB |
CD3 |
56 |
94 |
19 |
ммунодиагностика плазмоклеточных опухолей
|
45 |
138 |
38 |
56 |
m |
19 |
gK |
gλ |
|
45 |
138 |
38 |
28 |
27 |
19 |
117 |
81 |
Предложенный подход позволяет установить типичные иммунофенотипические образцы для большинства случаев восьми главных нозологий периферических B- клеточных лимфом - хронического лимфолейкоза, лимфомы Беркитта, ДБККЛ, фолликулярной лимфомы, волосатоклеточного лейкоза, лимфоплазмоцитарной лимфомы, мантийноклеточной лимфомы и лимфомы из клеток маргинальной зоны. Наибольшие сложности сохраняются при проведении дифференциальной диагностики ДБККЛ от фолликулярной лимфомы, а также от лимфомы маргинальной зоны и лимфоплазмоцитарной лимфомы, однозначно разграничить которые также не представляется возможным.
Иммунодиагностика зрелых Т-клеточных лейкозов и лимфом. Эти довольно редкие (~10%) периферические лимфомы, которые возникают из посттимических зрелых Т-клеток, представляют собой весьма гетерогенную группу болезней. Наиболее частой в классификации ВОЗ (2008) остается лимфома из периферических Т-лимфоцитов, неспецифицированная (~30%), что свидетельствует об отсутствии достаточных знаний для определения нормального клеточного эквивалента для Т-клеточных лимфом. В последние годы ряд нормальных аналогов T-клеточных лимфом был установлен. Например, ангиоиммунобластная Т-клеточная лимфома является отчетливым субтипом T- клеточных лимфом, происходящим из Т-хелперных клеток фолликулярных центров, а CD4+ СD25+
cyFOXP3+ регуляторные Т-клетки - наиболее близкий нормальный аналог Т- клеточного лейкоза/лимфомы взрослых. Анапластическая крупноклеточная лимфома в зависимости от экспрессии гена ALK может быть представлена двумя подтипами с различным прогнозом. Клетки Т-пролимфоцитарного лейкоза в значительной части случаев гиперэкспрессируют киназный коактиватор Tcl1 вследствие хромосомной перестройки гена TCL1.
Лимфомы из периферических Т-клеток относятся к наиболее агрессивным опухолям, исключение составляют только грибовидный микоз, первичная анапластическая лимфома кожи и Т-клеточный лейкоз из больших гранулярных лимфоцитов. Большинство больных имеют четкие симптомы лимфопролиферативного заболевания, часто с вовлечением периферической крови, помимо лимфатических узлов, кожи и других тканей.
Четыре антигена отобраны в качестве каркасных для диагностики T-клеточных лимфом - CD45, SmCD3, CD4, CD8. Создание иммунодиагностикума Т-клеточных
Медицинские книги
@medknigi
опухолей направлено на обнаружение фенотипически аберрантных Т-клеток и точное выделение вариантов лимфом из периферических Т-лимфоцитов в соответствии с классификацией ВОЗ (2008).
При отборе дополнительных маркеров изучили широкую панель антител к: обще- Т-клеточным антигенам, аберрантно экспрессированным при T-CLPD, таким как CD2, CD5, CD7; маркерам Т-клеточной дифференцировки (CD27, CD197 /CCR7/, CD45RA, CD45RO); костимуляторным молекулам (CD26, CD28); маркерам активации (CD25, CD38, CD69, HLA-DR); рецептору ИЛ-2 - CD122; молекулам, связанным с цитотоксичностью эффекторных Т-больших гранулярных лимфоцитов (CD11c, CD16, CD56, CD57), Ig-подобным рецепторам киллерных клеток (CD158a/b/e/j/k, NKB1), рецепторам лектинового типа (CD94, CD161), цитоплазматическим белкам (перфорину, гранзимам, TIA-1). Исследованы также молекулы, связанные со специфическими подтипами T-клеточных лимфом, такие как CD30, cyTcl1, и с маркерами фолликулярных CD4+-Т-клеток (CD10, CD279). Хорошо известно, что моноклональные Т-клетки часто имеют сниженные уровни обще-Т-клеточных маркеров, таких как CD2, CD5, CD7, наряду с SmCD3 и CD4.
Антитела к этим антигенам обязательны для использования в иммунодиагностике Т-клеточных лимфом. Это - диагностические маркеры 1-го уровня. Такое же значение имеют классификационные маркеры, позволяющие разделять T- клеточные лимфомы в соответствии с категориями ВОЗ (2008). CD26 и CD28 полезны для идентификации клеток Сезари:
CD2lo CD4lo smCD3lo CD26 - CD28+. CD30 характерен для системной анапластической крупноклеточной лимфомы (ALK- и ALK+), а также первичного кожного CD30+ T- лимфопролиферативного заболевания. Экспрессия CyTcl рестриктирована главным образом (70-80%) Т-пролимфоцитарным лейкозом. Этот маркер отсутствует на CD30+/- анапластической крупноклеточной лимфоме, Т-лимфобластной лимфоме, нодальной периферической Т-клеточной лимфоме, грибовидном микозе и других периферических Т-клеточных лимфомах. Маркеры 1-го уровня включают также CD11c, CD16, CD57. Вместе с тем молекулы, ассоциированные с цитотоксичностью, отнесены ко 2-му иммунодиагностическому уровню. Сюда включены также дифференцировочные маркеры CD27, CD197 (CCR7), CD45RA, CD45RO,
активационные антигены HLA-DR и CD25.
Это обусловлено тем, что фенотип патологических клеток при многих периферических T-клеточных лимфомах коррелирует с этапами дифференцировки Т-клеток. Так, клетки Сезари имеют фенотип CD4+ Т-лимфоцитов памяти, а клетки Т-пролимфоцитарного лейкоза соответствуют наивным Т-клеткам или Т-клеткам центральной памяти. Фенотип Т-клеточного лейкоза из больших гранулярных лимфоцитов перекрывается с таковым у активированных эффекторных Т-клеток.
Предложенный подход позволил четко отличать патологические клетки лимфом из периферических T-клеток (синдрома Сезари, Т-пролимфоцитарного лейкоза, Т- клеточного лейкоза/лимфомы взрослых, CD4+ Т-клеточного лейкоза из больших гранулярных лимфоцитов, ангиоиммунобластной Т-клеточной лимфомы) от
Медицинские книги
@medknigi
нормальных CD4+ Т-лимфоцитов. Маркерами дифференциальной диагностики синдрома Сезари явились CD2, CD26, CD7; при Т-пролимфоцитарном лейкозе наблюдается экспрессия CyTcl1. Т-клеточный лейкоз/лимфома взрослых характеризуется как позитивный по HLA-DR и CD25; CD4-позитивный Т-клеточный лейкоз из больших гранулярных лимфоцитов имеет маркеры CD28, Cy-гранзим В, CD7. Для ангиоиммунобластной Т-клеточной лимфомы характерен иммунофенотип
CD279, HLA-DR, SmCD3.
Лимфопролиферации из Т-лимфоцитов c яркой экспрессией CD8 (CD8hi) в большинстве случаев возможно отличить по иммунофенотипу от нормальных Т- лимфоцитов (CD8hi), причем наиболее информативными являются маркеры
CD45RO, CD27, цитоплазматический гранзим В, CD28, CD57, CD45RA. При разграничении патологических CD4 - /CD8 -/lo Т-клеток от нормальных аналогов к числу наиболее важных маркеров относятся CD28, цитоплазматический гранзим В, CD45RA, CD45RO, CD16, CD11c и CD27.
Иммунофенотипических различий между CD8hi TCRαβТ-клеточным лейкозом из больших гранулярных лимфоцитов CD8hi-неспецифицированной Т-клеточной лимфомой не установлено. Также не выявлено различий между CD4 - /CD8 - /loTCRγδТ-клеточным лейкозом из больших гранулярных лимфоцитов и CD4 - / CD8 - /lo гепатоспленической Т-клеточной лимфомой.
Иммунодиагностика NK-клеточного хронического лимфопролиферативного заболевания
Заболевания NK-клеток относятся к разряду редких, менее 1% всех лимфом и лимфопролиферативных заболеваний. В соответствии с классификацией ВОЗ (2008) выделяют 3 нозологии: агрессивный NK-клеточный лейкоз, экстранодальная (назальный тип) NK/T-клеточная лимфома и хроническое лимфопролиферативное заболевание из NK-клеток. Первые 2 нозологии имеют четкую связь с вирусом Эпштейна-Барр, характеризуются агрессивным течением и низкой выживаемостью. Напротив, NK-клеточное лимфопролиферативное заболевание является новой условной нозологической единицей, которая включает случаи, ранее считавшиеся NK-клеточным лимфоцитозом, хроническим лейкозом из больших гранулярных лимфоцитов с фенотипом NK-клеток и NK-клеточным лимфоцитозом из больших гранулярных лимфоцитов. Уровни лимфоцитоза, как правило, остаются стабильными на протяжении многих лет, иногда наблюдается спонтанная регрессия, сообщается о возможности трансформации в редких случаях в агрессивный NK-клеточный лейкоз. Как правило, в наиболее частых случаях NK-клеточного лимфопролиферативного заболевания причиной иммунологического обследования является NK-клеточный лимфоцитоз. Если по данным скрининга зрелых лимфоцитов имеет место абсолютный или относительный CD56+ либо CD56 -/lo/CD45hi лимфоцитоз при отсутствии экспрессии SmCD3, CD4, TCRγδи CD19, то следует проводить углубленную иммунодиагностику NK-клеточных лимфопролиферативных заболеваний.
Медицинские книги
@medknigi
В качестве каркасных антител при диагностике NK-клеточных лимфопролиферативных заболеваний использованы CD45, SmCD3, CD56, CD19. Набор потенциальных маркеров NK-клеточных опухолей достаточно широк. Это классические антигены, ассоциированные с NK-клетками, такие как сигнальные молекулы (CD2, CD5, CD7, CD8), низкоаффинный FcγRIII-рецептор CD16, маркеры активации (CD26,CD38, CD45RO, CD69, HLA-DR), рецепторы ИЛ-2 (CD25, CD122),
цитотоксические молекулы (CD11c, CD57), цитоплазматические энзимы (перфорин, гранзимы и TIA-1), а также Ig-подобные рецепторы киллерных клеток - KIR
(CD158a/b/d/e/l и NKB1), лейкоцитарные Ig-подобные рецепторы LIR (CD85j - LIR1/ILT2), лектиноподобные рецепторы С-типа (NKG2A/D, CD94, CD161),
рецепторы естественной цитотоксичности NCR (CD335 /NKp46/, CD336 / NKp44/, CD337 /NKp30/). Критериями необходимости использования антител явились их способность дифференцировать нормальные/реактивные NK-клетки от иммунофенотипически аберрантных NK-клеток, оценка цитотоксического эффекторного фенотипа и стадии созревания количественно увеличенных NKклеток.
Аберрантные или клональные NK-клетки имеют уникально измененные типы экспрессии CD2, CD7, HLA-DR, CD94 в сравнении с нормальными и реактивными NK-клетками, хотя и существует некоторый перекрест. Эти маркеры включены в первый уровень диагностической панели, куда отнесен также CD16. Данный маркер подтверждает природу CD56lo NK-клеток и полезен в идентификации редких CD16 - /lo NK-клеточных опухолей. Для оценки цитотоксического эффекторного фенотипа и стадии созревания анализируемых NK-клеток используются маркеры, экспрессированные на терминально дифференцированных цитотоксических клетках, - CD11c, CD57, перфорин, гранзим В. Они являются маркерами второго уровня, так как не позволяют отличить нормальные NK-клетки от аберрантных. Дополнительными антителами второго уровня являются CD5,
CD25, CD26.
Оцениваемое этим методом количество NK-клеток в крови доноров составило в среднем 2,1% (1,54,5) среди лейкоцитов, что в абсолютных значениях соответствовало 130 (60-290) х103 клеток/мкл. Проведение иммунодиагностики NKклеточных лимфопролиферативных заболеваний по предложенному алгоритму дает возможность идентифицировать иммунофенотипические профили, позволяющие отличить клональные NK-клетки от нормальных или реактивных (поликлональных) клеток. Наибольшее значение имеют маркеры CD56, CD57, HLADR, CD94, а в случаях CD56-/l° - CD7, цитоплазматический гранзим В, цитоплазматический перфорин и CD2.
Иммунодиагностика плазмоклеточных опухолей
Наиболее частыми плазмоклеточными заболеваниями являются множественная миелома (ММ) и моноклональная гаммапатия неустановленного значения, реже встречаются экстрамедуллярные плазмоклеточные опухоли. Многопараметровое иммунофенотипирование методом проточной цитометрии наряду с клиническими,
Медицинские книги
@medknigi
радиологическими, биохимическими и гематологическими данными представляет надежную информацию для диагностики и классификации плазмоклеточных опухолей. Кроме того, данный метод способствует прогностической стратификации и позволяет проводить мониторинг минимальной остаточной болезни (МОБ) у больных с ММ после лечения. Наиболее надежная клиническая информация многопараметрового иммунофенотипирования заключается в возможности идентификации и количественной оценки аберрантных плазматических клеток костного мозга в сравнении с нормальными плазматическими клетками. Чем выше пропорция аберрантных клеток среди плазмоцитов, тем более высок риск злокачественного процесса (например, множественной миеломы при проведении дифференциального диагноза с моноклональной гаммапатией неустановленного значения). Сходным образом присутствие <5% нормальных плазматических клеток в общей популяции плазматических клеток костного мозга также ассоциировано с худшим исходом симптоматической ММ и более высоким риском прогрессирования как моноклональной гаммапатии неустановленного значения, так и тлеющей ММ. Ряд маркеров и иммунофенотипических профилей (например, экспрессия CD28 и CD117) имеет ассоциацию со специфическими генетическими изменениями и исходом болезни.
Предложено большое число маркеров плазматических клеток. Обычно рекомендации включают CD38, CD138 и CD45 (наряду с характеристиками светорассеяния) в качестве каркасных маркеров для идентификации и количественной оценки плазматических клеток.
Дополнительными маркерами в этом случае могут являться CD19, CD56, CD117, CD20, CD28, CD27 и CD81. Необходима оценка клональности цитоплазматических легких полипептидных цепей иммуноглобулинов. В числе привлекательных маркеров - мембранный β2-микроглобулин.
Консорциумом «ЕвроФлоу» разработана панель из 12 моноклональных β2 антител в 8-цветной проточной цитометрии (2 пробы). Отобрано 4 каркасных маркера (CD38, CD138, CD45, CD19) для эффективного обнаружения плазматических клеток (CD38, CD138) и разграничения нормальных/реактивных от клональных плазматических клеток (CD19, CD38, CD45). Остальные 8 маркеров использованы для характеристики плазматических клеток. В предложенном иммунодиагностическом подходе дополнительные антитела равномерно разделены на 2 пробы: 1 - CD56, β2-микроглобулин, CyIgK и CyIgλ; 2 - CD27, CD28, CD81, CD117. Пробы 1 достаточно для специфической идентификации, количественной оценки плазматических клеток и их разделения на нормальные/реактивные и патологические (с аберрантным иммунофенотипом). Проба 2 может использоваться по показаниям для более подробной характеристики плазматических клеток.
ЗАКЛЮЧЕНИЕ
Иммунодиагностика опухолей крови стала в настоящее время одним из наиболее высокотехнологичных разделов медицины - гематологии, онкогематологии,
Медицинские книги
@medknigi
иммунопатологии. В основе данного подхода - глубокие знания биологии клеток крови, особенностей их дифференцировки и изменений, происходящих в ходе злокачественной трансформации. Реализация данного подхода позволяет не только своевременно и точно диагностировать, а следовательно, и правильно лечить опухоли крови, но и осуществлять молекулярный контроль эффективности проводимой терапии с учетом минимальной остаточной болезни. Все это в совокупности позволяет объективно оценивать существующие программы лечения и является основой создания новых современных и высокоэффективных противоопухолевых препаратов.
ЛИТЕРАТУРА
1.Тупицын Н.Н. Структура и функции иммунной системы человека. Глава 3 в кн.: Клиническая онкогематология (под ред. проф. М.А. Волковой). Изд. второе, перераб. и доп. - М.: Медицина, 2007. - С. 66-75.
2.Тупицын Н.Н. Иммунодиагностика острых лейкозов и неходжкинских лимфом. Там же. С. 338-369.
3.Тупицын Н.Н. Лимфоциты и иммунокомпетентная система. В кн.: Руководство по гематологии (под ред. акад. А.И. Воробьева). - М.: Ньюдиамед, 2007. - С. 119-135.
4.Craig F.E., Foon K.A. Flow cytometric immunophe-notyping for hematologic neoplasms // Blood. - 2008. - Vol. 11. - N. 6. - P. 3941-3967.
5.Davis B.H., Holden J.T., Bene M.C. et al. 2006 Bethesda International consensus recommendations on the flow cytometric immunophenotypic analysis in hematolymphoid neoplasia: medical indications // Cytometry B. Clin. Cytometry. - 2007. - Vol. 72B. - P. 5-13.
6.Kalina T., Flores-Montero J., van der Velden V.D. J. et al. Euro Flow standardization of flow cytometer instrument settings and immunophenotyping protocols. - Leukemia. - 2012. - Vol. 26. - P. 1986-2010.
7.Loken M.R. et al., Leukemia Research. - 2008. - Vol. 32. - P. 5-17.
8.Stetler-Stevenson M., Arthur D.C., Jabbour N. et al. Diagnostic utility of flow cytometric immunophenotyping in myelodisplastic syndrome // Blood. - 2001. - Vol. 98. - P. 979-987.
9.Swerdlow S.H., Campo E., Harris N.L. et al. (Eds.): WHO classification of tumours of haematopoietic and lymphoid tissues. - Lyon: IACR, 2008. - 439 p.
10.Valent P., Horny H.P., Bennett J.M. et al. Definitions and standards in the diagnosis and treatment of the myelodisplastic syndromes: consensus statements and report from working conference // Leuk. Res. 2007. - Vol. 31. - P. 727-736.
11.Van Dongen J.J. M., Lhermitte L., Bottcher S. et al. EuroFlow antibody panels for standardized n-dimentional flow cytometric immunophenotyping of normal, reactive and malignant leucocytes // Leukemia. - 2012. - Vol. 26. - P. 1908-1975.
Медицинские книги
@medknigi
12. Van Lochem E.G., van der Velden V.H. J., Wind H.K. et al. Immunophenotypic differentiation patterns of normal haematopoiesis in human bone marrow: reference patterns for age-related changes and disease - induced shifts // Cytometry Part. B. - 2004. - Vol. 60B. - P. 1-13.
Медицинские книги
@medknigi
Глава 7. Лучевая диагностика при заболеваниях системы крови
В.Н. Троян
СОВРЕМЕННЫЕ МЕТОДЫ ЛУЧЕВОЙ ВИЗУАЛИЗАЦИИ В ДИАГНОСТИКЕ ЗАБОЛЕВАНИЙ СИСТЕМЫ КРОВИ
В диагностике заболеваний системы крови наряду с традиционными методами лучевой диагностики, такими как рентгенография, рентгеноскопия, используются современные: цифровая рентгенография, рентгеновская мультиспиральная компьютерная томография (КТ), магнитно-резонансная томография, ультразвуковое исследование, совмещенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ).
Чаще всего указанные методы визуализации используются при гемобластозах - группе нозологий опухолевой природы, среди которых выделяются миелопролиферативные и лимфопролиферативные процессы (острые и хронические лейкозы, ходжкинские и неходжкинские лимфомы, парапротеинемические гемобластозы - множественная миелома, болезнь Вальденстрема и другие заболевания).
Из всех методов лучевых исследований КТ и магнитно-резонансная томография (МРТ) имеют несомненный приоритет в определении степени распространенности заболевания при оценке состояния органов грудной и брюшной полости, малого таза, забрюшинного пространства, позвоночного столба, головного и спинного мозга.
Основной задачей каждого лучевого исследования является определение характера, а также распространенности онкогематологического заболевания по органам и системам в местах, недоступных клиническому обследованию, - средостение, внутригрудные лимфатические узлы, селезенка, забрюшинные и внутрибрюшинные лимфатические узлы, скелет, головной и спинной мозг.
Компьютерно-томографическое исследование
КТ-исследование в диагностике онкогематологических заболеваний выполняется с целью установления факта болезни, проведения дифференциальной диагностики, установления степени злокачественности и стадирования заболевания. Этот метод используется также для морфологической верификации патологического процесса путем выполнения пункционных биопсий под контролем КТ, особенно при локализации процесса в грудной полости.
Как правило, при КТ-исследовании визуализации доступны все элементы лимфатической системы. В обычном состоянии поперечное сечение лимфатических узлов не превышает 2-10 мм. Увеличение поперечного сечения более 10 мм или изменение соотношения длины к ширине более чем 2:1 служит симптомом развития патологического процесса, но нужно обращать внимание, что
Медицинские книги
@medknigi
при исследовании срез не всегда проходит перпендикулярно лимфатическому узлу.
Основные показатели поражения лимфатической системы - это очередность вовлечения в процесс групп лимфатических узлов, частота и форма их поражения, а также экстранодальные проявления заболевания.
КТ-критериями поражения лимфатической системы являются формы поражения лимфатических узлов, их топографо-анатомическая характеристика и денситометрические показатели.
Формы поражения (увеличения) лимфатических узлов:
•изолированная;
•образование «пакета» узлов;
•формирование конгломерата узлов;
•образование лимфоидного инфильтрата.
К изолированной форме поражения относятся одиночные увеличенные лимфатические узлы, не связанные между собой. По данным КТ критериями поражения лимфатических узлов являются:
а) увеличение размера узла более 15 мм; б) визуализация одной группы узлов с размерами от 10 до 12 мм;
в) наличие узлов диаметром 8-10 мм в нескольких анатомических группах.
К форме поражения с образованием «пакета» узлов относится наличие группы изолированных узлов, тесно соединившихся между собой, КТ-критериями поражения которых являются:
а) выраженные или менее выраженные четкие контуры;
б) наличие между ними визуализируемой структуры, отличающейся от них только меньшей плотностью.
Кформе в виде конгломерата узлов относятся случаи, когда по критериям КТ все узлы, прилежащие друг к другу, объединены в единое образование с округлыми, четкими наружными контурами, имеющими однородную плотность. Размеры конгломератов могут быть 50 мм и более, когда в патологический процесс вовлекаются несколько анатомических групп.
Кформе образования лимфоидного инфильтрата относится патологическая инфильтрация лимфоидной ткани, распространяющаяся по ходу лимфатических стволов (грудному или поясничным) и крупным лимфатическим сосудам, определяемая при КТ-исследовании с нечеткими наружными контурами.
Медицинские книги
@medknigi
