
6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdf
Рис. 8.12. Локальную сократимость при вентрикулографии ЛЖ оценивают в правой или левой косой проекции.
Митральная регургитация имеет степени градации 1-4, в зависимости от наличия и объема регургитации (табл. 8.7), а при выраженной регургитации - и степени контрастирования полости ЛП. Очевидно, что размер ЛЖ и (особенно) полости ЛП, острота процесса, положение катетера, объем и скорость вводимого контраста могут изменять данные этого полуколичественного анализа, который остается субъективным, хотя у большинства пациентов ясно видно различие

между регургитацией, не требующей хирургического вмешательства (степени 1 и 2), и регургитацией, приводящей к необходимости хирургической коррекции (степени 3 и 4). Несмотря на то что ангиография - не самая простая методика определения абсолютных объемов, относительные параметры, такие как фракция изгнания ЛЖ, необходимо обязательно вычислять с помощью пакета прикладных программ, заложенных в ангиограф.
Таблица 8.7. Полуколичественная классификация митральной регургитации
Незначительная (класс 1, или 1+/4+): контраст забрасывается в ЛП, не заполняя всю полость предсердия, и вымывается в течение следующего сердечного сокращения
Умеренная (класс 2, или 2+/4+): плотность контрастного заполнения ЛП менее интенсивная, чем плотность контрастного заполнения ЛЖ, однако контраст полностью не вымывается за один сердечный цикл
От умеренной к тяжелой (класс 3, или 3+/4+): плотность контрастного заполнения ЛП той же интенсивности, что и плотность контрастного заполнения ЛЖ
Тяжелая (класс 4, или 4+/4+): плотность контрастного заполнения ЛП больше, чем ЛЖ, и/или полное прокрашивание ЛП во время систолы, и/или заброс контраста в устья легочных вен
АНГИОГРАФИЯ ПРИ ПАТОЛОГИИ КЛАПАННОГО АППАРАТА СЕРДЦА И КАРДИОМИОПАТИЯХ
Выполнение ангиографии для оценки большинства клапанных поражений, а также при кардиомиопатиях потеряло свою актуальность в связи с развитием ЭхоКГ. Но если для коррекции тяжелой клапанной патологии необходимы протезирование или пластика клапана, то всем больным старше 40 лет (или более молодого возраста при наличии нескольких факторов риска или симптомов стенокардии) выполняют коронарографию. Выполнение вентрикулографии из полости ЛЖ показано всем больным с патологией МК или аортальной регургитацией при отсутствии серьезных нарушений гемодинамики или нарушений функций почек, хотя и нет строгой необходимости в дополнительной визуализации или контрастировании камер сердца. Помимо необходимости подтвердить наличие и тяжесть митральной регургитации или косвенные признаки стеноза МК, исследование полезно для выявления и оценки дисфункции ЛЖ. В случае стеноза АК, когда необходимость операции подтверждена клинической симптоматикой и данными неинвазивных методов исследования, проведение инструмента за клапан не рекомендовано. Однако, если данные о скорости потока, полученные с помощью допплеровского УЗИ, вызывают сомнения, то минимальный риск эмболизации и перфорации при проведении инструмента через стенозированный и кальцинированный АК становится клинически оправданным. После измерения градиента давления для выполнения вентрикулографии из ЛЖ рекомендуют использовать катетер типа "поросячий хвостик", проведенный по 0,89-миллиметровому (0,035-дюймовому) проводнику с J-образным кончиком и длиной 260 см. Иногда для лучшей оценки тяжести стеноза МК и степени легочной гипертензии необходимо измерение давления в правых камерах сердца, а также выполнение вентрикулографии из ПЖ, что помогает выявить и определить степень дилатации ПЖ и регургитацию на ТК. На венозном возврате после получения изображения артериального и венозного русла легочного дерева, а также вычисления времени кровообращения по малому кругу можно оценить дилатацию ЛП и патологическую подвижность структур МК. У больных с патологией АК можно оценить наличие и тяжесть кальциноза структур клапана и восходящей части аорты, количество створок и нарушение открытия клапана, а также форму струи изгнания по данным вентрикулографии из ПЖ и ЛЖ и по данным аортографии. Полуколичественная классификация степени расширения аорты, тяжести аортальной недостаточности (табл. 8.8), а также описание неровного и кальцинированного контура стенки аорты лежат в основе обследования больных с поражением клапанов аорты, артериальной гипертензией или синдромом Марфана. Применение катетеров типа "поросячий хвостик" с рентгеноконтрастными маркерами, находящимися друг от друга на расстоянии 1 см, предпочтительно в случае обследования больных, отобранных для протезирования корня аорты или транскатетерной имплантации АК.
Таблица 8.8. Полуколичественная классификация аортальной регургитации
Незначительная (класс 1, или 1+/4+): небольшое количество контраста ретроградно забрасывается в желудочек, вымывается в течение каждого сердечного сокращения

Умеренная (класс 2, или 2+/4+): плотность контрастирования ЛЖ меньше, чем восходящего отдела аорты, контраст полностью не вымывается в течение одного сердечного сокращения
От умеренной к тяжелой (класс 3, или 3+/4+): ЛЖ контрастируется с такой же плотностью, как аорта
Тяжелая (класс 4, или 4+/4+): плотность контрастирования ЛЖ более интенсивная, чем восходящего отдела аорты, и/или полное заполнение полости ЛЖ в течение одного сердечного сокращения
ВНУТРИКОРОНАРНОЕ УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
20 лет назад, когда было разработано ВСУЗИ, пионеры этой техники верили, что она сможет заменить ангиографию таким же образом, как эндоскопическая техника заменила традиционное радиологическое обследование в гастроэнтерологии. Существует ряд причин, почему этого не произошло.
1.В отличие от эндоскопии, техника все еще не превзошла ангиографию, поскольку требует флюороскопии и введения контраста для проведения датчика.
2.ВСУЗИ всех основных венечных сосудов и их ветвей, включая дистальные сегменты, - громоздкое исследование, требующее экспертной оценки полученного изображения.
3.ВСУЗИ позволяет выявить ангиографически скрытые атеросклеротические изменения, но не существует новых методов локальной стабилизации бляшки, чтобы оправдать рутинное использование этого дополнительного диагностического метода.
4.Несмотря на тот факт, что совершенствование методики ЧТА и новые фундаментальные представления о необходимости имплантации стента высоким давлением получены с помощью ВСУЗИ, не существует больших рандомизированных исследований, убедительно показавших клиническую пользу применения ВСУЗИ перед ангиографией.
ПОЛУЧЕНИЕ ИЗОБРАЖЕНИЯ
Миниатюрные гибкие внутрикоронарные ультразвуковые датчики генерируют изображения с высоким разрешением поперечного среза артерии с помощью вращающегося на 360° пьезоэлектрического кристалла или последовательной активации множества (64) кристаллов датчика (рис. 8.13). Катетер компании Бостон-Сайнтифик (Boston-Scientific), Натик (Natick), Массачусетс, США (MS, USA), "Атлантис Про" (Atlantis Pro) имеет основную частоту 40 МГц, датчик на монорельсовой системе доставки с очень низким поперечным профилем 0,22 дюйма. Больший диаметр проксимальной части, требуемой для промывания катетера, и механизм вращения кабеля делают его профиль совместимым с проводниковым катетером размера 6 French. Компания Волкано (Volcano Therapeutics) Ранчо Кордова (Rancho Cordova), Калифорния (CA), США (USA)
была пионером в технологии ВСУЗИ, а катетер "Игл-Ай Голд" (EagleEye Gold) с равномерным профилем 2,9 мм остается единственной системой, совместимой с проводниковым катетером размера 5 French. Он доступен для проведения как по длинному проводниковому катетеру, так и по катетеру с обычной длиной и с датчиком, очень близко смещенным к дистальному концу. Эта система предпочтительна для проведения ВСУЗИ дистального выхода из хронической тотальной окклюзии, где катетер может быть проведен в ложный канал (рис. 8.14). Для того чтобы улучшить разрешающую способность, эта же компания разработала датчик "Революшен" (Revolution) с частотой 45 МГц, диаметром 3,2 French, с механическими характеристиками, сходными с катетером "Атлантис" (Atlantis). Большие датчики с более низкими частотами для улучшения проникающей способности (10-15 МГц) используют при внутрисердечном или внутрисосудистом исследовании периферических артерий, но их применение требует специфической техники. Чтобы добавить третье измерение (длину) к томографическому изображению сосудистой стенки, катетер (в системе с многоэлементной матрицей) или внутренний проводящий кабель ультразвукового кристалла (в механических датчиках) соединяется с системой, регулирующей скорость между 0,5 и 2 мм/с. Некоторые исследователи предпочитают большую разрешающую способность и динамический диапазон, который механическая система с одним большим кристаллом (основная частота 40 или 45 МГц) может предложить, и положительно рассматривают необычную методику получения изображения через неподвижный дистальный футляр, который остается в фиксированным в одном месте во время ВСУЗИ с безопасным движением назад за счет отсутствия контакта с сосудистой стенкой (табл. 8.9). Безопасность метода была изучена в первые годы после внедрения [10], когда были доступны лишь жесткие и крупные датчики. Эти

исследования выявили основные осложнения методики: спазм, расслоение артерий и тромбоз. Такие осложнения встречались исключительно до и после ангиопластики. Более интересен факт того, что в венечных артериях пациентов, отобранных для трансплантации сердца, не выявлено достоверных различий в количестве артериопатий после ВСУЗИ при сравнении с группой контроля, где ВСУЗИ не проводили [11].
Рис. 8.13. А1-А2 - увеличенный снимок кончика и схематическое изображение механического однокомпонентного эндоваскулярного ультразвукового внутрисосудистого катетера. Необходимо отметить, что сканирующий датчик перемещается в неподвижной прозрачной трубке. Б1-Б2 - увеличенный снимок кончика и схематическое изображение многокомпонентного ультразвукового внутрисосудистого катетера.
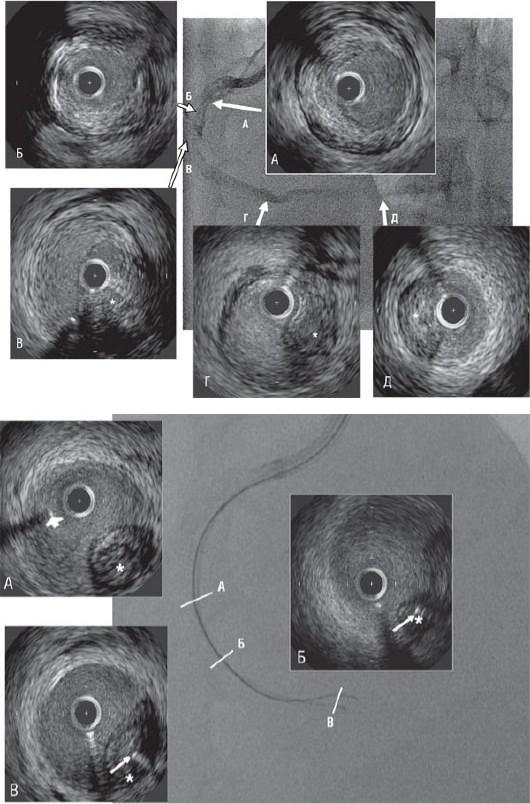
Рис. 8.14. Ряд 1. А - полная окклюзия средней трети ПВА. Б - покрытый полимером коронарный проводник проведен через зону окклюзии при поддержке баллонного катетера OTW. Контралатеральное контрастирование свидетельствует о том, что дистальная часть коронарного проводника располагается вне просвета сосуда. В - контрастирование после удаления проводника через просвет баллона подтверждает субинтимальное расположение со слепым ходом в конце протяженного расслоения. Дальнейшие манипуляции при помощи дополнительного проводника под обычным ангиографическим контролем не позволили пройти в дистально расположенный истинный просвет сосуда. Ряд 2. Серия из пяти ультразвуковых поперечных срезов от проксимального сегмента к дистальному (А-Д),

указаны стрелками на ангиограмме. А и Б расположены в проксимальном сегменте, проксимальнее зоны окклюзии и расслоения. В-Д располагаются на различных уровнях вне зоны расслоения. Звездочкой отмечен поджатый ложный просвет. Ряд 3. Три ультразвуковых среза от проксимального к дистальному А-В ясно показывают положение проводника по отношению к суженному истинному просвету сосуда (*). На снимке А проводник, отмеченный стрелкой, располагается точно в зоне расслоения. На снимках Б и В проводник, указанный тонкой стрелкой, проведен в истинный просвет сосуда под
контролем ультразвукового катетера: первоначально в конце истинного просвета для определения точного направления, необходимого для прохождения через проксимальную зону окклюзии; затем катетер перемещен дистальнее для подтверждения стабильного внутрисосудистого положения проводника. После баллонной предварительной дилатации по проводнику в просвете сосуда и имплантации нескольких стентов достигнут превосходный результат.
Таблица 8.9. Протокол получения внутрисосудистого ультразвукового изображения
До воспроизведения изображения
Соединение ультразвукового катетера с консолью изображения
Введение демографических и сосудистых обследований
Для механического датчика тщательно промыть маленьким шприцем
Соединить катетер/рукоятку для моторизации системы выведения до 0,5 мм/с
Активировать и проверить изображение, получаемое до ввода
Ввести 0,1-0,3 мг нитроглицерина или 1-3 мг изосорбида динитрата в соответствии с АД и риском спазма
Во время воспроизведения изображения
Для электронных катетеров до интракоронарного введения отодвинуть катетерный проводник, получить изображение непосредственно снаружи устья венечной артерии и вычесть окружность, расположенную внизу артефакта
Продвинуть катетер дистально к интересующему сегменту
Оптимизировать ультразвуковые параметры (глубина и усиление) и начать цифровое получение/механическое выведение
Проверить данные ЭКГ и давление в ходе отведения, чтобы исключить длительную ишемию, особенно в ходе предилатационного воспроизведения изображения
Завершить выведение до тех пор, пока катетер не достигнет коронарного устья или не втянется внутрь катетерного проводника
Избегать остановки механического выведения и предпочтительнее повторить воспроизведение поперечного сечения зоны интереса из цифрового архива после завершения получения изображения
Повторно ввести катетер для получения изображений в зону интереса только при наличии сомнений при интерпретации изображения (например, если возникла необходимость промывания изотоническим раствором натрия хлорида в нужном сегменте, чтобы подтвердить наличие изъязвленной бляшки, расслоения, определить границу просвет/интима при замедленном токе крови и других сходных обстоятельствах, или необходимо введение контраста, чтобы выявить

расположение данного поперечного среза вдоль сосуда)
После воспроизведения изображения
Промыть ультразвуковой катетер (особенно для механического датчика) и почистить его
Переставить катетер, чтобы он был готов для новой манипуляции
Выполнить измерения (диаметра и площади) наиболее важных поперечных сечений (обычно - опорный сегмент, проксимальный и/или дистальный, или оба, минимальную площадь поперечного сечения внутри поражения или минимальную площадь поперечного сечения стента других интересующих сегментов, см. рис. 8.16)
Обеспечить продольную демонстрацию изображения после продольной реконструкции (вытянутое изображение) и измерить длину интересующего сегмента (например, длину сегмента для стентирования)
Сохранить изображения в цифровом формате DICOM на том же сервере и под теми же идентификационными именами DICOM ангиографических изображений
Подготовить отчет, включая измерения и качественную интерпретацию изображения
ИНТЕРПРЕТАЦИЯ ИЗОБРАЖЕНИЯ
ИЗМЕРЕНИЯ
Аксиальная разрешающая способность ВСУЗИ, которая в естественных условиях даже при частоте 40-45 МГц не превышает 70 мк, не позволяет оценить состояние неизмененной интимы. Однако у большинства больных с патологией венечных артерий интима почти на всем протяжении утолщена из-за возрастных или ранних атеросклеротических изменений, что делает возможным ее отграничение от прилежащей адвентициальной оболочки. Акустическая граница между интимой, окруженной мышечной средней оболочкой со скудным эхо-сигналом, и чрезвычайно яркими коллагеновыми и эластиновыми волокнами адвентициальной оболочки приводит к появлению так называемой "трехслойности", или "некоего подобия мишени".
В табл. 8.10 представлены основные измерения, возможные при применении ультразвука. Как Европейское общество кардиологов [12], так и Американский колледж кардиологии [13] распространяют руководства часто используемой терминологии и методов качественного количественного анализа ВСУЗИ-изображений. Наиболее очевидное измерение, доступное с использованием техники, обеспечивающей круговое изображение сосуда, - область с наружным контуром, начерченным по передней кромке окружающих структур (рис. 8.15). Область просвета и область внутри наружной эластической мембраны, также называемая тотальной сосудистой областью, - два наиболее важных размера, и различие между ними обеспечивает область комплекса интима-медиа. После установки стента его область также можно измерить, и этот размер служит эквивалентом области просвета сразу же после раскрытия сосуда, за исключением случаев внедрения стента в стенку сосуда или пролапса бляшки, суживающей просвет. До наступления эпохи стентов с лекарственным покрытием, спустя недели и месяцы после имплантации на балках стентов формировалась неоинтима различной толщины, что при последующем динамическом наблюдении давало возможность достаточно просто рассчитывать площадь формирования неоинтимы по разнице между площадью просвета сосуда и площадью стента. Антипролиферативный эффект стентов с лекарственным покрытием часто уменьшает внутренний слой сосуда до степени, лежащей вне разрешающей способности УЗИ.

Рис. 8.15. Четыре поперечных ультразвуковых среза, полученных в позициях, указанных на ангиографическом снимке ПВА в левой косой проекции. Больной с диффузным рестенозом через 3 мес после имплантации нескольких стентов от устья до средней трети ПВА. А - отчетливое неполное раскрытие стента с диффузной гиперплазией внутри стента заметно по наличию ярких точек и полосок (указано стрелками). Б - на данном срезе видны отсутствие стента на уровне коронарного устья, а также рестеноз, вероятно, возникший за счет возвратного эластического сужения большой концентрической бляшки, не покрытой во время первоначальной процедуры. В - просвет сосуда (внутренняя точечная линия), стент (пунктирные линии по окружности и по максимальному диаметру) и площадь сосуда по наружной эластической мембране (наружная точечная линия по окружности и по максимальному диаметру). При использовании 1-миллиметрового масштаба калибровочной сетки очевидно, что диаметр стента - 2,3 мм в сравнении с диаметром наружной эластической мембраны, составляющим 4,5 мм. Г - ангиография не позволяет достоверно оценить степень эксцентричности дистального стеноза: минимальная толщина бляшки - 0,2 мм, максимальная - 1,9 мм.
Таблица 8.10. Практические рекомендации для выполнения измерений при интракоронарном ультразвуковом исследовании
Измерение |
Единицы |
Описание |
Комментарии |
|
измерения |
|
|
|
|
|
|
Площадь просвета |
мм2 |
Площадь, ограниченная |
Если граница между |
сосуда |
|
внутренней границей |
внутренней оболочкой и |
|
|
внутренней оболочки |
просветом сосуда нечеткая из- |
|
|
|
за неровностей контура (при |
|
|
|
изъязвлении бляшки, |
|
|
|
расслоении стенки) или |
|
|
|
вследствие замедления |
|
|
|
кровотока, то введение |
|
|
|
изотонического раствора |
|
|
|
натрия хлорида позволяет |
|
|
|
четче определить контур. Не |
|
|
|
следует выполнять измерение |
|
|
|
в момент введения |
|
|
|
изотонического раствора |
|
|
|
натрия хлорида (просвет |
|
|
|
|

|
|
|
артерии увеличивается из-за |
|
|
|
возрастания внутрисосудистого |
|
|
|
давления и изменения скорости |
|
|
|
ультразвука в растворе по |
|
|
|
сравнению с кровью) |
|
|
|
|
Границы наружной |
мм2 |
Площадь, ограниченная |
Не прослеживается, если при |
эластической |
|
внутренней границей |
превышении угла сканирования |
мембраны |
|
адвентициальной оболочки |
более чем на 90° окружность |
(абсолютная площадь |
|
|
сосуда не визуализируется из- |
сосуда) |
|
|
за затенения или истончения |
|
|
|
|
Площадь стента |
мм2 |
Площадь, ограниченная |
Площадь стентированного |
|
|
каркасом стента |
участка должна |
|
|
|
соответствовать просвету |
|
|
|
сосуда, если каркас стента не |
|
|
|
внедрился в стенку сосуда (в |
|
|
|
случае недораскрытия или |
|
|
|
наличия сосудистой |
|
|
|
аневризмы) или бляшка |
|
|
|
пролабирует в стент |
|
|
|
|
Площадь средней |
мм2 |
Разница между площадью, |
Не определяется при |
оболочки и |
|
ограниченной наружной |
кальцинозе или внедрении |
атеросклеротической |
|
эластической мембраной, и |
стента в стенку сосуда |
бляшки |
|
площадью просвета сосуда |
|
|
|
на соответствующих |
|
|
|
поперечных срезах |
|
|
|
|
|
Площадь |
мм2 |
Разница между площадью, |
Может быть рассчитана с |
неоинтимальной |
|
ограниченной стентом, и |
ошибкой из-за низкой |
пролиферации в |
|
площадью внутреннего |
эхогенности интимы, что |
стенте |
|
просвета сосуда на |
затрудняет ее отличие от |
|
|
изображениях, |
среды сосудистого просвета, |
|
|
выполненных после |
особенно в случае критического |
|
|
имплантации стента |
рестеноза или наличия стента |
|
|
|
(с лекарственным покрытием) с |
|
|
|
микроскопическим утолщением |
|
|
|
неоинтимы, не |
|
|
|
визуализируемым при ВСУЗИ |
|
|
|
|
Площадь бляшки |
% |
Процентное отношение |
- |
|
|
площади наружной |
|
|
|
эластической мембраны, |
|
|
|
заполненной бляшкой, |
|
|
|
рассчитывают по формуле: |
|
|
|
(площадь наружной |
|
|
|
эластической мембраны - |
|
|
|
площадь внутреннего |
|
|
|
просвета сосуда) / площадь |
|
|
|
наружной эластической |
|
|
|
мембраны × 100 |
|
|
|
|
|
Площадь |
% |
Рассчитывают по формуле: |
- |
неоинтимального слоя |
|
(площадь внутреннего |
|
|
|
просвета стента - площадь |
|
|
|
просвета сосуда) / площадь |
|
|
|
внутреннего просвета |
|
|
|
стента × 100 |
|
|
|
|
|
Индекс |
- |
Индекс эксцентричности |
1 - концентрическая бляшка, |
эксцентричности |
|
бляшки - отношение между |
‹1 - эксцентричная бляшка. |
бляшки |
|
минимальными и |
Помните, что американские |
|
|
максимальными размерами |
авторы обычно используют |
|
|
бляшки с учетом толщины |
обратный (!) индекс, с |
|
|
средней оболочки сосуда |
возрастающими показателями, |
|
|
|
указывающими на постепенное |
|
|
|
увеличение эксцентричности |
|
|
|
|
Объем внутреннего |
мм3 |
Внутренний объем |
Сразу после имплантации |
просвета в стенте |
|
стентированного сегмента |
площадь сосуда должна |
|
|
рассчитывают по формуле |
соответствовать площади |
|
|
Симпсона с измерением |
стента |
|
|
площади множества |
|
|
|
равномерно |
|
|
|
расположенных срезов или |
|
|
|
при автоматическом |
|
|
|
компьютерном измерении |
|
|
|
контура множества |
|
|
|
поперечных или |
|
|
|
продольных срезов |
|
|
|
|
|
Объем просвета |
мм3 |
Объем внутреннего |
Рассчитывают по хорошо |
стента |
|
просвета стента |
видимым границам стента |
|
|
|
|
Объем |
мм3 |
Разница между внутренним |
Крайне сложно рассчитать у |
неоинтимальной |
|
объемом стента и объемом |
стентов с лекарственным |
пролиферации в |
|
внутреннего просвета |
покрытием из-за чрезвычайно |
стенте |
|
сосуда в области стеноза |
тонкого слоя неоинтимальной |
|
|
|
гиперплазии |
|
|
|
|
Уменьшение просвета |
% |
Рассчитывают по формуле: |
Идеальный биологический |
стента при |
|
(площадь внутреннего |
индикатор эндотелизации |
эндотелизации |
|
стента |
|
|
просвета стента - площадь |
||
|
|
|
|
|
|
просвета сосуда) / |
|
|
|
площадь просвета стента × |
|
|
|
100 |
|
|
|
|
|
Линейные измерения также возможны при УЗИ. Они нужны, когда ВСУЗИ используют, чтобы определить размер устройства для дилатации сосуда, например баллона или стента. К сожалению, сосудистый просвет, особенно область внутри наружной эластической мембраны, редко имеет круглую форму, так как по большей части бляшки растут эксцентрично или из-за того, что датчик не идеально выровнен по длинной оси сосуда, генерируя косой срез. Обычно нужны два линейных измерения для каждого поперечного изображения: минимальный и максимальный диаметр. Минимальную и максимальную толщину бляшки также используют для вычисления индекса эксцентричности бляшки (см. рис. 8.15). В клинической практике пространственные и линейные измерения редко берут в более чем в двух-трех локализациях, соответствующих области минимального просвета до ангиопластики или после баллонной дилатации и минимальной области стента после стентирования, а также в одном-двух референтных участках проксимальнее и/или дистальнее стенозированного сегмента или стента (рис. 8.16). Последний участок более субъективен, хотя поперечный срез наибольшей области и/или наименьшей бляшки в пределах 5-10 мм от края стенозированного участка или края стента часто используют. Поскольку сосуд имеет конусовидную форму, среднее значение между размерами в проксимальной и дистальной частях сосуда может точнее отобразить степень тяжести поражения и тип ремоделирования в пределах области стеноза. Сравнение между областью сосуда в стенозированной и референтной частях позволяет подсчитать индекс ремоделирования. Позитивное ремоделирование, описанное Глаговым (Glagov) в морфологических исследованиях, было подтверждено in vivo и показало наличие его в большинстве участков с ранними
