
6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdf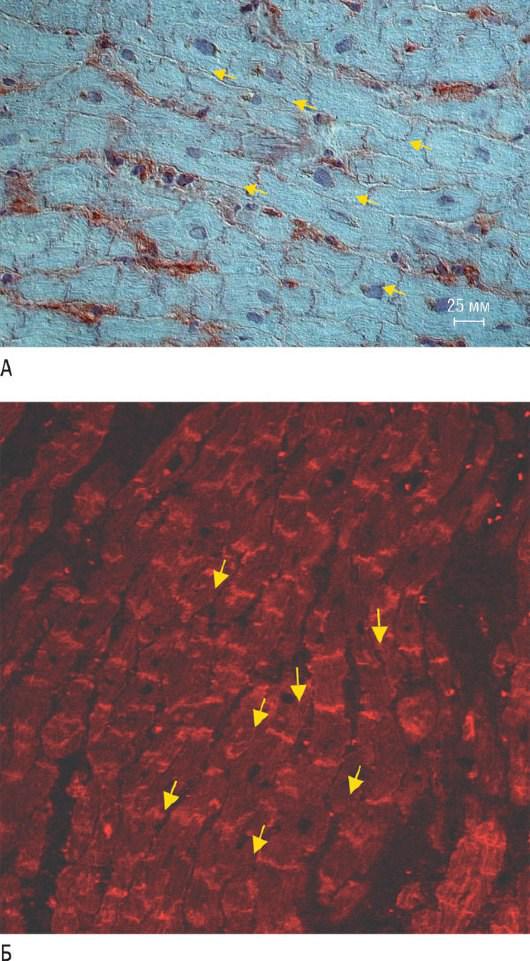
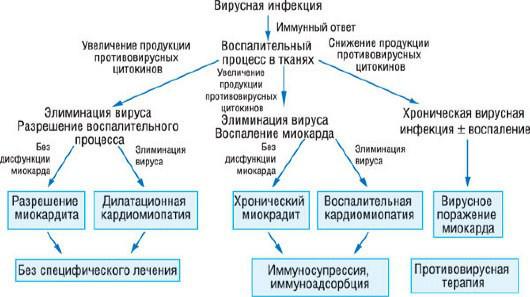
Рис. 18.28. Рецепторы Коксаки-аденовируса (CAR), экспрессирующиеся при дилатационной кардиомиопатии. А - экспрессия CAR на сарколемме кардиомиоцитов и вставочных дисках по эмбриональной модели при дилатационной кардиомиопатии (показано стрелками; ×400). Б - конфокальная лазерная сканирующая микроскопия (иммунофлуоресценция с помощью Cy3) позволяет обнаружить индукцию CAR в сарколемме кардиомиоцитов и вставочных дисках (показано стрелками; ×400) при дилатационной кардиомиопатии. Источник (с
разрешения): Noutsias M., Fechner H., Jonge H. et al. Human Coxsackie-adenovirus receptor is colocalized with integrins alpha(v)beta(3) and alpha(v)beta(5) on the cardiomyocyte sarcolemma and upregulated in dilated cardiomyopathy: implications for cardiotropic viral infections // Circulation. - 2001. - Vol. 104. - P. 275-280.
Примером последнего служит протеаза вируса Кок-саки 2А, которая разрезает дистрофин и приводит к повреждению цитоскелета [243]. Даже нереплицирующийся геном вируса Коксаки при низкой экспрессии может оказывать цитопатический эффект.
Презентация вирусных антигенов вызывает активацию противовирусного иммунного ответа в организме человека, цель которого состоит в элиминации вируса, не всегда оказывающего пагубное влияние на сердце. Иммунный ответ организма может опосредованно вызвать повреждение миокарда, что связано с молекулярной мимикрией и, возможно, генетической предрасположенностью. Именно поэтому, несмотря на элиминацию вируса, аутоиммунные реакции, запускаемые в ходе формирования противовирусного иммунитета, могут продолжаться. Персистирующая вирусная инфекция вызывает иммунный ответ, действие которого направлено уже на сердечную мышцу. Активированные В-лимфоциты продуцируют антитела, которые вступают в перекрестную реакцию с антигенами миокарда и способствуют ухудшению его сократительной способности. У больных ДКМП часто обнаруживают антитела к транспортеру АДФ/АТФ, β1-адренорецепторам, а также митохондриальным и сократительным белкам. Несмотря на то что образование аутоантител в течение долгого времени считали сопутствующим признаком иммунного ответа, недавние исследования доказали способность антител к вторичной внеклеточной петле β1-адренорецептора вызывать развитие ДКМП у иммунизированных крыс [244]. Более того, результаты исследований по использованию иммуноадсорбции отчетливо демонстрируют причинно-следственную связь между развитием ДКМП и выработкой аутоантител
[245].
В процессе иммунного ответа секретируются цитокины, обладающие прямым кардиодепрессивным эффектом, что влияет на сократительную способность миокарда. Цитокины способствуют нарушению баланса между металлопротеиназами (MMP) и их тканевыми ингибиторами (TIMP), что приводит к ремоделированию миокарда [246]. Предварительные результаты клинических исследований показали существование связи между экспрессией металлопротеиназ, их тканевых ингибиторов и функцией ЛЖ. Более того, цитокины индуцируют экспрессию адгезионных молекул сосудистым эндотелием, что служит промежуточным этапом трансэндотелиальной миграции иммунокомпетентных клеток в миокард [39]. В свою очередь, цитотоксические Т-лимфоциты участвуют в повреждении кардиомиоцитов [247]. Патогенетическая модель миокардита и ВКМП представлена на рис. 18.29.
Рис. 18.29. Патофизиология воспалительной кардиомиопатии и методы специфического лечения.
КЛИНИЧЕСКАЯ КАРТИНА
Клинические симптомы миокардита и ВКМП включают дискомфорт в грудной клетке, признаки СН, обмороки, сердцебиения и ВСС. Пациенты с острым миокардитом могут описывать недавнее (в последние дни или недели) простудоподобное заболевание с симптомами респираторной или желудочно-кишечной инфекции, которая предшествует возникновению нарушений со стороны сердца. Несмотря на это, острый миокардит без выраженных симптомов достаточно часто не диагностируют. Различают два типа острого миокардита.
При остром фульминантном миокардите больные жалуются на острое начало и быструю прогрессию (от нескольких часов до нескольких дней) таких симптомов СН, как одышка при минимальной физической нагрузке или в покое и периферические отеки. По мере дилатации ЛЖ его функция нарушается вплоть до развития отека легких. Пациентам может потребоваться инотропная или механическая поддержка ЛЖ (искусственный ЛЖ). В дальнейшем в случае развития острого фульминантного миокардита функция ЛЖ может значительно улучшиться и, как показывает наблюдение за такими пациентами, даже нормализоваться [122]. Это послужило основой гипотезы о том, что функция ЛЖ улучшается после элиминации вируса и разрешения миокардита. Вирусный фульминантный миокардит регистрируют реже, чем нефульминантную форму заболевания.
Острый нефульминантный миокардит обычно характеризуется острым началом, симптомами стенокардии, элевацией или депрессией сегмента ST, а также инверсией зубца Т на ЭКГ. Эти изменения сопровождаются повышением активности КФК-МВ и тропонина, что при отсутствии стенозов венечных артерий имитирует ИМ. Активность креатининфосфокиназы и тропонина обычно нормализуется в течение 60 ч. Концентрация С-реактивного белка часто повышена. При остром нефульминантном миокардите общая систолическая функция сохранена, несмотря на то что часто развиваются регионарное нарушение сократимости и диастолическая дисфункция. Более того, при ЭхоКГ можно обнаружить выпот в перикарде и отек стенок [241].
При остром миокардите и ВКМП на ЭКГ регистрируют БНПГ(правой или левой), депрессию сегмента ST, образование патологического зубца Q и отрицательного зубца Т, а также АВ-блокады различной степени. При ХМ обнаруживают разнообразные нарушения ритма: синусовую тахикардию (брадикардию), наджелудочковую и желудочковую ЭС, ФП и ТП. Миокардит служит частой причиной возникновения ВСС (до 40% всех случаев), особенно у молодых пациентов. Его развитие нередко ассоциировано с серьезными физическими нагрузками.
Коронарная ангиография позволяет исключить стенозы венечных артерий при миокардите и ВКМП. Введением вазоконстрикторов можно спровоцировать спазм венечных артерий, что имеет диагностическое значение, особенно в случае острого нефульминантного миокардита [241, 248].
ЛЕЧЕНИЕ
При подозрении на острый миокардит и ВКМП необходимо исключить вторичные причины возникновения СН (т.е. ИБС, артериальную гипертензию, гемодинамически значимые аномалии строения клапанов). Используют все методы диагностики и лечения, применяемые при СН: иАПФ, БРА, β-адреноблокаторы, диуретики, антагонисты альдостерона и сердечные гликозиды. При неэффективности медикаментозного лечения выполняют трансплантацию сердца. При необходимости можно назначать РСТ и механическую поддержку ЛЖ, которая может значительно улучшить состояние пациента. Стратификация риска и первичная профилактика ВСС - клинически сложная задача. Это связано с тем, что программируемая желудочковая стимуляция у больных миокардитом не влияет на прогноз заболевания. На основании недавно опубликованных результатов клинических исследований, касающихся ВСС, были выделены критерии стратификации риска для больных с ишемической КМП и КМП неишемической этиологии, страдающих ХСН II функционального класса по NYHA и выше, и ФВ ЛЖ менее 35%. Данные относительно стратификации риска острого миокардита в настоящее время отсутствуют. Наблюдение за пациентами требуется, по меньшей мере, в течение всей фазы повышения активности КФК-МВ и тропонина. Скрининговое обследование родственников больных при наличии указаний в семейном анамнезе помогает в диагностике заболевания на ранней стадии.
Больные с миокардитом или ДКМП, получающие лечение по поводу СН, должны периодически проходить обследование, включающее физикальный осмотр, 12-канальную ЭКГ, суточное ЭКГмониторирование, а также ЭхоКГ. У больных с острым миокардитом нередко отмечают спонтанное восстановление функции ЛЖ. Тем не менее, если, несмотря на проводимое медика-ментозное
лечение, СН постепенно ухудшается, то необходимо рассмотреть возможность назначения иммуномодулирующей терапии (см. "Стратегия назначения иммуномоделирующей терапии"). Таким пациентам следует выполнить эндомиокардиальную биопсию, а ее результаты проанализировать с использованием всех доступных современных диагностических методов (иммуногистологическая оценка воспалительного процесса, молекулярно-биологическое определение кардиотропных вирусов). Кроме того, требуются определение титра и оценка функциональной активности антител к миокарду.
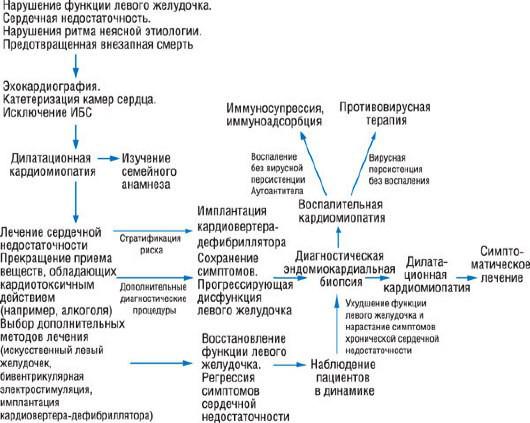
Алгоритм лечения пациентов с миокардитом и ВКМП представлен на рис. 18.30.
Рис. 18.30. Алгоритм диагностики воспалительной кардиомиопатии и лечения дилатационной кардиомиопатии.
ДИАГНОСТИЧЕСКАЯ ЭНДОМИОКАРДИАЛЬНАЯ БИОПСИЯ
Материал для биопсии забирают из ПЖ, ЛЖ или межпредсердной перегородки. Осложнения при проведении диагностической эндомиокардиальной биопсии в центрах, имеющих опыт проведения этой манипуляции, возникают достаточно редко, но она может привести к летальному исходу вследствие перфорации миокарда. Согласно данным исследований, его регистрируют менее чем в 0,4% случаев [249]. Диагностическая ценность результатов, полученных при проведении эндомиокардиальной биопсии, превышает ущерб и потенциальный риск, что делает выполнение этой процедуры обоснованным.
ГИСТОЛОГИЧЕСКАЯ ОЦЕНКА ВОСПАЛЕНИЯ
Критерии Далласа позволяют дифференцировать активный миокардит (интерстициальная воспалительная инфильтрация с некрозом кардиомиоцитов) от пограничного миокардита, при котором отсутствует некроз кардиомиоцитов и имеется инфильтрация с фиброзом или без него (рис. 18.31) [250]. При отсутствии клинических симптомов только по данным гистологического исследования миокардит обнаруживают достаточно редко (обе формы составляют 5-19% случаев). Традиционное гистологическое исследование может быть причиной ошибки и широкой вариабельности результатов. Кроме того, при гистологическом исследовании можно обнаружить признаки других КМП, не патогномоничных для миокардита или ВКМП. Несмотря на возможные ошибки, гистологическое исследование биоптатов остается стандартом диагностики острого миокардита, а также дифференциальной диагностики с другими заболеваниями, например с болезнями накопления.
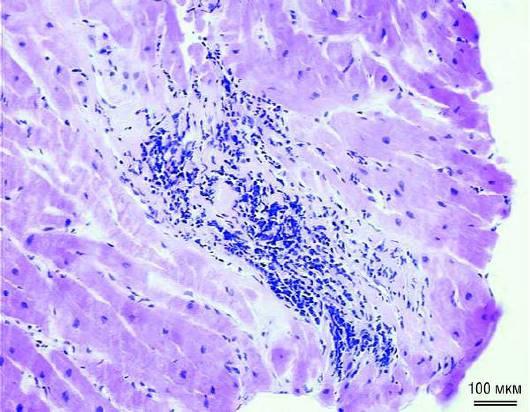
Рис. 18.31. Гистологическая картина острого миокардита: фокальная лимфомононуклеарная инфильтрация с миоцитолизом (×200).
ИММУНОГИСТОЛОГИЧЕСКАЯ ОЦЕНКА ВОСПАЛЕНИЯ
Общепризнано, что иммуногистологические методы исследования обладают высокой чувствительностью и специфичностью, которая обеспечивает оптимальную количественную и качественную характеристику воспаления. Они имеют многочисленные преимущества по сравнению с гистологическими критериями Далласа и позволяют определить ключевые моменты иммунного ответа при миокардите и ВКМП.
Для миокардита патогномонична выраженная Т-лим-фо-цитарная инфильтрация (более 7 клеток в 1 мм2) (рис. 18.32). Кроме того, использование функциональных маркеров цитотоксических Т- лимфоцитов (см. рис. 18.32), активированных Т-лимфоцитов (в том числе CD45R0+ или CD69+) и макрофагов позволяет получить дополнительную информацию о характеристиках воспалительного процесса. Важным диагностическим признаком считают высокое содержание адгезионных молекул, участвующих в воспалительной инфильтрации благодаря специфическому взаимодействию рецептора с лигандом (см. рис. 18.32). Слайды с иммуногистологической окраской можно анализировать с помощью количественных методов обработки цифрового изображения, что дает возможность независимой оценки препаратов [39, 242, 249]. Антигенымишени, применяемые для иммуногистологической оценки воспаления в миокарде, представлены в табл. 18.12.

Рис. 18.32. Иммуногистологические признаки воспалительной кардиомиопатии (ВКМП). А - характерная картина диффузной инфильтрации LFA-1 и лимфоциты при ВКМП (×200); Б - цитотоксические Т-лимфоциты (перфоринположительные), окружающие кардиомиоциты и указывающие на миоцитолиз при ДКМП (×630); В - эндотелиальные адгезионные молекулы ICAM-1 при ВКМП (×200); Г - эндотелиальные адгезионные молекулы VCAM-1 при ВКМП
(×630). Источник (с разрешения): Noutsias M., Pauschinger M., Schultheiss H.P. et al. Cytotoxic perforin+ and TIA-1+ infiltrates are associated with cell adhesion molecule expression in dilated cardiomyopathy // Eur. J. Heart Fail. - 2003. - Vol. 5. - P. 469-479.
Таблица 18.12. Антигены, наиболее часто используемые для иммуногистологической оценки интрамиокардиального воспаления**
Антиген |
Распознаваемые фенотипы (экспрессия) |
|
|
CD3 |
Т-лимфоциты |
|
|
CD11a/LFA-1 |
Т-лимфоциты, большие гранулярные лимфоциты, включая |
|
цитотоксические Т-лимфоциты, рецепторное связывание с адгезионными |
|
молекулами ICAM-1 |
|
|
CD45R0 |
Т-клетки памяти |
|
|
Перфорин |
Специфические цитотоксические Т-лимфоциты |
|
|
CD11b/Mac-1 |
Макрофаги, рецепторное связывание с адгезионными молекулами ICAM-1 |
|
|
27E10 |
Специфические ранние активированные макрофаги |
|
|
Рецепторы комплекса |
Конститутивно экспрессируется на базальном уровне. Экспрессия |
гистосовме-стимости |
увеличивается при воспалительной кардиомиопатии на эндотелиальных |
I класса |
клетках и клетках интерстиция, иногда - на сарколемме кардиомиоцитов |
|
|
CD54/ICAM-1 |
Конститутивно экспрессируется на базальном уровне, экспрессия |
|
|
|
увеличивается при воспалительной кардиомиопатии на эндотелиальных |
|
клетках, клетках интерстиция, редко - на сарколемме кардиомиоцитов. |
|
Эндотелиальный рецептор для LFA-1+ и Mac-1+ |
|
|
CD106/VCAM-1 |
Экспрессируется только на эндотелиальных клетках. Отсутствует |
|
конститутивная экспрессия; de novo экспрессируется при воспалительной |
|
кардиомиопатии |
|
|
Примечания: ICAM-1 - межклеточные молекулы адгезии I типа; VCAM-1 - сосудистые молекулы адгезии I типа.
Источник (с разрешения): Noutsias M., Pauschinger M., Poller W.C. et al.
Immunomodulatory treatment strategies in inflammatory cardiomyopathy: current status and future perspectives // Expert. Rev. Cardiovasc. Ther. - 2004. - Vol. 2. - P. 37-51.
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ВИРУСНОГО ГЕНОМА
Обнаружение вирусных геномов с помощью молеку-лярно-биологических методов проводят с целью дифференциальной диагностики ВКМП. В связи с низкой чувствительностью и специфичностью сывороточные серологические тесты или иммуногистохимическое определение вируса в миокарде имеет невысокую диагностическую ценность. Проведение ПЦР-амплификации вирусного генома позволило подтвердить персистенцию вируса у большинства больных с миокардитом и ВКМП, а также существенно расширило спектр известных кардиотропных вирусов.
Неблагоприятное влияние персистирующей энтеровирусной инфекции на развитие ВКМП известно достаточно давно [126]. Результаты последних исследований подтвердили роль репликации этих вирусов в патогенезе ДКМП [127, 251]. В последнее время большое значение придают и другим кардиотропным вирусам, таким как парвовирус B19, вирус простого герпеса VI типа и вирус Эпштейна-Барр (см. рис. 18.27). Данные предварительных исследований показывают, что персистенция этих вирусов у больных с ВКМП прогностически неблагоприяна [45, 241]. Кроме того, при ретроспективном анализе у пациентов с персистирующей вирусной инфекцией (за исключением вируса гепатита С) отсутствовало клиническое улучшение, а в ряде случаев происходило ухудшение состояния на фоне иммуносупрессивной терапии [45]. На основании этого сделан вывод, что персистенция перечисленных вирусов в миокарде имеет такое же прогностически неблагоприятное значение и ассоциирована с такими же терапевтическими осложнениями, как и при инфекции, вызванной вирусом Коксаки.
В дополнение к амплификации вирусного генома с помощью гнездовой ПЦР для характеристики вирусных инфекций применяют и другие методологические подходы. Основная проблема состоит в определении репликативного типа вирусной инфекции, так как последняя может манифестировать в форме латентной инфекции или активной репликации в пределах пораженной ткани. Исследования показали, что при энтеровирусной инфекции у больных миокардитом и ВКМП с помощью аллель-специфичных праймеров, а также в результате обнаружения "минус-цепи" РНК, указывающей на активную репликацию вируса, обнаруживают оба типа вирусной репликации [251]. Следует отметить, что пациенты с ВКМП и активной репликацией энтеровируса имели значительно худший прогноз, нежели больные с ВКМП и латентной вирусной инфекцией [127]. ПЦР в режиме реального времени предназначена для количественной оценки вирусной нагрузки. Прямое секвенирование продуктов реакции позволяет определить вирусный генотип. Анализ последовательности следует выполнять с высоким контролем качества, что позволяет исключить возможную контаминацию (особенно при использовании гнездовых ПЦР-методов [42, 241, 248].
СТРАТЕГИЯ ЛЕЧЕНИЯ ИММУНОМОДУЛЯТОРАМИ
Иммуномодулирующую терапию следует рассматривать в качестве дополнительного метода лечения больных ВКМП, в том случае, если функция ЛЖ постепенно ухудшается, несмотря на проводимое лечение СН. Этот подход основан на предположении, что лечение последней не влияет на основные патогенетические механизмы развития ВКМП, а целенаправленная патогенетическая иммуномодулирующая терапия сдержит прогрессирование заболевания.
Недавние исследования продемонстрировали очевидные преимущества целенаправленной иммуномодулирующей терапии у отдельных больных с ВКМП при использовании современных методов диагностики. Выполнение эндомиокардиальной биопсии обязательно для подтверждения и верификации воспалительного процесса и (или) вирусной инфекции. Также необходимо оценить функциональную активность аутоантител. Все эти патогенетические факторы важны при определении тактики и стратегии иммуномодулирующей терапии. Согласно современным
представлениям, больным с ВКМП с иммуногистологически доказанным хроническим воспалением и отсутствием вирусной персистенции рекомендовано проведение иммуносупрессивной терапии. Иммуноадсорбция рекомендована тем пациентам, у которых присутствуют функционально активные антитела. Тем не менее больным с ВКМП с персистенцией кардиотропных вирусов иммуносупрессивную терапию назначать нежелательно, поскольку им рекомендовано противовирусное лечение. В настоящее время проведение иммуномодулирующей терапии доступно только экспертным центрам.
ИММУНОСУПРЕССИЯ
31 пациенту с ВКМП, подтвержденной иммуногистологическими методами, при отсутствии спонтанного выздоровления с целью иммуносупрессии проводили курс лечения глюкокортикоидами в течение 6 мес, после чего был отмечен значительный положительный эффект в отношении регресса симптомов СН, а также улучшение гемодинамических показателей. У 64% пациентов одновременно зарегистрировано значительное уменьшение инфильтратов и экспрессии молекул клеточной адгезии [252]. Столь существенное улучшение ФВ ЛЖ происходило независимо от первоначальной величины этого показателя, на основании чего можно предположить, что практически всем пациентам с ВКМП можно рекомендовать иммуномодулирующее лечение, даже в тех случаях, когда функция ЛЖ нарушена незначительно (например, региональная дисфункция ЛЖ). Этот вывод был сделан на основании результатов исследований, по данным которых у всех пациентов было продемонстрировано улучшение функции ЛЖ: ФВ увеличилась с 24 до 40% (р‹0,001) через 6 мес и до 44% (р‹0,001) через два года. Устойчивый положительный эффект иммуносупрессивной терапии в отношении регресса симптомов СН, размеров ЛЖ и ФВ у пациентов с иммуногистологически (анализ биоптатов) подтвержденной ВКМП был доказан в рандомизированном исследовании. 41 пациенту проводили лечение глюкокортикоидами и азатиоприном в течение 3 мес и более. В дальнейшем они состояли под наблюдением в течение двух лет [46]. Введение преднизолона начинали с дозы 1 мг/кг в день
ипо истечении 12 дней дозу постепенно снижали через каждые пять дней на 5 мг до достижения поддерживающей дозы 0,2 мг/кг в день. Лечение продолжали около 90 дней. Азатиоприн вводили в дозе 1 мг/кг в день в течение 100 дней. Это клиническое исследование подтверждает диагностическую чувствительность и точность метода, позволяющего обнаружить повышенное содержание адгезионных молекул при ВКМП даже при отсутствии лимфоцитарной инфильтрации, что, вероятно, обусловлено тесной связью между экспрессией адгезионных молекул и воспалительной инфильтрацией иммунокомпетентными клетками, а также продукцией провоспалительных цитокинов [39]. Таким образом, оценка экспрессии адгезионных молекул при иммуногистохимическом исследовании - важный критерий отбора пациентов, которые, скорее всего, ответят на иммуносупрессивную терапию. Кроме того, в этом исследовании впервые было показано, что проведение иммуносупрессивной терапии в течение 3 мес столь же эффективно, как
ив течение 6 мес. Благотворный эффект лечения сохраняется на длительный период времени
(около двух лет).
Вирусная персистенция и отсутствие аутоантител к миокарду - ключевые признаки заболевания у больных ВКМП, не ответивших на проведение иммуносупрессивной терапии в течение 6 мес [45]. Эти выводы подтверждают гипотезу о том, что больным с ВКМП с персистирующей вирусной инфекцией не следует назначать подобное лечение, так как угнетение противовирусного иммунитета может поддерживать вирусную репликацию. У таких пациентов предпочтение необходимо отдавать противовирусной терапии. Тем не менее это утверждение не относят к случаям ВКМП, индуцированной вирусом гепатита С.
ИММУНОАДСОРБЦИЯ
Основание для проведения иммуноадсорбции - необходимость удаления из плазмы крови пациента антител, оказывающих кардиодепрессивный эффект. В рамках процедуры выполняют забор условной единицы плазмы, которую пропускают через колонку с иммуносорбентом. В процессе повторных сеансов, проводимых через определенные промежутки времени, адсорбируется IgG. Первый курс, проводимый в течение трех дней подряд, включает ежедневные сеансы иммуноадсорбции. В дальнейшем через каждый месяц проводят еще четыре курса. После каждой сессии концентрацию IgG в крови восстанавливают посредством введения поликлонального IgG в дозе 0,5 г/кг.
Благоприятное влияние иммуноадсорбции на гемодинамику у больных с ВКМП может быть связано с удалением функционально активных миокардиальных аутоантител, поскольку иммуноадсорбция приводит к уменьшению лимфоцитарной инфильтрации и экспрессии адгезионных молекул, что можно подтвердить при исследовании биоптатов [253].
ПРОТИВОВИРУСНАЯ ТЕРАПИЯ
В противовирусном иммунном ответе в основном участвуют интерфероны I типа (например, интерферон-β). Во II фазе клинического исследования пациенты с ВКМП и доказанной по результатам биопсии персистирующей энтеровирусной инфекцией получали лечение интерфероном-β в течение 24 нед [44]. Результаты последующих биопсий продемонстрировали полную элиминацию вирусного генома у всех пациентов. Одновременно с этим было отмечено значимое повышение ФВ ЛЖ с 45 до 53% (p‹0,001) и ослабление симптомов СН.
ПРОГНОЗ И ИСХОД
Пятилетняя выживаемость пациентов, страдающих ВКМП, составляет около 36%. У 80% больных миокардит разрешается спонтанно. По данным проспективного наблюдения, прогноз у пациентов с миокардитом плохой: в основном в результате прогрессирования ВКМП и ВСС десятилетняя выживаемость составляет 45% [122].
Начальные клинические симптомы у больных с миокардитом и ВКМП достаточно разнообразны, равно как и прогноз. В настоящее время не существует доказанных клинических признаков, позволяющих с достоверностью прогнозировать трансформацию миокардита в ВКМП. Даже ФВ ЛЖ, которую считают достоверным предиктором ИБС, в случае острого миокардита подобного прогностического значения не имеет [122]. Кроме того, в отличие от ИБС, также не имеет прогностического значения высокая концентрация тропонина и активность креатининфосфокиназы.
Гистологическое и морфометрическое исследование биоптатов, полученных при эндомиокардиальной биопсии, большой прогностической ценности не имеет. Тем не менее обнаружение персистенции вирусной инфекции иммуногистологическими методами при имеющемся хроническом интрамиокардиальном воспалении, как правило, ассоциировано с плохим прогнозом у пациентов с ВКМП [126-128].
ВТОРИЧНЫЕ ЗАБОЛЕВАНИЯ МИОКАРДА
Поражение миокарда, возникающее на фоне известного заболевания, называют вторичным. Острая ишемия часто усиливает недостаточность ЛЖ, в то время как хроническая ишемия вызывает гибернацию миокарда. В связи с существованием жизнеспособного миокарда оба эти состояния могут быть обратимыми при выполнении реваскуляризации последнего. Нарушение функции желудочков часто обнаруживают и при аномалии строения сердечных клапанов. Классический пример - аортальный стеноз, при своевременной коррекции которого функция желудочков может нормализоваться. Артериальная гипертензия, сахарный диабет и избыточное употреб-ление алкогольных напитков - частые причины возникновения вторичной КМП. Редким, но серьезным заболеванием считают перипартальную, или послеродовую, КМП, возникающую во время беременности и после родов. Индуцированная тахикардией КМП развивается вследствие длительно существующей без полноценного лечения хронической предсердной или желудочковой тахикардии. Нормализация ЧСС приводит к восстановлению нормальной функции желудочков. Наконец, вовлечение сердечной мышцы в патологический процесс при мышечных дистрофиях также относят к вторичным заболеваниям миокарда.
ГИПЕРТОНИЧЕСКАЯ КАРДИОМИОПАТИЯ
Артериальная гипертензия - один из основных предрасполагающих факторов развития ИБС, СН, а также цереброваскулярных заболеваний. Хотя гипертрофию ЛЖ всегда рассматривали как реакцию адаптации к систолической перегрузке у больных с артериальной гипертензией, есть веские основания считать, что она связана с развитием дисфункции ЛЖ, нарушениями ритма и ВСС. Именно поэтому гипертрофию ЛЖ, возникшую на фоне имеющейся артериальной гипертензии, можно считать самостоятельной КМП.
Характерные гистологические изменения, обнаруживаемые при гипертонической КМП, - увеличение и полиплоидизация кардиомиоцитов [254]. Интерстициальный фиброз - ключевой признак гипертонической КМП, для которой характерно накопление коллагена I и III типа [255]. Тяжесть миокардиального фиброза коррелирует с массой миокарда, гипертрофией ЛЖ и систолическим АД [256]. При увеличении содержания коллагена в интерстициальной ткани в 2- 3 раза по сравнению с нормой миокард становится неподатливым. В результате развивается диастолическая дисфункция ЛЖ. В клинической практике артериальную гипертензию считают
ведущей причиной возникновения диастолической СН. Дальнейшее прогрессирование фиброза, в конечном итоге, приводит к развитию систолической недостаточности. В возникновении последней определенную роль может играть апоптоз кардиомиоцитов.
По мере развития гипертрофии коронарное микроциркуляторное русло не увеличивается в степени, достаточной для обеспечения кровоснабжения повышенной массы миокарада. В результате возникает нарушение сердечной микроциркуляции. Эндотелиальная дисфункция, утолщение медии и периваскулярный фиброз вносят свой вклад в уменьшение коронарного резерва [256]. В результате у многих пациентов с гипертонической КМП обнаруживают признаки и симптомы ишемии миокарда, несмотря на отсутствие обструкции венечных артерий при коронарографии.
ФП и желудочковые аритмии у больных с гипертензией и гипертрофией ЛЖ регистрируют чаще, чем в общей популяции населения. При ХМ на ЭКГ у таких пациентов обнаруживают частые мультифокальные ЖЭС и короткие эпизоды неустойчивой ЖТ. Устойчивая желудочковая тахиаритмия развивается редко [257]. Тем не менее у больных с гипертонической КМП отмечен повышенный риск ВСС, предикторами которого служат гипертрофия ЛЖ и желудочковые аритмии [260]. Аритмогенным субстратом в этом случае могут быть фиброз миокарда, ишемия, нарушение автономной регуляции и гетерогенное удлинение потенциала действия при гипертрофии ЛЖ [257].
Регресс гипертрофии ЛЖ сопровождается уменьшением желудочковой аритмии, улучшением диастолической функции, сохранением систолической функции и исчезновением микрососудистой ишемии. В дополнение к эффектам нормализации АД снижение массы ЛЖ в процессе антигипертензивного лечения ассоциировано с уменьшением числа сердечно-сосудистых событий. Тем не менее не все антигипертензивные препараты равноценны по влиянию на ремоделирование ЛЖ. Наиболее эффективны иАПФ и антагонисты ангиотензиновых рецепторов. Блокаторы медленных кальциевых каналов также способствуют снижению массы ЛЖ. Атенолол, напротив, связан с увеличением сердечно-сосудистой смертности [258]. Очевидную неэффективность в предотвращении ФЖ можно объяснить гидрофильностью атенолола и, следовательно, его низкой проницаемостью через гематоэнцефалический барьер.
АЛКОГОЛЬНАЯ КАРДИОМИОПАТИЯ
Алкогольная КМП - одна из форм ДКМП, развивающаяся вследствие хронического злоупотребления алкогольными напитками. Поскольку распространенность хронического последнего намного превышает таковую алкогольной КМП, вполне вероятно, что этанол, обладающий, как известно, кардиодепрессивным действием, вызывает развитие вторичной алкогольной КМП у больных с генетической предрасположенностью к ДКМП. Прием этилового спирта в дозе, превышающей 90 г в день в течение пяти лет, сопровождается повышенным риском развития алкогольной КМП [259]. Влияние этанола на сердце находится в нелинейной зависимости от дозы [260]. Порог развития алкогольной КМП ниже у женщин, хотя причины, лежащие в основе повышенной чувствительности к этиловому спирту, до сих пор остаются неизвестными [261].
В развитии алкогольной КМП можно выделить две фазы: бессимптомную, характеризующуюся изолированным расширением ЛЖ с диастолической дисфункцией или без нее, и фазу выраженных клинических симптомов, при которой отмечают систолическую дисфункцию ЛЖ, а также признаки и симптомы СН. Распространенность ФП и неустойчивой ЖТ при алкогольной КМП соответствует таковой при ДКМП. Сопоставима с ДКМП и частота возникновения ВСС, но прогноз у пациентов с алкогольной КМП при отказе от приема алкогольных напиков значительно лучше [262].
На основании данных, полученных в экспериментах in vitro и на животных моделях, были предложены несколько возможных механизмов развития алкогольной КМП, в том числе в результате индуцированного этиловым спиртом апоптоза кардиомиоцитов, нарушения функций митохондрий и саркоплазматического ретикулума, изменения экспрессии саркомерных белков и нарушения метаболизма кальция. Роль каждого из вышеперечисленных факторов еще предстоит уточнить в процессе клинических исследований.
Лечение СН улучшает функцию ЛЖ при алкогольной КМП (особенно при воздержании от употребления алкогольных напитков). В случае продолжающегося приема спиртного также зафиксировано увеличение ФВ ЛЖ, но медикаментозное лечение в этом случае не влияет на прогноз и выживаемость больных [263]. Таким образом, воздержание от приема алкогольных напитков - важное требование в лечении больных с алкогольной КМП. На основании результатов недавно проведенного исследования сделан вывод, что прогноз алкогольной КМП улучшается при умеренном потреблении этилового спирта [264]. Для того чтобы подтвердить рекомендации этого подхода, необходимо длительное наблюдение большой группы пациентов.
