
5 курс / Госпитальная педиатрия / 1 том Респираторная медицина
.pdf
Раздел 6
6-минутный тест
6-МТ — тест с произвольной скоростью ходьбы. Пациента просят ходить как можно быстрее в течение 6 мин по ровной местности. Основным результатом исследования является расстояние в метрах, пройденное пациентом за 6 мин (6-МР).
Методика проведения 6-минутного теста
6-МТ высокочувствителен к изменениям методики его проведения, поэтому рекомендуется четко соблюдать технические требования, разработанные совместно ERS и ATS.
Коридор. Коридор маркируют через каждые 3 м. Начало и конец дистанции отмечают конусами (аналогичными оранжевым дорожным конусам), которые ставят на расстоянии 0,5 м от концов коридора (рис. 6.18). Стартовая линия отмечается на полу яркой лентой [37]. Рекомендуемая длина коридора должна составлять 15–50 м [36, 38].
Рис. 6.18. Тест с 6-минутной ходьбой
Вспомогательные приспособления для ходьбы. Использование вспомогательных приспособлений для ходьбы, прежде всего роллаторов, увеличивает 6-МР на 2–46 м, или 1–14% (в среднем на 6,2%), причем этот эффект более выражен у больных с наибольшими нарушениями двигательной активности [38].
Кислород. Использование O2 во время тестирования увеличивает 6-МР на 12–50 м, при этом имеет значение способ перемещения источника O2 (самим пациентом или медицинским персоналом, использование тележки и т.д.) [38].
Прием лекарств. Бронходилататоры улучшают результат 6-МТ в среднем на 6–7 м. Эта разница не считается клинически значимой [38].
Общение с больным. Перед началом тестирования следует подробно объяснить больному его задачу. Исследователь должен проинструктировать пациента следующим образом: «Цель этого исследования — пройти за 6 мин как можно больше. Вы сами определяете интенсивность своей нагрузки. Возможно, у вас усилится одышка или появится усталость. При этом вы можете замедлить темп ходьбы, а если нужно, остановиться и отдохнуть. После отдыха следует продолжать ходьбу. Ходить нужно вперед и назад по коридору, обходя конусы. Поворачивать вокруг конусов нужно быстро и затем без задержки продолжать движение в обратном направлении» [37].
Установлено, что на результат 6-МТ оказывает значительное влияние словесная стимуляция пациента: если во время исследования потора-
пливать больного и просить его ускорить темп ходьбы, то результат теста можно увеличить на 41,5–66,5 м [39]. В связи с этим не рекомендуется разговаривать с пациентом во время тестирования. Можно лишь использовать стандартные ободряющие фразы: «Вы все делаете хорошо. Вам осталось ходить 5 мин», «Продолжайте так же хорошо выполнять задание. Осталось ходить 4 мин», «Все идет хорошо. Вы уже прошли половину», «Продолжайте так же. Вам осталось ходить всего 2 мин», «Вы все делаете правильно. Вам осталось ходить только 1 мин» [37]. Навязанное увеличение скорости ходьбы у больных с сердечно-сосудистой патологией влечет раннюю усталость и создает стресс, поэтому нельзя даже жестами требовать от больного ходить быстрее [37].
Если пациент во время исследования остановился и нуждается в отдыхе, таймер на это время не выключают. Если пациент отказывается продолжать ходьбу (или исследователь считает, что тест нужно прекратить), следует подвинуть кресло, усадить в него пациента и отметить в протоколе пройденное расстояние, время и причину преждевременного прекращения исследования.
За 15 с до завершения теста следует предупредить пациента, чтобы после просьбы остановиться он остановился там, где будет находиться
вэтот момент. Затем исследователь сам подходит к пациенту и при необходимости подкатывает к нему кресло. Точку остановки отмечают на полу куском яркой ленты либо другим маркером, затем подсчитывают пройденное расстояние в метрах.
Использование тредмила для выполнения 6-МТ
вцелях экономии пространства не рекомендуется, так как существенно сокращает 6-МР из-за непривычности такого вида ходьбы для большинства больных [36].
Параметры 6-минутного теста
Одышка. У больных с ХОБЛ 6-МР коррелирует с выраженностью одышки по шкале Борга (r=0,39–0,49), с одышкой при повседневных физических нагрузках (r=0,54) и качеством жизни (r=–0,69–0,43) [38].
Усталость. Субъективное ощущение усталости, как общей, так и усталости мышц нижних конечностей, является важным симптомом у больных с разнообразными бронхолегочными заболеваниями. При ХОБЛ этот симптом связан с выраженностью системного воспаления [38]. Для оценки усталости используют те же шкалы, что и для одышки; усталость оценивают в начале и в конце тестирования.
ЧСС. Во время 6-МТ рекомендуется регистрировать ЧСС до и после нагрузки, как правило, используя для этого пульсоксиметр. ЧСС вносит свой вклад в результат 6-МТ. Также при 6-МТ можно оценивать максимальную ЧСС, ЧСС через 2 мин после окончания теста (в период восстанов-
370

Функциональные исследования
ления) и восстановление (снижение) ЧСС через 1 или 2 мин после окончания теста. Так, у больных ИЛФ пороговое значение снижения ЧСС через 1 мин после завершения 6-МТ (ЧСС1), достоверно прогнозирующее летальность, составляет ≤13 в минуту. У больных c легочной артериальной гипертензией снижение ЧСС на <16 в минуту через 1 мин после завершения 6-МТ было связано с риском клинического ухудшения [38].
Таким образом, ЧСС является обязательным параметром 6-МТ. Особое внимание следует уделять измерению ЧСС1, хотя единые пороговые значения этого показателя для разных хронических бронхолегочных заболеваний пока отсутствуют.
SpO2. Измерение SpO2 во время 6-МТ позволяет выявить десатурацию на фоне физической нагрузки у больных, у которых в состоянии покоя показатели газообмена нормальные. Под десатурацией понимают снижение SpO2 во время 6-МТ на >4% исходного значения или менее 90% [38]. Десатурация на фоне нагрузки связана с более низкой повседневной физической активностью, более быстрым снижением легочной функции и неблагоприятным прогнозом заболевания [36].
Убольных с ХОБЛ 6-МТ чаще выявляет десатурацию на фоне физической нагрузки, чем НТ на велоэргометре [40, 41]. Надежное измерение
SpO2 во время 6-МТ возможно только при наличии адекватной пульсовой волны, что может быть проблематичным у больных с поражением легких на фоне системной склеродермии или при другой патологии периферических сосудов.
Десатурация во время 6-МТ имеет прогностическое значение при ХОБЛ, ИЗЛ, легочной артериальной гипертензии и системной склеродермии с поражением легких и связана с более тяжелым течением заболевания, более выраженной одышкой при физической нагрузке, дисфункцией скелетной мускулатуры и снижением повседневной физической активности [38].
Внастоящее время рекомендуется измерять
SpO2 непрерывно в течение всего 6-МТ. Это обеспечивает бóльшую безопасность исследования и позволяет более точно установить степень десатурации, поскольку у больных, которым приходится
останавливаться в процессе тестирования, SpO2 может максимально снижаться перед вынужденной остановкой и снова повышаться за время отдыха [38]. Масса пульсоксиметра не должна превышать 900 г, чтобы не создавать дополнительную нагрузку [37].
Помимо обычного измерения SpO2, существуют и другие показатели десатурации.
Произведение расстояния и сатурации (ПРС), измеряемое в метр-процентах, м/% (результат умножения 6-МР в метрах на минимальную за время теста SpO2 при дыхании атмосферным воздухом).
Убольных ИЛФ ПРС ≤200 м% связано с возрастанием риска летальности в 6,5 раза [42]. У больных саркоидозом ПРС более тесно коррелирует с
легочной функцией, одышкой и газообменом, чем 6-МР [43], хотя пока нет данных о прогностическом значении этого показателя при саркоидозе.
Площадь десатурации — площадь между кривой SpO2, измеряемой каждую минуту 6-МТ, и 100% уровнем сатурации. Чем больше площадь десатурации, тем более выражена десатурация в целом во время 6-МТ [44]. У больных ИЛФ увеличение площади десатурации на 10 единиц сопровождалось повышением риска летального исхода
в1,3 раза [44], однако этот показатель пока не получил широкого распространения.
Показатель соотношения расстояния и десатурации представляет собой комбинацию 6-МР и площади десатурации и тесно связан с тяжестью ИЗЛ [45], хотя точное прогностическое значение этого соотношения пока не изучено.
Таким образом, в последние годы появились новые показатели десатурации при 6-МТ, которые пока используются преимущественно у больных с ИЗЛ.
Работа в 6-МТ. На энергию, затрачиваемую больным при выполнении 6-МТ (работу), оказывает влияние масса тела больного. Работа в 6-МТ вычисляется как произведение 6-МР и массы тела больного; этот показатель позволяет лучше оценить величину нагрузки, чем 6-МР. Работа
в6-МТ более тесно, чем 6-МР, коррелирует с
V’O2peak (r=0,67–0,81 по сравнению с 0,40–0,54) и TLCO (r=0,60–0,70 по сравнению с 0,35–0,46) [38]. Однако более подробная информация об этом показателе пока отсутствует.
Безопасность 6-минутного теста
Осложнения во время проведения 6-МТ встречаются крайне редко. Наиболее частые нежелательные явления при 6-МТ — десатурация <80%, боль в грудной клетке и тахикардия, которые встречаются примерно у 6% больных, быстро исчезают после прекращения теста и не имеют отдаленных последствий. Появление других выраженных симптомов также служит поводом прекращения исследования и не рассматривается большинством авторов как осложнение [36]. С другой стороны, безопасность 6-МТ у больных с выраженной десатурацией (<80%) не изучалась [38].
Интерпретация результатов 6-минутного теста
Тренирующий эффект. При повторном проведении 6-МТ с интервалом от нескольких часов до 10 дней после первого тестирования 6-МР увеличивалось у 50–87% больных с ХОБЛ в среднем на 26,3 м, у 86% больных ИЗЛ в среднем на 19,55 м. У больных МВ улучшение 6-МР при повторном тестировании было менее выраженным и составило в среднем 4,18 м [38].
Таким образом, тренирующий эффект может быть достаточно велик и существенно влиять на оценку эффективности лечения или динамики функционального состояния больного. В этих
371

Раздел 6
ситуациях тестирование проводят дважды и выбирают лучшее значение 6-МР [36].
Должные величины 6-МР. В настоящее время существует 17 уравнений для расчета должного 6-МР (табл. 6.5). Различия в должных величинах, полученных разными авторами, объясняются расовыми и этническими различиями между популяциями, участвовавшими в исследованиях, и разными методиками проведения теста [38].
В связи с большой вариабельностью должных величин, полученных разными авторами, эксперты ATS/ERS рекомендуют по возможности рассчитывать должные величины 6-МР отдельно для каждой популяции больных.
Корреляция с показателями КРТН. У больных с различными хроническими бронхолегочными заболеваниями взаимосвязь 6-МР с V’O2peak, рассчитанным при КРТН, по данным разных авторов, колеблется от умеренной до сильной с коэффициентом корреляции r=0,4–0,8 [38].
Сопоставление пиковых показателей реакции кардиореспираторной системы на физическую нагрузку в ходе 6-МТ и КРТН у больных с ХОБЛ, ИЗЛ и легочной артериальной гипертензией в большинстве случаев не выявило достоверной разницы между достигнутыми V’O2peak и пиковой ЧСС. Напротив, V’CO2peak, пиковая вентиляция и RER во время 6-МТ были значительно ниже, чем при КРНТ [38].
Взаимосвязь 6-МР с тяжестью и клиническими исходами заболевания. 6-МР коррелирует, хотя
ине очень тесно, с таким показателем тяжести
ХОБЛ, как ОФВ1 (r=0,31–0,70), а при ИЗЛ — с форсированной жизненной емкостью (ФЖЕЛ) (r=0,10–0,40) и TLCO (r=0,42–0,61) [38]. У больных МВ 6-МР также коррелирует с ОФВ1 (r=0,53)
иФЖЕЛ (r=0,62), у больных легочной артериальной гипертензией — со средним давлением в ЛА (r=–0,20–0,62) [38].
Таблица 6.5. Уравнения для расчета должных величин 6-минутного теста [38]
Авторы и год |
Пол больных |
Уравнения для расчета должных величин 6-МР |
|
публикации |
|||
|
|
||
|
|
|
|
Casanova et al., 2011 |
Мужчины |
361–(В×4)+(Р×2)+(3×ЧССmax%должн.)–(М×1,5) |
|
|
Женщины |
361–(В×4)+(Р×2)+(3×ЧССmax%должн.)–(М×1,5)–30 |
|
Dourado et al., 2011 |
Все |
299,296–(2,728×В)–(2,160×М)+(361,731×Р*)+(56,386×пол#) |
|
|
Все |
109,764–(1,794×В)–(2,383×М)+(423,110×Р*)+(2,422×сила мышц$) |
|
Hill et al., 2011 |
Все |
970,7+(–5,5×В)+(56,3×пол#) |
|
Soares et al., 2011 |
Все |
511+(Р*×0,0066)–(В2×0,030)–(ИМТ2×0,068) |
|
Osses et al., 2010 |
Мужчины |
530–(3,31×В)+(2,36×Р)–(1,49×М) |
|
|
|
|
|
|
Женщины |
457–(3,46×В)+(2,61×Р)–(1,57×М) |
|
|
|
|
|
Alameri et al., 2009 |
Все |
(2,81×Р)+(0,79×В)–28,5 |
|
|
|
|
|
Ben Saad et al., 2009 |
Все |
750,50–(160×полf)–(5,14×В)–(2,23×М)+(2,72×Р) |
|
Iwama et al., 2009 |
Все |
622,461–(1,846×В)+(61,503×пол#) |
|
Jenkins et al., 2009 |
Мужчины |
867–(5,71×В)+(1,03×Р) |
|
|
|
|
|
|
Женщины |
525–(2,86×В)+(2,71×Р)–(6,22×ИМТ) |
|
|
|
|
|
Masmoudi et al., 2008 |
Все |
299,8–(4,43×В)+(342,6×Р*)–(1,46×М)+(62,5×полf) |
|
Camarri et al., 2006 |
Все |
64,69+(3,12×Р)+(2,29×ОФВ1) |
|
|
Все |
216,90+(4,12×Р)–(1,75×В)–(1,15×М)–(34,04×полf) |
|
Chetta et al., 2006 |
Все |
518,853+(1,25×Р)–(2,816×В)–(39,07×полf) |
|
Poh et al., 2006 |
Все |
(5,50×ЧССmax/ЧССmax%должн.)+(6,94×Р)–(4,49×В)–(3,51×М)–473,27 |
|
Gibbons et al., 2001 |
Все |
868,8–(В×2,29)–( полf×74,7) |
|
Enright et al., 2003 |
Мужчины |
510+(2,2×Р)–(0,93×М)–(5,3×В) |
|
|
|
|
|
|
Женщины |
493+(2,2×Р)–(0,93×М)–(5,3×В) |
|
|
|
|
|
Troosters et al., 1999 |
Все |
218+(5,14×Р)–(5,32×В)–(1,80×М)+(51,31×пол#) |
|
Enright et al., 1998 |
Мужчины |
(7,57×Р)–(5,02×В)–(1,76×М)–309 |
|
|
|
|
|
|
Женщины |
(2,11×Р)–(2,29×М)–(5,78×В)+667 |
|
|
|
|
|
|
Мужчины |
1,140–(5,61×ИМТ)–(6,94×В) |
|
|
|
|
|
|
Женщины |
1,017–(6,24×ИМТ)–(5,83×В) |
|
|
|
|
Примечание: В — возраст; Р — рост; М — масса тела. * Рост в метрах. # Мужской пол = 1, женский = 0. $ Имеется в виду сила мышц кисти, измеренная динамометром. f Мужской пол = 0, женский = 1. ИМТ — индекс массы тела; ОФВ1 — объем форсированного выдоха за 1-ю секунду.
372

Функциональные исследования
Более короткое 6-МР связано с более высокой летальностью у больных с ХОБЛ, в меньшей степени — у больных с ИЗЛ и легочной артериальной гипертензией. Менее тесная связь выявлена между 6-МР и риском госпитализаций больных с ХОБЛ и ИЗЛ [36].
Минимальная клинически значимая разница 6-МР.
Минимальная клинически значимая разница 6-МР для взрослых больных с хроническими бронхолегочными заболеваниями составляет около 30 м (25–33 м) вне зависимости от исходных характеристик больного или конкретного заболевания [36].
Динамика 6-МР на фоне лечения. У больных с ХОБЛ среднее улучшение 6-МР на фоне лечения, в первую очередь легочной реабилитации, составляет в среднем 48 м, при разрешении обострения ХОБЛ — в среднем 78 м. У больных с ИЗЛ улучшение 6-МР в среднем составляет 39 м, у больных легочной артериальной гипертензией — 34 м [38].
Таким образом, 6-МТ надежно отражает эффективность терапии большинства хронических бронхолегочных заболеваний. Физическая реабилитация в большей степени улучшает 6-МР, чем лекарственная терапия.
Шаттл-тесты
Шаттл-тест — внелабораторный НТ с ходьбой
взаданном темпе. Скорость ходьбы регулируется предварительно записанными звуковыми сигналами. Пациент получает инструкции ходить уверенным шагом с такой скоростью, чтобы к моменту следующего звукового сигнала достичь противоположного конца дистанции.
Нагрузка в шаттл-тесте может постепенно нарастать (ШТВН) или оставаться на одном уровне
втечение всего исследования (ШТПН).
Методика проведения
Шаттл-тест проводится на более короткой, чем 6-МТ, дистанции — 10 м, ограниченной, как и в 6-МТ, яркими дорожными конусами, расположенными на расстоянии 0,5 м от концов дистанции, для того чтобы пациент не сокращал расстояние (рис. 6.19). В начале теста пациенту дают подробные инструкции; необходимо убедиться, что он понял поставленную перед ним задачу. Тест начинается по тройному сигналу, в этот момент пациент начинает ходьбу, а исследователь включает таймер.
Рис. 6.19. Шаттл-тест
Во время теста исследователь должен постоянно держать пациента в поле своего зрения и быть уверенным, что он проходит нужное число кругов на каждом этапе теста, поэтому рекомендуется считать пройденные пациентом круги вручную.
Тест прекращается, когда: 1) пациент сообщает или показывает жестами, что не может далее продолжать ходьбу; 2) исследователь считает, что пациент не может далее продолжать ходьбу изза ухудшения состояния; 3) исследователь видит, что пациент не успевает поддерживать нужную скорость ходьбы и достичь противоположного конуса к очередному сигналу (находится к моменту звукового сигнала на расстоянии >0,5 м от конуса); при этом исследователь сначала просит пациента ускорить темп ходьбы, и если пациент не в состоянии эффективно увеличить скорость, тест прекращается. Также тест прекращается, если SpO2 снижается <80%.
Кроме того, исследование может быть прекращено по инициативе пациента, если он чувствует, что не может продолжать ходьбу, чаще всего из-за одышки. Однако могут быть и другие причины, побудившие пациента прервать исследование, например усталость ног, боль в ногах или спине и т.д.
Независимо от причины прекращения шаттлтеста по его окончании исследователь должен подсчитать пройденное пациентом расстояние в метрах по числу завершенных кругов [36].
Навязывание скорости ходьбы извне повышает объективность шаттл-теста и улучшает его воспроизводимость по сравнению с 6-МТ, позволяет стандартизировать величину физической нагрузки. Однако недостатком этого теста является больший, чем в тестах с произвольной скоростью ходьбы, риск развития сердечно-сосудистых осложнений, что обусловливает менее широкое его распространение [38].
Шаттл-тест с возрастающей нагрузкой
Методика проведения. Впервые методика ШТВН описана в 1992 г. для оценки физических возможностей больных с ХОБЛ [46]. В табл. 6.6 представлены инструкции для ШТВН.
Подобно КРНТ, ШТВН состоит из нескольких уровней (см. табл. 6.7), каждый длительностью 1 мин. Начальная скорость составляет 0,5 м/с и увеличивается каждую минуту на 0,17 м/с, при этом время между звуковыми сигналами соответственно укорачивается. Нагрузка может наращиваться более плавно («облегченный» вариант шаттл-теста, при котором тестирование заканчивается на 10-м уровне) [46] либо более активно (модифицированный вариант шаттлтеста, который насчитывает 12 уровней, при этом к концу тестирования скорость ходьбы и суммарная нагрузка будут выше, чем в первом варианте). На последнем 12-м уровне скорость ходьбы составляет 2,37 м/с [47]. Соответственно темпам увеличения нагрузки увеличивается число кругов, которые пациент должен пройти на каждом уровне. Так, в течение 1-й минуты пациент должен пройти 3 круга или 1 круг за 20 с, а на 2-й минуте он должен пройти 4 круга и т.д. Если пациент достиг конца дистанции раньше,
373
Раздел 6
Таблица 6.6. Инструкции для пациента по выполнению шаттл-теста с возрастающей нагрузкой [36]
ШТВН
Цель теста с возрастающей нагрузкой — пройти как можно больше туда и обратно вдоль 10-метровой дистанции. Скорость ходьбы будет диктоваться звуковыми сигналами
Вы должны ходить спокойным шагом так, чтобы в момент звучания каждого звукового сигнала дойти до конца дистанции и успеть повернуть вокруг конуса. Поначалу ваша скорость ходьбы будет очень медленной, но она будет возрастать каждую минуту. Каждый одиночный сигнал означает конец круга, каждый тройной сигнал — увеличение скорости ходьбы. Вы можете остановиться, только если больше не можете из-за одышки продолжать ходьбу с требуемой скоростью или не успеваете дойти до конца дистанции к моменту очередного сигнала
Нагрузка в этом исследовании нарастает до максимальной. Это означает, что в начале исследования ходить легче, а к концу все труднее. Первый круг вы должны пойти за 20 с, поэтому не развивайте сразу большую скорость. Исследование начнется через 15 с, поэтому приготовьтесь к старту. Начинайте идти после 4-секундного обратного отсчета и последующего за ним тройного сигнала
чем прозвучал сигнал, он должен остановиться |
ница, которая создает необходимость повторного |
|||||||
и продолжать ходьбу только после сигнала. В те- |
тестирования, особенно при первом обследовании |
|||||||
чение 1-й минуты, когда скорость ходьбы самая |
больного [38]. |
|
||||||
медленная, исследователь может идти рядом с |
|
Параметры ШТВН. Основным показателем |
||||||
больным, чтобы помочь ему понять суть теста, |
ШТВН является пройденное расстояние, измерен- |
|||||||
но уже со 2-й минуты пациент должен ходить |
ное с точностью до 10 м (по числу завершенных |
|||||||
самостоятельно. Поскольку скорость ходьбы воз- |
дистанций). Кроме этого, результат теста можно |
|||||||
растает каждую минуту после каждого тройного |
представить как число кругов и как достигнутый |
|||||||
сигнала, в этот момент разрешается напоминать |
уровень. Перед началом и по окончании ШТВН |
|||||||
пациенту: «Вам надо увеличить скорость ходьбы». |
измеряют ЧСС и АД, SpO2, одышку и усталость |
|||||||
Это единственная фраза, которую исследователь |
ног; по результатам теста можно рассчитать V’O2 и |
|||||||
может говорить пациенту во время исследования. |
максимальную вентиляцию. Десатурация в ШТВН |
|||||||
Скорость ходьбы возрастает до тех пор, пока |
более выражена, чем при 6-МТ. SpO2 и ЧСС целе- |
|||||||
пациент не перестанет успевать пройти нужное |
сообразно мониторировать непрерывно во время |
|||||||
расстояние до следующего звукового сигнала или |
тестирования для выявления максимальной деса- |
|||||||
когда он не сможет поддерживать нужную ско- |
турации и пиковой ЧСС [38]. |
|
||||||
рость из-за одышки/усталости. Максимальная |
|
Оценка результатов шаттл-теста с возрастающей |
||||||
продолжительность теста составляет 10 мин для |
нагрузкой |
|
||||||
облегченного варианта и 12 мин для модифици- |
|
Должные величины ШТВН. В настоящее время |
||||||
рованного варианта [46] (табл. 6.7). |
|
предложены три варианта уравнений для расчета |
||||||
Тренирующий эффект. При повторном прове- |
должных величин ШТВН, однако использование |
|||||||
дении ШТВН возможно появление тренирующего |
всех этих уравнений в клинической практике огра- |
|||||||
эффекта с разницей между результатами в 9–25 м |
ничено, так как они выведены для представителей |
|||||||
(в среднем 20 м). Это достаточно большая раз- |
бразильской популяции — здоровых добровольцев |
|||||||
Таблица 6.7. Протокол шаттл-теста с возрастающей нагрузкой [46] |
|
|
|
|
||||
|
|
|
|
|
|
|
||
|
«Облегченный» |
|
|
Модифицированный |
||||
Уровень |
|
|
|
|
|
|
|
|
скорость, м/с |
|
число кругов |
|
|
скорость, м/с |
|
число кругов |
|
|
|
в одном уровне |
|
|
в одном уровне |
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
1 |
0,62 |
|
3 |
|
|
0,50 |
|
3 |
|
|
|
|
|
|
|
|
|
2 |
0,72 |
|
4 |
|
|
0,67 |
|
4 |
|
|
|
|
|
|
|
|
|
3 |
0,82 |
|
4 |
|
|
0,84 |
|
5 |
|
|
|
|
|
|
|
|
|
4 |
0,92 |
|
5 |
|
|
1,01 |
|
6 |
|
|
|
|
|
|
|
|
|
5 |
1,02 |
|
6 |
|
|
1,18 |
|
7 |
|
|
|
|
|
|
|
|
|
6 |
1,12 |
|
6 |
|
|
1,35 |
|
8 |
|
|
|
|
|
|
|
|
|
7 |
1,22 |
|
7 |
|
|
1,52 |
|
9 |
|
|
|
|
|
|
|
|
|
8 |
1,32 |
|
7 |
|
|
1,69 |
|
10 |
|
|
|
|
|
|
|
|
|
9 |
1,41 |
|
8 |
|
|
1,86 |
|
11 |
|
|
|
|
|
|
|
|
|
10 |
1,52 |
|
9 |
|
|
2,03 |
|
12 |
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
2,20 |
|
13 |
|
|
|
|
|
|
|
|
|
12 |
|
|
|
|
|
2,37 |
|
14 |
|
|
|
|
|
|
|
|
|
374

Функциональные исследования
и больных с ХОБЛ или кардиологическими заболеваниями, и возможность экстраполяции этих должных величин на другие популяции и больных
сдругими заболеваниями неизвестна. Кроме того, должные величины, полученные в этих исследованиях, существенно различаются между собой, что, вероятно, связано с методологическими различиями в выполнении шаттл-теста [47].
Минимальная клинически значимая разница для ШТВН у больных с ХОБЛ составляет 47,5 м [38]. Данные для других заболеваний отсутствуют.
Динамика ШТВН на фоне лечения. Динамика результата ШТВН на фоне разных видов терапии изучалась всего в нескольких исследованиях
сучастием только больных с ХОБЛ. В целом пройденное расстояние увеличивалось на фоне терапии бронхолитиками на 13,2 м, кислородотерапии — на 33,2 м, физической реабилитации — на 64,35 м [38].
Взаимосвязь ШТВН с клиническими исходами заболевания. Согласно данным литературы, ШТВН является надежным показателем физического состояния больных с ХОБЛ. Результат ШТВН достоверно прогнозирует выживаемость и риск повторных госпитализаций у больных с ХОБЛ [38]. Пороговым значением ШТВН, связанным
сповышением летальности (в 2,8 раза), является 170 м, однако этот результат был получен пока в единственном исследовании [48].
Корреляция с показателями КРНТ. V’O2peak, пиковая величина работы и расстояние, пройденное
в ШТВН, тесно коррелируют с показателями максимальной нагрузки в КРНТ (r=0,75–0,88), при этом V’O2 одинаково для обоих тестов. По данным некоторых авторов, оба теста вызывают одинаковую кардиореспираторную реакцию на физическую нагрузку. Таким образом. ШТВН позволяет надежно оценить физические возможности больных с ХОБЛ при такой же кардиореспираторной реакции, что и КРНТ. Другие физиологические показатели (максимальная продукция CO2, максимальная легочная вентиляция) при ШТВН ниже, чем при КРНТ [36, 38].
Безопасность ШТВН. В литературе отсутствуют сообщения об осложнениях во время ШТВН [38].
Шаттл-тест с постоянной нагрузкой
ШТПН, в отличие от 6-МТ и ШТВН, оценивает не переносимость физической нагрузки, а выносливость. В этом варианте шаттл-теста, как и в предыдущем, скорость ходьбы задается извне звуковым сигналом, но частота его остается неизменной на протяжении всего исследования.
Методика проведения. ШТПН является производным ШТВН, поэтому основные принципы его выполнения те же, что и для ШТВН. Пациент должен ходить по 10-метровой дистанции, поворачивая вокруг конусов по сигналу, записанному с одинаковыми интервалами времени. Скорость ходьбы рассчитывается заранее и должна со-
ставлять 85% скорости, достигнутой пациентом
впредварительно проведенном ШТВН (V’O2peak 70–85% уровня, достигнутого в ШТВН) [38].
Перед тестированием пациенту ставят задачу ходить максимально долго с одинаковой скоростью.
ШТПН начинается с «разогрева» длительностью около 1,5 мин, когда пациент ходит с более медленной скоростью для «привыкания» к дистанции. Затем скорость ходьбы повышается до рассчитанной и не меняется до конца исследования. Момент повышения скорости, как и в ШТВН, определяется звуковым сигналом. Таймер включают только по окончании периода «разогрева». Завершение ШТПН определяется теми же условиями, что и ШТВН. Максимальная продолжительность теста 20 мин [36, 49].
Общение с пациентом. В литературе отсутствуют данные о влиянии различных ободряющих фраз на результат ШТПН, тем не менее рекомендуется ограничить общение с пациентом единственной фразой: «Вам надо увеличить скорость ходьбы» [36].
Повторное тестирование. При необходимости возможно выполнить повторный ШТПН с интервалом 40 мин и выбрать лучший из полученных результатов [49]. Однако если ШТПН и предшествующий ему ШТВН проводятся в один день, повторное тестирование необязательно [50].
Оценка результатов
Обычно результатом ШТПН является время,
втечение которого пациент выполнял заданную физическую нагрузку, но иногда результат выражают в метрах [38].
Должные величины для ШТПН в настоящее время отсутствуют.
Динамика результатов ШТПН на фоне лечения.
Ингаляция O2 во время тестирования увеличивает результат ШТПН в среднем на 273 с, однако этот эффект зависит от того, передвигает пациент самостоятельно источник кислорода или это делает идущий рядом исследователь [38], хотя эти данные получены в единичных исследованиях, а потому недостаточно надежны.
Минимальная клинически значимая разница для ШТПН составляет 65 с или 85 м, но получена только для бронхолитической терапии больных с ХОБЛ [38].
Взаимосвязь шаттл-теста с возрастающей нагрузкой с клиническими исходами заболевания
Внастоящее время нет данных о сопоставимости результатов ШТПН с другими НТ, включая КРНТ, и о прогностическом значении ШТПН.
Таким образом, нагрузка в ШТПН очевидно высокая, но она стабильная и соответствует проанализированным ранее физическим возможностям пациента. Данный тест также представляет собой компромисс между интенсивностью и продолжительностью нагрузки, поскольку окончание теста не программируется заранее. Этот момент
375
Раздел 6
можно рассматривать как недостаток, потому что тест может продолжаться очень долго, если интенсивность нагрузки недостаточно высока. По этой причине шаттл-тесты не подходят для здоровых людей, так как для достижения субмаксимальной и тем более максимальной нагрузки им потребуются слишком большая скорость ходьбы и длительное время исследования.
Другой недостаток ШТПН — необходимость предшествующего НТ с возрастанием нагрузки.
Заключение
В настоящее время в мире используются три варианта внелабораторных НТ: 6-МТ, ШТВН и ШТПН. Все эти тесты могут использоваться у больных с хроническими бронхолегочными заболеваниями.
Внелабораторные НТ применяются в клинической практике для оценки физических возможностей пациента (пиковой переносимости физической нагрузки или выносливости), выявления факторов, ограничивающих физическую толерантность (одышка, усталость, мышечно-скелет- ные ограничения) и оценки эффективности лечения. Некоторые внелабораторные НТ, в первую очередь 6-МТ, могут применяться для прогнозирования исходов и течения заболевания (летальности, риска повторных госпитализаций). Кроме того, можно использовать внелабораторные НТ для выбора интенсивности тренировок в программах легочной реабилитации.
Выбор одного из трех вариантов внелабораторных НТ определяется техническими возможностями: 6-МТ требует наличия коридора длиной около 30 м; если такой коридор отсутствует, то рекомендуется проводить шаттл-тест. С другой стороны, благодаря более длительному существованию 6-МТ, объем собранной в мире информации о нем значительно превышает объем данных по шаттл-тестам.
И 6-МТ, и шаттл-тесты позволяют достичь уровня V’O2, близкого к уровню в КРНТ, однако физиологическая реакция организма в ШТВН больше похожа на реакцию в КРНТ в силу регулируемой извне скорости ходьбы, в отличие от произвольной скорости в 6-МТ. Показатели, получаемые в ходе внелабораторных НТ, тесно коррелируют с клинически значимыми показателями КРНТ, что свидетельствует об объективности этих тестов и достоверности получаемых результатов.
Список литературы
См. 
6.3. Предоперационная оценка
А.В. Черняк
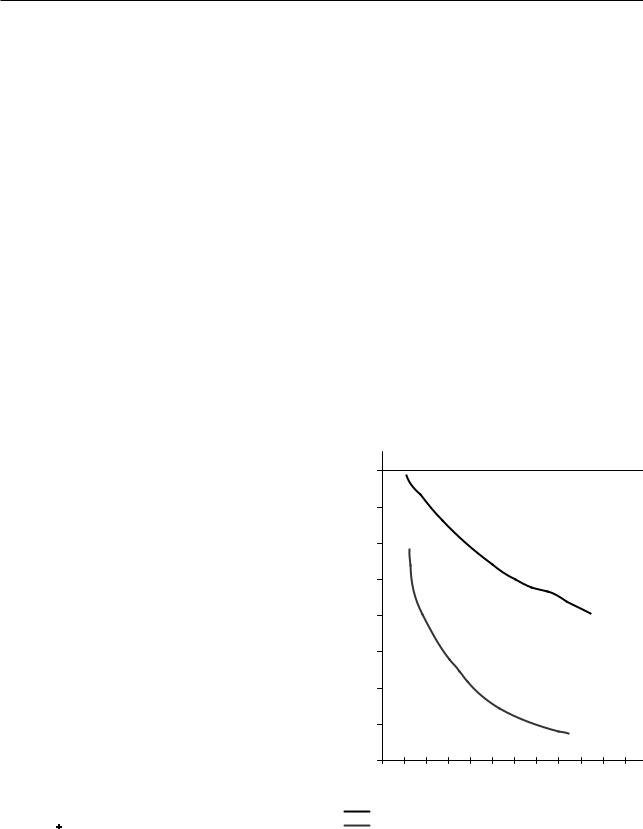
Пациенты, перенесшие торакальное хирургическое вмешательство, существенно отличаются от пациентов после кардиологической операции. Риск развития осложнений со стороны сердечно-сосуди- стой системы у пациентов с заболеваниями органов дыхания является значительным, но риск развития осложнений со стороны дыхательной системы вносит не меньший, если не более высокий вклад в послеоперационную летальность и осложнения у этой группы пациентов (рис. 6.20) [1].
Исследования последних десятилетий были направлены на то, чтобы еще до операции определить критерии, которые позволяют предсказать индивидуальный риск развития послеоперационных осложнений и летального исхода [1–4]. Основной задачей предоперационной оценки пациентов, направляемых на торакальное хирургическое вмешательство, является выявление пациентов с высоким риском серьезных операционных осложнений (в том числе «неоперабельных», т.е. пациентов, которым не рекомендуется оперативное лечение), разработка алгоритма операцион-
|
1.00 |
|
|
0.90 |
|
Выживаемость |
0.80 |
|
0.70 |
||
|
||
|
0.60 |
|
|
0.50 |
|
|
0.40 |
|
|
0.30 |
|
|
0.20 |
0 1000 2000 3000 4000 5000 Дни
Пациенты без осложнений Пациенты с 1 или более осложнений в первые 30 сут после операции
Рис. 6.20. Влияние послеоперационных легочных осложнений (в первые 30 дней после операции) на выживаемость пациентов (From Khuri S.F., Henderson W.G., DePalma R.G. et al. Determi-nants of long-term survival after major surgery and the adverse effect of postoperative complications. Ann Surg 2005. 242 (3). P. 326–341)
376

Функциональные исследования
ных и послеоперационных мероприятий, адекватные рекомендации по тактике ведения больных в предоперационный период, что позволит снизить риск интра- и послеоперационных осложнений и длительность нетрудоспособности.
Осложнения со стороны дыхательной системы
При торакальном хирургическом вмешательстве послеоперационные легочные осложнения (ПЛО) встречаются чаще (19–59%), чем при хирургическом вмешательстве в верхнем или нижнем отделе брюшной полости (16–17 и 0–5% соответственно) [5]. Такой большой разброс частоты ПЛО обусловлен различным подходом в определении ПЛО. Как правило, к ПЛО относят нозокомиальную пневмонию, ателектаз легкого (доли или целого легкого), ОДН, легочную эмболию, острый РДС, пневмоторакс, бронхоспазм, аспирационный пневмонит [6]. При этом чаще всего наблюдаются следующие осложнения со стороны дыхательной системы: ателектаз легкого, послеоперационная пневмония и ДН [7].
Ателектаз легкого
Ателектаз — наиболее распространенное послеоперационное легочное осложнение. При анестезии объемы легких быстро изменяются, остаются уменьшенными во время хирургического вмешательства и иногда в послеоперационный период. Легочная дисфункция характеризуется длительным снижением объема легких, приводит к развитию ателектазов и гипоксемии [8]. Снижение ЖЕЛ и ОФВ1, а также сопутствующее увеличение альвеолярно-артериальной разницы парциального давления кислорода (PAO2 – PaO2) отмечаются через неделю после оперативного вмешательства в грудной или брюшной полости даже при условии, что легкие не были затронуты. При общей анестезии увеличение PAO2 – PaO2 и альвеолярно-артериальной разницы парциального давления углекислого газа (PACO2 – PaCO2) может способствовать снижению эластичности легочной ткани, увеличению шунтирования крови, мертвого пространства и уменьшению эффективности вентиляции в результате рассогласования механизмов вентиляции и перфузии [9]. Ателектазы возникают преимущественно в дорсальных, каудальных отделах легких у лежачих пациентов, и объем поражения может достигать 10% всей легочной ткани [10].
Компрессия легочной ткани медиастинальными органами и давлением брюшной полости (снижение ФОЕ легких), а также изменение механики дыхания (снижение тонуса дыхательных мышц, изменения геометрии грудной клетки и диафрагмы) являются причинами развития ателектазов и соответственно гипоксемии [10]. Как правило, после абдоминального хирургического вмешательства с
применением общей анестезии даже у пациентов, не входящих в группу риска, рентгенологически выявляются ателектазы [11]. При применении положительного конечно-экспираторного давления (PEEP) ателектазы обычно расправляются [12]. В лежачем положении пациента при применении общей анестезии диафрагма движется в краниальном направлении, способствуя уменьшению легочных объемов. Было отмечено, что у пациентов с выраженным послеоперационным снижением ФОЕ вероятность ПЛО наиболее высока [13]. Послеоперационные ателектазы возникают не только в результате снижения сократительной способности диафрагмы и ограничения дыхательных движений, связанных с послеоперационной болью, но и в результате уменьшения возбуждения диафрагмального нерва [14]. Кроме того, спадение альвеол может происходить в результате вдыхания газовых смесей с низким содержанием азота во время анестезии [9]. После абдоминального хирургического вмешательства дыхание пациентов обычно частое и поверхностное с тенденцией к парадоксальному движению брюшной стенки, что также способствует развитию ателектазов [11]. Ателектазы сохраняются до 2 дней после хирургического вмешательства, а после лапароскопии у пациентов без избыточной массы тела — в течение 24 ч [10, 15]. У пациентов, страдающих ожирением, объем ателектазов больше и дольше период их разрешения [15].
Применение обезболивающих средств и/или послеоперационные процедуры, направленные на увеличение объема легких (например, лечение интермиттирующим положительным давлением, побудительная спирометрия, тренировка инспираторных мышц), уменьшают послеоперационную легочную дисфункцию, однако полностью не предотвращают развитие ателектазов [15]. Было показано, что большинство мероприятий, разработанных для увеличения объема легких и раскрытия ателектазов, одинаково эффективны [15].
Послеоперационная пневмония
В послеоперационном периоде пациенты стараются подавлять кашель, чтобы избежать усиления боли в месте рассечения, что затрудняет выведение бронхиального секрета. Кашель способствует очищению дыхательных путей только при адекватном экспираторном потоке. У пациентов с обструктивными заболеваниями органов дыхания экспираторный поток снижен исходно, следовательно, существует предрасположенность к тому, что кашель будет неэффективным. Послеоперационное снижение легочных объемов (в том числе ОФВ1) также способствует снижению эффективности кашля. Кроме того, при торакальных операциях повреждается мускулатура грудной клетки, что может приводить к снижению растяжимости грудной клетки [16]. При повреждении экспираторных дыхательных мышц эффективность кашля
377

Раздел 6
временно снижается, усиливая застой бронхиального секрета в дыхательных путях.
Развитию пневмонии может способствовать нарушение мукоцилиарного клиренса в послеоперационный период [17]. Механизм нарушения мукоцилиарного клиренса не до конца ясен, предполагают, что основной причиной является эффект, оказываемый ингаляционными анестезирующими средствами, а также травмирование трахеи при интубации [18]. Свой вклад вносят послеоперационное уменьшение подвижности больного, диафрагмальная дисфункция и обезболивающий эффект лекарственных препаратов.
Риск пневмонии также возрастает при наличии инфекции респираторного тракта, даже при отсутствии очевидной клинической картины. Carrel
исоавт. обнаружили, что пневмонии чаще развиваются у тех больных, у которых, несмотря на назначение антибактериальной терапии, в операционном аспирате из трахеи были обнаружены патогенные микроорганизмы (у 8 пациентов из 26). При отсутствии патогенной флоры пневмония развивалась редко (у 1 пациента из 72) [19]. Таким образом, предоперационная подготовка пациента должна включать выявление возможной инфекции дыхательных путей с тем, чтобы при необходимости назначать антибактериальную терапию для снижения риска развития послеоперационной пневмонии. У пациентов, постоянно продуцирующих мокроту, выявление инфекции может быть затруднено. В этом случае клинические признаки (изменение цвета и количества мокроты, возникновение одышки) должны настораживать в плане возможного инфицирования дыхательных путей
ибудет полезным назначение антибиотиков [20].
Дыхательная недостаточность
ДН возникает не у всех пациентов в послеоперационном периоде. Развитие ДН зависит от типа хирургического вмешательства, его продолжительности и индивидуальных особенностей пациента [21]. О ДН говорят в тех случаях, когда продолжительность механической вентиляции легких составляет более 48 ч либо проводится реинтубация. Как правило, ДН развивается у пациентов с тяжелыми обструктивными заболеваниями при торакальном или абдоминальном (в верхних отделах брюшной полости) хирургическом вмешательстве. Samuels и соавт. проанализировали результаты операций аортокоронарного шунтирования. Продолжительная механическая вентиляция легких потребовалась 7% пациентов, страдающих ХОБЛ (n=191), и только в 3% случаев при отсутствии ХОБЛ (n=1738) [22].
Дооперационная задержка углекислого газа (CO2), избыточная масса тела пациента, сепсис и состояние шока также увеличивают риск развития послеоперационной ДН. Уменьшение легочных объемов и скорости потока после оперативного лечения приводят к тому, что у пациентов в после-
операционный период возникает несоответствие между вентиляторным обеспечением и вентиляторным запросом. Проблема выведения CO2, как правило, возникает у пациентов с тяжелыми заболеваниями органов дыхания. У таких пациентов вентиляция может быть не только существенно снижена, но также и неэффективна, что проявляется в увеличении отношения физиологического мертвого пространства к дыхательному объему (Vd/Vt). Степень нарушения отношения Vd/Vt можно вычислить, измеряя продукцию CO2, артериальную концентрацию CO2 и минутный объем вентиляции [23].
Послеоперационное инфицирование с лихорадкой приводит к усилению метаболизма, что вызывает повышение продукции CO2 и способствует развитию острого респираторного ацидоза с последующей ДН [24]. Кроме того, питание с высоким содержанием углеводов, увеличивая RER, может тоже способствовать увеличению продукции CO2 и вентиляторного запроса.
Торакальная хирургия
У пульмонологических больных основным видом хирургического вмешательства является резекция легкого при раке легкого. Радикальная операция (лобэктомия или пневмонэктомия) является лучшим шансом лечения у больных раком легких, особенно это относится к пациентам с раком в стадии IA и IB. Неутешительные результаты, связанные с консервативным лечением рака легких, применение новых хирургических методов, улучшение анестезиологического пособия и послеоперационного ведения привели к росту числа пациентов, ранее считавшихся неоперабельными,
ик пересмотру критериев оценки «операбельности» больного. Falcoz и соавт. проанализировали базу данных Французского общества торакальной
исердечно-сосудистой хирургии, включавшую данные более 15 000 пациентов, и предложили прогностическую модель, получившую название Thoracoscore (Thoracic Surgery Scoring System). Thoracoscore позволяет оценить риск хирургического вмешательства с помощью оценки 9 факторов, которые увеличивают смертность: возраст, пол, тяжесть одышки, физический статус пациента по ASA (American Society of Anesthesiologists), физическая работоспособность, экстренность операции, диагноз, тип хирургического вмешательства и наличие сопутствующих заболеваний [25]. B.D. Kozower и соавт. предложили свою систему оценки риска оперативного лечения, для создания которой были изучены показания более чем 18 000 пациентов из базы данных Общества торакальной хирургии (Society of Thoracic Surgeons, STS). По их данным, на смертность влияют следующие факторы: физический статус пациента по ASA, функциональной статус по шкале ВОЗ (также называемой шкалой Zubrod), почеч-
378

Функциональные исследования
ная дисфункция, химиолучевая терапия, ОФВ1, ИМТ, мужской пол и тип операции [26]. Важным ограничением этих моделей является отсутствие такого фактора, как диффузионная способность легких (DLCO), так как многим пациентам этого измерения не проводили. Анализ показаний более 7800 пациентов, у которых измерение DLCO проводили, продемонстрировал, что DLCO является сильным независимым предиктором смертности в дополнение к ранее упомянутым факторам [27]. С помощью этих, пусть и не идеальных, моделей врач на основании анализа объективных данных может получить оптимальный алгоритм ведения сложных больных [6].
Оценка риска развития осложнений со стороны сердечно-сосудистой системы у пациентов с заболеваниями органов дыхания
Наиболее частым осложнением со стороны сердечно-сосудистой системы бывает развитие инфаркта миокарда (ИМ), сопровождаемое высокой летальностью — 15–25%. Другими осложнениями хирургического вмешательства являются: тяжелые нарушения ритма сердца, декомпенсация хронической СН (ХСН), смерть от сердечных причин [28]. Летальные исходы вследствие сердечно-сосу- дистых причин в ходе крупных внесердечных операций составляют 0,5–1,5%, а любые кардиальные осложнения — 2–3,5% [28].
Предоперационная оценка не включает обязательное развернутое исследование сердечно-со- судистой системы у всех пациентов. Потребность в таком исследовании определяется наличием клинических факторов риска (выявленных при клиническом осмотре, анализе ЭКГ покоя, физикальном обследовании и оценке функционального статуса) и риском, связанным непосредственно с хирургическим вмешательством (большинство операций торакальной и абдоминальной хирургии относятся к хирургическим вмешательствам промежуточного риска, при которых ИМ или смерть от сердечных причин развивается в 1–5% случаев) [4, 28]. Рутинное исследование функции ЛЖ не является обязательным условием при предоперационной оценке, поскольку эхокардиографическое исследование не дает дополнительной информации относительно предсказания операционного риска по сравнению с клиническими данными [4, 28]. На ЭхоКГ-исследование следует направлять всех пациентов с признаками обструкции выносящего тракта ЛЖ и с подозрением на другие клапанные пороки, с дисфункцией ЛЖ или легочной гипертензией [в соответствии с рекомендациями Американской коллегии кардиологов и Американской ассоциации сердца (AHA/ACC)].
Современные международные и российские рекомендации предлагают алгоритм предоперационной оценки сердечно-сосудистой системы у пациентов как ССЗ, так и с заболеваниями
органов дыхания (см. рис. 6.21) [4, 28]. Важное место в этом алгоритме играет индекс сердечного риска, предложенный Lee и соавт. [29]. Индекс Lee включает 5 факторов риска: наличие ИБС в анамнезе, заболевания сосудов головного мозга, СН, инсулинзависимый сахарный диабет, почечная недостаточность (креатинин >2 мг/дл). Наличие каждого фактора оценивается в 1 балл. На основании данного индекса выделяют категории низкого (0 баллов), умеренного (1–2 балла) и высокого (3 балла и более) риска оперативного лечения. В настоящее время широко используется модификация индекса Lee — пересмотренный индекс сердечно-сосудистого риска (RCRI: Revised Cardiac Risk Index), который дополнен 6-м фактором риска — абдоминальное, торакальное или сосудистое хирургическое вмешательство.
Большинство торакальных хирургических вмешательств относится к операциям промежуточного риска, но пациенты, имеющие функциональное состояние менее 4 МЕТ [1 МЕТ — это потребляемое организмом количество кислорода в состоянии покоя, равное 3,5 мл O2 на 1 кг массы тела в минуту (мл·кг–1·мин); невозможность выполнить нагрузку, эквивалентную 4 МЕТ (неспособность пройти 4 квартала или подняться на 2 пролета лестницы), указывает на низкую толерантность к физической нагрузке и ассоциируется с повышенным риском сердечно-сосудистых осложнений после операции] и более 1 фактора риска индекса Lee требуют такого же обследования и периоперационного лечения, как и больные с доказанной ИБС [28].
Неинвазивное нагрузочное тестирование у пациентов этой группы рекомендуют проводить тогда, когда это может изменить стратегию лечения [4, 6, 28]. При выявлении критериев высокого риска по данным НТ решение по тактике лечения должно приниматься индивидуально, включая оценку потенциальной пользы и риска планируемого хирургического вмешательства и рассмотрение вопроса о проведении коронарографии и хирургической реваскуляризации миокарда первым этапом [28].
Коронарная реваскуляризация
На основе консенсуса, достигнутого в течение последнего десятилетия, пришли к выводу, что коронарография и предварительная коронарная реваскуляризация (коронарное шунтирование или чрескожное коронарное шунтирование) перед внесердечным хирургическим вмешательством оправдана лишь у пациентов, имеющих показания к их проведению независимо от факта предстоящей внесердечной операции. При этом предполагаемый риск периоперационных осложнений при реваскуляризации миокарда, рассчитанный по шкале EuroSCORE, не должен превышать риск кардиальных осложнений внесердечного хирургического вмешательства [28].
379
