
3. Гаптоглобин синтезируется в печени. Факторы, регулирующие его образование, неизвестны. Биологическая роль также недостаточно ясна. Комплекс гемоглобин-гаптоглобин быстро разрушается в организме, поэтому он может ускорять катаболизм гемоглобина, попавшего в плазму крови при разрушении эритроцитов в очаге воспаления. Возможно, гаптоглобин сохраняет Fe в организме. Содержание в крови в норме – 0,6-1,8г/л, при воспалении – 3-6г/л.
4.Ферменты плазмы крови
1)Секреторные – синтезируются в органах, но свое действие оказывают только в сосудистом русле. Например, ЛХАТ, ЛПЛ. ЛХАТ синтезируется в печени, катализирует эстерификацию холестерина в сосудистом русле. ЛПЛ синтезируется в клетках жировой и мышечной ткани, секретируется в кровь и участвует в гидролизе триацилглицеринов, входящих в состав липопротеинов.
2)Индикаторные – синтезируются и оказывают свое действие
только в тканях. Появление их в крови говорит о повреждении клеток. Например, АсАТ, АлАТ.
3) Экскреторные – нормальные компоненты желчи, при желчнокаменной болезни попадают в кровь. Например, щелочная фосфатаза, лейцинаминопептидаза.
В плазме крови содержатся промежуточные и конечные продукты обмена белков. Это небелковые азотистые вещества: полипептиды, аминокислоты, мочевина, мочевая кислота, креатин, креатинин, пурины, пиримидины.
Среди безазотистых веществ в крови присутствуют продукты обмена углеводов и липидов: глюкоза, молочная и пировиноградная кислоты, жирные кислоты, глицерин, кетоновые тела.
Постоянными компонентами плазмы являются минеральные ве-
щества: NaCl, КCl, CaCl2, MgCl2, NaHCO3, CaCO3, K2HPO4, Ca(PO4)2, Na2SO4, незначительные количества соединений Fe, Cu, Zn, I, Mn, Co.
5. Белки эритроцитов
Представлены гемоглобином и небольшим количеством белков стромы.
Различают два основных типа белков плазматической мембраны: поверхностные и интегральные. Поверхностные белки локализованы на внутренней цитоплазматической поверхности мембраны. К ним относятся глицеральдегид-3-фосфатдегидрогеназа, актин, спектрин. Цепи спектрина образуют разветвленную волокнистую сеть. Спектрин стабилизирует и регулирует вместе с актином форму мембраны эритроцитов, которая изменяется при прохождении клеток через капилляры.
501
Интегральные белки расположены внутри мембраны. Их можно отделить от мембраны только с помощью детергентов или органических растворителей. В мембране имеется анионный канал, делающий ее проницаемой для НСО3- и Сl- . Это димер белка и составляет ¼ общего количества белка в мембране. Этот канал имеет большое значение для транспорта СО2 эритроцитами, канал Na+K+ АТФ-азы.
Гемоглобин - основной белок эритроцитов. Это сложный Fe содержащий белок с м.м. 68000. Состоит из белковой части – глобина и простетической группы гема. Молекула имеет 4 субъединицы с М. м. 17 тыс. каждая. В состав субъединицы входит гем и одна полипептидная цепь.
В глобин входит 574 аминокислоты. Различают 2 α и 2 β цепи. α- цепь состоит из 141 аминокислоты, N концевая - валин, С - аргинин. β- цепь имеет 146 аминокислот, N концевая - валин, С - гистидин. Четвертичная структура гемоглобина состоит из 2-х α и 2-х β цепей:
α2 β2 . Это основной гемоглобин взрослого человека НbА1 (adul-
tus).
Гемовые группы находятся на поверхности глобулы в особых карманах, образованных петлями полипептидной цепи. Глобин соединяется через имидазольное кольцо гистидина с гемом по 5 координационной связи железа.
|
|
|
|
|
а) |
Гем |
|
|
|
|
|
|
|
|
|
б) |
|
|
|
|
|
||
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гемоглобин |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
HC |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
C |
H |
|
C |
|
|
|
|
|
|
CH2 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C C |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H3C |
C |
|
|
|
|
|
|
|
|
|
|
|
|
H2C C |
|||||||||
C |
|
|
N |
|
N |
|
|
C |
C |
|
|
CH2CH2COOH |
C |
|
|
||||||||
|
|
|
|
|
|
|
|||||||||||||||||
HC |
|
|
|
|
Fe |
|
|
|
|
CH |
|
|
|
|
|
N Fe |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
H |
|
C |
|
|
N |
|
N |
|
|
C |
|
H |
N |
C |
|
|
|||||||
|
|
|
|
|
|
|
|||||||||||||||||
C |
C |
|
|
|
C |
|
C |
|
|
|
C CH2CH2COOH |
|
|
H |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
H2C |
|
|
|
|
C |
C |
|
|
|
|
|
|
|
|
Плоскость порфи- |
||||||||
|
|
|
C |
|
|
|
|
|
|
|
|
ринового кольца |
|||||||||||
|
|
|
|
|
|
H |
CH3 |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
в) |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Оксигемоглобин |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
CH2 |
H |
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|||||
H2C |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|||||
|
|
C |
C |
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
N |
|
Fe O |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
H |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Плоскость порфиринового кольца
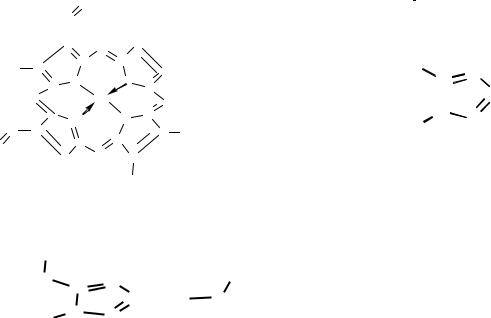
Структура гема (а), структура активного центра дезоксигемоглобина (б), структура активного центра оксигемоглобина (в)
502
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшиеся две связи – перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепей глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (называемый также метгемоглобином). В феррогемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, а вторая связь свободна (рис. б). Кроме этого гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток – дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода со свободным гемом приводит к необратимому окислению атома железа тема
[Fe(II) Fe(III); гем гемин]. В дезоксигемоглобине глобин предохраняет железо гема от окисления.
Обратимое присоединение кислорода (оксигенация), позволяющее гемоглобину выполнять свою основную функцию переносчика, обеспечивается возможностью образовать прочные пятую и шестую координационные связи и перенести электрон на кислород не от железа (то есть окислить Fe2+), а от имидазольного кольца проксимального гистидина. Вместо молекулярного кислорода железо гема может присоединить окись углерода СО (угарный газ). Даже небольшие концентрации СО приводят к нарушению кислородпереносящей функции гемоглобина и отравлению угарным газом.
Выше было сказано, что одна молекула гемоглобина содержит четыре субъединицы и, следовательно четыре тема, каждый из которых может обратимо присоединить одну молекулу кислорода. Поэтому реакцию оксигенации можно разделить на четыре стадии:
Нb + О2 HbO2 НbО2 + О2 Hb(O2)2
Hb(O2)2 + О2 Hb(O2)3
Hb(O2)3 + О2 Hb(O2)4
Прежде чем рассмотреть эту главную функциональную реакцию гемоглобина более детально, необходимо сказать несколько слов о мышечном гемоглобине – миоглобине. Он содержит одну молекулу гема и одну полипептидную цепочку, состав и структура которой подобны составу и структуре β-субъединицы гемоглобина. Как и для ге-
503
моглобина, важнейшей функцией миоглобина является обратимое присоединение молекулярного кислорода. Эту функцию характеризует так называемая кривая оксигенации, связывающая степень насыщения гемоглобина кислородом (в процентах) с парциальным давлением по-
следнего, ро2 (мм Hg). |
|
|
|||
100Y, % |
|
а |
|
|
23 |
8 |
|
|
|
|
|
|
б |
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
2 |
|
|
|
|
|
0 |
2 |
4 |
6 |
8 |
100 |
|
|||||
|
|
ро2, мм Hg |
|
|
|
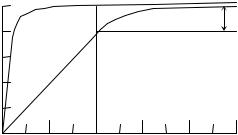
Типичные кривые оксигенации гемоглобина и миоглобина (при условии достижения химического равновесия) приведены на рис. Для миоглобина кривая является гиперболой, как и должно быть в случае одностадийной химической реакции при условии достижения химического равновесия:
Кривые оксигенации миоглобина (а) и гемоглобина (б)
Совершенно другая картина возникает в случае гемоглобина. Кривая диссоциации имеет S-образную форму. Без кислорода молекулы гемоглобина обладают низким сродством к кислороду, затем кривая становится круче и при высоких значениях рО2 практически сливается с кривой диссоциации миоглобина.
Между гемами одной молекулы гемоглобина существует некоторая связь, благодаря которой присоединение кислорода к одному гему влияет на присоединение кислорода к другому гему той же молекулы. Это явление получило название гем-гем взаимодействия. Физиологический смысл гем-гем взаимодействия очевиден. Сигмоидная форма кривой диссоциации создает условия максимальной отдачи кислорода при переносе гемоглобина от легких с высоким значением рО2 к тканям с низким значением рО2. Для человека значения рО2 артериальной и венозной крови в нормальных условиях (Т 37°С, рН 7,4) равны соответственно 100 и 40 ммНg. При этом (рис. б) гемоглобин отдает тканям 23% связанного кислорода (степень оксигенации меняется от 98 до 75%). При отсутствии гем-гем взаимодействия для одногемового миоглобина (рис. а) эта величина не превышает 5%. Миоглобин поэтому служит не переносчиком, а депо кислорода и отдает его мышечной ткани лишь при резкой гипоксии, когда насыщение ткани кислородом падает до недопустимо низкого значения.
Присоединение кислород меняет кислотно-основные свойства гемоглобина. Оксигемоглобин является более сильной кислотой, чем дезоксигемоглобин. Поэтому в тканях, где значительная часть гемоглобина теряет кислород и становится более сильным основанием, гемоглобин связывает образующуюся в ходе метаболических внутриклеточных процессов углекислоту. В альвеолах легких дезоксигемоглобин
504
снова превращается в оксигемоглобин, становится более сильной кислотой и способствует отщеплению СО2 . Это слегка упрощенное опи-
сание важного процесса транспорта углекислоты эритроцитами.
Углекислота, освобожда-емая тканями, недостаточно хорошо растворима для эффективного переноса. С помощью фермента карбоангидразы, ускоряющего прямую и обратную реакцию двуокись углерода
СО2 + Н2О НСО3– + Н+,
превращается в хорошо растворимый бикарбонат-анион. В капиллярах тканей отщепление кислорода повышает содержание дезоксигемоглобина, связывающего протоны и смещающего, таким образом, равновесие реакции вправо. Легко растворимый ион бикарбоната переносится кровью. В альвеолах легких гемоглобин оксигенируется, протоны освобождаются и равновесие смещается влево. Образуется плохо растворимая двуокись углерода СО2, которая удаляется из водной фазы и выдыхается. Таким образом, гемоглобин работает как буфер с переменным значением рК. Функция гемоглобина как переносчика углекислоты не менее важна, чем его функция переносчика кислорода.
Производные гемоглобина
1)Гемоглобин, не связанный с О2 и содержащий гем с Fe 2-х валентным, называют дезоксигемоглобином, востановленным гемоглобином, сокращенно Hb.
2)Полностью оксигенированный Hb, называемый оксигемоглобином, содержит 4 молекулы О2.
3)Гемоглобин может присоединять СО2, образуя карбгемогло-
бин.
4)Карбоксигемоглобин образуется при присоединении угарного газа СО-. При этом гемоглобин теряет способность связывать О2 , развивается удушье.
5)Метгемоглобин – содержит Fe в 3-х валентной форме и не мо-
жет присоединять О2. В небольших количествах образуется в норме,но при участии метгемоглобинредуктазы востанавливается до гемоглобина.
Повышение количества метгемоглобина (метгемоглобинемия) наблюдается у людей:
1)После воздействия амилнитрита, анилина, (нитробензола), нитратов, сульфаниламидов, (фенацетина), салицилатов - окисляющих Fe 2-х валентное в Hb до 3-х валентного.
2)Семейная метгемоглобинемия обусловлена редкой врожденной недостаточностью метгемоглобинредуктазы в эритроцитах боль-
505
ных. В этом случае от 25 до 40% всего гемоглобина может нах одиться
ввиде MеtHb, что приводит к цианозу.
3)С HbМ.
HbМ - это группа гемоглобинов, у которых вследствие мутации остаток гистидина, участвующий в связывании Fe, замещен другими аминокислотами, чаще тирозина. Это приводит к тому, что Fe окислено до Fe3+ и не может восстановиться метгемоглобинредуктазой.
МеtHb способен связать синильную кислоту с образованием малотоксичного цианметгемоглобина. Поэтому противоядием при отравлении синильной кислотой являются препараты, превращающие часть гемоглобина в МеtHb (мет. синь, амилнитрит).
Нарушение способности крови транспортировать О2 при метгемоглобинемии зависит от соотношения гемоглобина и метгемоглобина. Легкая степень метгемоглобинемии клинических последствий не имеет, исключая несущественный косметический дефект - легкая цианотичность.
6. Гетерогенность гемоглобина
Различают 3 типа гетерогенности: 1) эмбриональная, 2) обусловленная наличием минорных Hb, 3) генетическая.
1) Эмбриональная. В эритроцитах плода наибольшую часть составляет фетальный гемоглобин HbF. У него две α цепи как у Hb A и две γ цепи, -α2γ2 . γ цепи отличаются от β цепей иной последовательностью 37 аминокислот. Сродство к О2 у HbF значительно выше, чем у HbА. Поэтому HbF обеспечивает доставку О2 эмбриону из системы кровообращения матери. После рождения HbF начинает исчезать и через 4-6 месяцев не обнаруживается.
2)В эритроцитах взрослого кроме основного HbА1α2β2 имеются минорные гемоглобины, составляющие 5-10% от общего количества гемоглобина:
а) HbА2 составляет 2,5%, имеет 2α и 2δ (дельта) цепи α2δ2. δ цепи отличаются от β цепей последовательностью 10 аминокислот.
б) HbА1b - 3-6%, HbА1c - 1%, образуются в результате глюкозилирования N концевых остатков валина β цепей. При диабете количество этих гемоглобинов повышается.
3)Генетическая гетерогенность связана с точечными мутациями
водном из генов, кодирующих синтез α,β,γ или δ цепей. Выявлено 300 вариантов гемоглобина, они называются аномальные Hb.
7. Гемоглобинопатии
Структурные аномалии гемоглобина, приводящие к клиническим признакам болезни, называют гемоглобинопатии. При этом изменяется
506
одно из 3-х свойств нормального Hb: 1) растворимость, 2) сродство к О2 , 3) устойчивость к денатурации.
1) Изменение растворимости наблюдается при серп овидноклеточной анемии. Эритроциты содержат HbS, у которого в β цепи в 6- ом положении вместо глутамата расположен валин. Такое замещение полярной боковой цепи на неполярную, приводит к резкому понижению растворимости дезоксигемоглобина S. В результате образуется волокнистый осадок, который деформирует эритроцит, придавая ему форму серпа. Такие эритроциты быстро разрушаются, возникает гемолитическая анемия. Анемия возникает только у гомозигот, у гетерозигот - бессимптомно. Эта мутация имела приспособительное значение и была распространена в зонах малярии. Люди с такими генами значительно меньше подвержены малярии, так как в серповидных эритроцитах условия для развития малярийного плазмодия не благоприятны.
2)Мутации, приводящие к замене аминокислот вблизи гема, вы-
зывают нарушение связывания О2. В Hb М гистидин заменен на тирозин, в результате HbМ стабилизирован в форме MetHb и не способен связывать О2.
3)Замена аминокислот во внутренней части молекулы Hb, приводит к изменению третичной структуры и как следствие к нестабильности молекулы Hb.
8. Синтез гема и глобина, регуляция
Синтез глобина
Цепи α и β глобина синтезируются на полисомах, образованных, как правило, пятью рибосомами. Цепь α освобождается первой, присоединяется к β цепи, еще связанной с рибосомой и отделяет ее, образуя димер αβ. Два димера соединяются в молекулу Hb α 2β2 . Соединение гема с глобином может происходить или в процессе синтеза полипептидный цепей или после окончания синтеза глобина.
Ферменты синтеза гема аллостерически ингибируются гемом и гемоглобином.
Синтез пептидных цепей Hb происходит только в присутствии гема. При низкой концентрации гема синтез глобина замедляется. Отсюда синтез гема и глобина происходит координировано и ни один из этих компонентов не образуется в избыточном или недостаточном количестве.
507
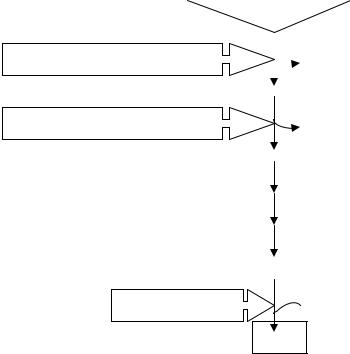
Стероидные гормоны и некоторые лекарства (барбитураты, дикслофенак, сульфаниламиды, эстрогены, прогестины) являются индукторами синтеза аминолевулинатсинтазы.
Глицин + Сукцинил-КоА
δ-Аминолевулинатсинтаза  СО2, HSКоА
СО2, HSКоА
δ-Аминолевулиновая кислота
δ-Аминолевулинатдегидратаза
2Н2
Порфобилиноген
Протопорфирин IX
Феррохелатаза Fe2+
Гем
Синтез гема
В результате генетических дефектов или нарушения регуляции ферментов, участвующих в биосинтезе гема, развиваются порфирии. Первичные порфирии обусловлены генетическими дефектами ферментов синтеза гема, вторичные связаны с нарушениями регуляции реакций синтеза гема. При этих заболеваниях накапливаются промежуточные метаболиты синтеза гемапорфириногены, которые оказывают токсическое действие на нервную систему и вызывают нервнопсихические симптомы. Порфириногены на свету превращаются в nopфирины, которые при взаимодействии с кислородом образуют активные радикалы, повреждающие клетки кожи.
Генетически обусловленное нарушение синтеза одной из нормальных цепей гемоглобина приводит к талассемии. Если угнетается синтез β цепей, развивается β талассемия, α - α талассемия. При β талассемии наряду с HbА1 в крови появляется до 15% HbА2 и резко повышается содержание HbF. Болезнь характеризуется поражением печени, селезенки, разрушением костного мозга, деформацией черепа, тяжелой гемолитической анемией. Талассемия α не совместима с жизнью, так как в каждый Hb входит α цепь.
508
9. Метаболизм эритроцита
Зрелый эритроцит млекопитающих не содержит клеточных органелл, поэтому для него характерен упрощенный метаболизм, предназначенный для сохранения структуры мембраны и стромы эритроцита, и предотвращения окисления Fe в гемоглобине.
Для реконструкции мембраны используются белки и липиды плазмы – происходит обмен между эритроцитами и окружающей их плазмой.
Жизнеспособность эритроцита определяется двумя метаболическими путями: анаэробным гликолизом и пентозофосфатным.
Примерно 90% глюкозы в эритроцитах распадается в процессе гликолиза и 10% - в пентозофосфатном пути. Потребление О2 эритроцитами очень низкое и связано преимущественно с окислением гемоглобина в метгемоглобин. Образующийся в ходе этой реакции супероксидный ион О2• - удаляется супероксиддисмутазой, которая очень активна в цитозоле эритроцита.
Энергия гликолиза обеспечивает работу Na+ K+ AТФ-азы, блокада гликолиза приводит к выравниванию трансмембранного потенциала и гибели эритроцита. Особенностью гликолиза в эритроцитах является наличие шунта, приводящего к образованию 2,3-дифосфоглицерата.
3-фосфоглицериновый альдегид
мутаза
1,3-дифосфоглицерат |
|
2,3-дифосфоглицерат |
||
|
||||
|
|
|||
3 |
|
фосфоглицерат |
фосфатаза |
|
|
||||
2,3-дифосфоглицерат является одним из регуляторов переноса О2. Он связывается с гемоглобином и уменьшает сродство его к О2, таким образом облегчается освобождение О2 из эритроцитов в тканях.
Активно используется глюкоза в эритроцитах и по пентозофосфатному пути. Образующиеся при этом НАДФН2 используется в защитных восстановительных системах, например, для восстановления глутатиона. Восстановленный глутатион используется: 1) для поддержания в восстановленной форме цистеиновых остатков белков, 2) в процессах детоксикации, 3) предотвращает Fe в гемоглобине от окисления. При наследственных заболеваниях, когда активность ферментов ПФП снижена, наблюдается патологический гемолиз и развитие анемии.
Высокое содержание кислорода в эритроцитах вызывает повышение скорости образования супероксидного анион-радикала, Н2О2
(пероксида водорода) и ОН (гидроксил-радикала).
509
Постоянным источником активных форм кислорода в эритроцитах является неферментативное окисление гемоглобина:
Нb(Fе2+) + О2 → МетНb(Fе3+) + О2–
Активные формы кислорода могут вызвать гемолиз эритроцитов. Эритроциты содержат ферментную систему, предотвращающую токсическое действие радикалов кислорода и разрушение мембран эритроцитов. Гликолиз обеспечивает синтез АТФ и восстановление НАД. ATФ необходим для работы ионных насосов. НАДН является коферментом метгемоглобинредуктазы, катализирующей восстановление метгемоглобина до гемоглобина. Супероксидный анион супероксиддисмутазой превращается в пероксид водорода, который под действием глутатионпероксидазы или каталазы превращается в Н2О и О2. Донором водорода для глутатионпероксидазы является восстановленный глутатион (GSH). Окисленный глутатион (GSSG) восстанавливается ферментом глутатионредуктазой, кофермент которого НАДФН образуется в пентозофосфатном пути катаболизма глюкозы.
HbFe2+
дезокси Hb
О2 |
НАД |
метгемоглобинре- |
|
дуктаза |
|||
Hb(Fe2+)О2 |
НАДН |
Hb(Fe3+) |
|
|
|
||
оксиHb |
|
|
метHb |
О2–
Активные формы
кислорода
При генетическом дефекте глюкозо-6-фосфатдегидрогеназы и приеме некоторых лекарств, являющихся сильными окислителями, потенциала глутатионовой защиты может оказаться недостаточно. Это приводит к увеличению содержания в клетках активных форм кислорода, вызывающих окисление SH-групп молекул гемоглобина. Образование дисульфидных связей между протомерами гемоглобина и метгемоглобина приводит к их агрегации –образованию телец Хайнца. Последние способствуют разрушению эритроцитов при попадании их в мелкие капилляры. Активные формы кислорода и сами разрушают мембраны, вызывая перекисное окисление липидов мембран.
Основные механизмы фагоцитоза. В ответ на инфекционные агенты и другие стимуляторы в гранулематозных клетках происходит респираторный взрыв. Он является главным источником супероксидного аниона, Н2О2, гидроксильных радикалов, гипохлорида
510
