
4 курс / Акушерство и гинекология / Копылова_Ю_В_Роль_проангиогенных_и_антиангиогенных_факторов_в_развитии
.pdfсоздание новых сосудов из уже существующих сосудистых структур,
которые в период беременности последовательно отражают формирование сосудистой системы зародыша и плаценты [47,113]. Оба процесса имеют решающее значение, потому что от них зависит эффективная транспортировка кислорода, питательных веществ и выведение продуктов обмена веществ [130].
Васкулогенез и ангиогенез представляют собой сложные процессы,
которые регулируются множеством сигнальных молекул: цитокинами,
ростовыми факторами, а также характером взаимодействия
эндотелиальных клеток друг с другом, компонентами
экстрацеллюлярного матрикса и с клетками микроокружения, такими как макрофаги, гладкомышечные клетки, фибробласты и тучные клетки.
Инициация, развитие и завершение ангиогенеза в плаценте зависит от
баланса проангиогенных и антиангиогенных факторов в
микроокружении эндотелиальных клеток. Особое значение для развития сосудистой сети плаценты и ее нормального функционирования имеют факторы, стимулирующие пролиферацию эндотелиальных клеток и увеличивающие их жизнеспособность. С другой стороны, апоптоз эндотелиальных клеток – физиологический процесс, необходимый для нормального развития сосудистой сети плаценты путем ангиогенеза и ремоделирования сосудов [130]
Сосудистая сеть плаценты обладает пластичностью и динамически изменяется в течение беременности. В ходе васкулогенеза новые капилляры образуются путем миграции и дифференцировки клеток-
предшественников эндотелиальных клеток. Эти процессы находятся под
контролем сосудистых факторов, таких как эндотелиальный фактор
роста (VEGF) и фактор роста фибробластов (bFGF) и их рецепторов
VEGF-R и FGF-R. Установлено, что эндотелиальные клетки экспрессируют рецепторы VEGF-R, в то время как VEGF экспрессируют клетки трофобласта, обеспечивая дифференцировку, миграцию и
31
пролиферацию эндотелиальных клеток, формирование новой сосудистой сети [120,124]. Материнские сосуды трансформируются так,
чтобы обеспечить маточно-плацентарную циркуляцию крови. Инвазия трофобласта происходит глубоко под материнские спиральные артерии,
которые полностью разрушаются, а плацентарный лабиринт представляет собой открытые окончания спиральных артерий.
Дальнейшее формирование сосудистой сети плаценты идет путем ангиогенеза [130].
В эндогенной регуляции ангиогенеза участвуют такие факторы роста, как bFGF, VEGF и PlGF (плацентарный фактор роста).
Основными источниками этих цитокинов в плаценте могут быть как сами эндотелиальные клетки, так и плацентарные макрофаги. VEGF
оказывает ангиогенное действие, стимулируя миграцию, пролиферацию
ипротеолитическую активность эндотелиальных клеток. PlGF
потенцирует пролиферацию стимулирующего действия VEGF, а также увеличивает проницаемость сосудов [124,130].
На поздних стадиях ангиогенеза макрофаги, фибробласты и гладкомышечные клетки секретируют антиангиогенные факторы,
тормозящие миграцию и пролиферацию эндотелиальных клеток, не снижая их жизнеспособности.
Следовательно, для нормального развития и функционирования плаценты важно равновесие между различными механизмами ангиогенеза, а также баланс между процессами ангиогенеза и апоптоза,
которые поддерживаются соотношением проангиогенных и антиангиогенных факторов, секретируемых как самими эндотелиальными клетками, так и клетками микроокружения.
Изменение баланса цитокинов и ростовых факторов в микроокружении эндотелиальных клеток лежит в основе патологических нарушений плацентации, гестации на различных сроках беременности и преждевременных родов [130]. VEGF влияет на развитие новых
32
кровеносных сосудов и выживание незрелых сосудов (сосудистая поддержка), связываясь с двумя близкими по строение мембранными тирозинкиназными рецепторами (рецептор-1 VEGF и рецептор-2 VEGF)
и активируя их. Эти рецепторы экспрессируются клетками эндотелия стенки кровеносных сосудов. Связывание VEGF с этими рецепторами запускает сигнальный каскад, который в конечном итоге стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию.
Эндотелиальные клетки участвуют в таких разнообразных процессах,
как вазоконстрикция и вазодилатация, презентация антигенов, а также служат очень важными элементами всех кровеносных сосудов – как капилляров, так и вен или артерий [120].
Ключевыми факторами, регулирующими ангиогенез гестационного периода, являются сосудисто-эндотелиальный фактор роста (VEGF) и
плацентарный фактор роста (PlGF) [108,117,125].
Семейство VEGF включает несколько групп: А, В, С, D, E.
Существует несколько изоформ VEGF: VEGF165, VEGF180 VEGF183 VEGF145 VEGF206, которые различаются по способности взаимодействовать с компонентами экстрацеллюлярного матрикса и рецепторами клеточной поверхности. Преобладающими изоформами
VEGF являются растворимые VEGF165 и VEGF121, а VEGF 189 и
VEGF206 находятся в связанном состоянии и мобилизируются только в результате протеолиза [112].
VEGF повышает выработку NO и PGI2 (простациклин), вызывая вазодилатацию, антитромботический эффект, снижает адгезию лейкоцитов, обладает противовоспалительными свойствами. Эти данные свидетельствуют о защитных функциях фактора роста [133,126].
VEGF взаимодействует с тремя видами рецепторов тирозинкиназы
— flt-1, flk-1, flt-4 [120,123]. Имеются данные о наличии рецепторов для этого фактора роста только на поверхности эндотелиальных клеток,
33
тогда как рецепторы для большинства других проангиогенных молекул найдены и в других тканях [127,141].
Установлено, что VEGF-А, отвечающий за формирование, рост и агрегацию предшественников эндотелиальных клеток при образовании ангиогенных тяжей, начинает экспрессироваться на ранних сроках беременности. Основными источниками этого фактора являются трофобласт и стромальные макрофаги ворсин. Предположение, что продуцируемый макрофагами ангиогенный фактор роста, каковым является VEGF-А, участвует в васкулогенезе, подтверждает и тот факт,
что макрофаги локально дифференцируются в строме ворсин еще до развития ангиогенных тяжей [110].
Иммуноферментный анализ сыворотки крови беременных женщин показал, что уровень VEGF практически не меняется в течение беременности, но резко возрастает в послеродовом периоде [82]. В свою очередь при иммуногистохимических исследованиях установлено, что экспрессия VEGF-А и его рецепторов наиболее интенсивна на ранних сроках беременности. С течением беременности выраженность их уменьшается. На поздних сроках беременности одной из основных функций VEGF является обеспечение повышенной жизнеспособности эндотелиоцитов и стабилизации сосудистого русла [102].
Плацентарный фактор роста - PlGF, принадлежащий к подсемейству
VEGF, относится к числу контролирующих рост плаценты факторов и обладает выраженными ангиогенными свойствами. PlGF обеспечивает пролиферацию вневорсинчатого трофобласта, при этом не оказывая влияния на процессы его миграции и инвазии. Известно, что в отличие от VEGF, который взаимодействует с разными рецепторами – VEGF-R1, VEGF-R2, PlGF взаимодействует только с рецептором VEGF-R1.
Поэтому при взаимодействии этих проангиогенных факторов с рецепторами наблюдается конкуренция за связь с VEGF-R1. В условиях повышенной секреции VEGF и PlGF это приводит к истощению VEGF-
34
R1 [132]. По данным литературы, PlGF воздействует больше на
процессы ангиогенеза, чем васкулогенеза, однако также отмечается, что
PlGF и VEGF-R1 влияют на мобилизацию мезенхимальных предшественников эндотелиальных клеток, которые участвуют в васкулогенезе [113].
С другой стороны, неотъемлемой частью нормального ангиогенеза является продукция антиангиогенных факторов. В результате молекулярного диалога, возникающего в процессе васкуляризации,
продукция ингибиторов служит сдерживающим фактором для избыточной инвазии клеток трофобласта, а также препятствием для дальнейшего развития сосудистого русла и формирования васкуляризованных участков тканей, подвергшихся патологическим изменениям. Антиангиогенные факторы характеризуются высокой
специфической экспрессией на эндотелии [105].
К антиангиогенным факторам относятся VEGF-R1 (Flt-1), также известный как fms-подобная тирозинкиназа, VEGF-R2 (Flk-1, KDR),
VEGF-R3 (Flt-4) и эндоглин [131]. Растворимые формы этих
рецепторов способны связывать ростовые факторы в циркуляции,
замедляя или блокируя процессы ангиогенеза [105].
sFlt-1 представляет собой растворимую изоформу Flt-1, которая представляет собой трансмембранный рецептор VEGF. Хотя sFlt-1
лишен трансмембранного домена, он содержит лиганд-связывающий участок и способен связывать циркулирующие VEGF и PlGF,
предотвращая связывание фактора роста с трансмембранным рецептором. Таким образом, sFlt-1 обладает антиангиогенным эффектом [81].
Растворимый эндоглин (sEng) является изоформой корецептора трансформирующего фактора роста бета (TGF- β). Так как растворимая изоформа эндоглина содержит TGF- β - связывающий домен, он может связывать циркулирующий TGF-β, соответственно, уменьшать его
35
уровень в плазме крови. TGF- β является проангиогенной молекулой, но при высоком уровне sEng, обладающим антиангиогенным эффектом, он утрачивает свои свойства и инактивируется.
Следовательно, sEng играет важную роль в развитии дисфункции
эндотелия и в патогенезе плацентарной недостаточности [127]. |
|
Растворимые формы сосудистых факторов, участвующие |
в |
процессах васкулогенеза и ангиогенеза, более доступны |
для |
исследования в материнской циркуляции. Изменение содержания их в
крови матери также отражает изменение содержания этих факторов в маточно-плацентарном комплексе. Следовательно, изучение данных факторов в материнском кровотоке имеет особо важное значение для понимания процессов морфогенеза и гистофизиологического развития плаценты, а также прогнозирования происходящих в ней нарушений.
В настоящее время патогенез ПН еще недостаточно изучен. Многие отечественные и зарубежные исследователи отводят важную роль в развитии плацентарной недостаточности дисбалансу проангиогенных и
антиангиогенных факторов [113,133,135].
Ряд исследователей полагают, что в плаценте находится пусковой механизм для возникновения повреждения эндотелиальных клеток
[117]. Исследования показывают, |
что ишемизированная |
плацента |
|
продуцирует различные факторы, |
которые |
способны |
вызвать |
повреждение эндотелиальных клеток. Эти факторы блокируют действие
VEGF и PlGF, что в свою очередь приводит к расстройству функции материнского организма.
Анализ |
литературы показал, что в настоящее время достаточно |
активно ведутся исследования, посвященные влиянию проангиогенных |
|
и антиангиогенных сосудистых факторов на морфогенез плаценты при |
|
нормально протекающей беременности и при различных патологических |
|
состояниях, |
однако отсутствуют фундаментальные работы по |
количественным |
характеристикам |
сосудистых |
факторов |
при |
|
|
|
|
36 |
беременности, осложненной течением плацентарной недостаточности.
Недостаточно сравнительных данных о количественных значениях сосудистых факторов в зависимости от степени тяжести ПН, в
различные сроки гестации.
Таким образом, в настоящее время остаются далеко не до конца изученными положения о влиянии сосудистых факторов роста на развитие различных патологических состояний, отягощающих беременность, и достаточно мало исследований, посвященных особой роли сосудистых факторов в формировании плацентарной недостаточности.
Детальное изучение основ фетоплацентарного ангиогенеза, причин нарушений формирования плаценты и развития плода позволит разработать комплекс мероприятий по ранней диагностике плацентарной недостаточности для своевременного лечения и выбрать оптимальную тактику ведения с целью снижения перинатальной заболеваемости и смертности.
37
Глава II. Материал и методы исследования
2.1Объем и общая структура исследования
Сцелью оценки состояния беременных проведен проспективный анализ течения беременности, родов и постнатальных исходов у 168 женщин с неосложненным течением беременности и с плацентарной недостаточностью, характеризующейся формированием синдрома задержки роста плода в сроки гестации от 28 до 37 недель.
Обследование беременных проводилось в период с 2010 по 2012
год на базе кафедры акушерства и гинекологии лечебного ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России - родильное отделение городской больницы №8, главный врач – к. м. н. Дуленков А.Б.
Критерием включения в исследование были:
1.Возраст пациенток от 18 до 45 лет
2.Беременность в сроке 28-37 недель беременности.
3.Наличие ПН и СЗРП для основной группы.
Критерии исключения пациенток из исследования:
1.Артериальная гипертензия.
2.Сахарный диабет.
3.Системные заболевания соединительной ткани.
4.Пороки сердца.
5.Заболевания крови.
6.Психические заболевания.
7.Пороки развития плода.
8.Многоплодная беременность.
Врезультате проведенной работы все обследуемые беременные были разделены на 2 группы:
38
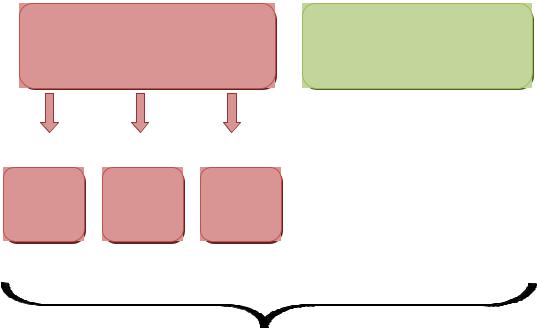
I группу (основную) составили 116 пациенток, беременность которых осложнилась развитием плацентарной недостаточности и синдромом задержки роста плода.
II группу (контрольную) составили 52 соматически здоровые беременные с неотягощенным акушерско-гинекологическим анамнезом и физиологическим течением данной беременности.
I основная группа была разделена на 3 подгруппы в зависимости от степени тяжести СЗРП.
1А подгруппу составили 44 беременных с СЗРП I степени тяжести. 1Б подгруппу составили 38 беременных с СЗРП II степени
тяжести.
1В подгруппу составили 34 беременных с СЗРП III степени.
I Основная группа |
II Контрольная группа |
n=116 |
n=52 |
IА |
IБ |
IВ |
n=44 |
n=38 |
n=34 |
N=168
Рис. 1 Структура обследованных беременных (n=168)
39
Диагноз СЗРП устанавливали при выявлении параметров фетометрии ниже 10-го перцентиля. Степень тяжести СЗРП определяли по отставанию параметров фетометрии от должного гестационного срока. При I степени тяжести СЗРП – отставание на 2 недели, при II – в
пределах 3-4, при III степени - более 4-х недель.
2.2 Клиническая характеристика обследованных беременных
Возраст пациенток в обследуемых группах достоверно не отличался и составил в среднем в основной группе 28,8±1,1 лет с индивидуальными колебаниями от 19 до 38 лет, и в контрольной
29,5 1,2 лет с индивидуальными колебаниями от 20 до 32 лет. Возраст беременных в подгруппах основной группы также достоверно не отличался и составил в среднем в 1А подгруппе 28,5 ±1,5 лет, в 1Б
подгруппе 29,2±1,8 лет и в 1В подгруппе 29,3±2,9 лет.
У 75% (87) пациенток основной группы работа была сидячая и связана с использованием компьютера, по сравнению с 71,2% (37)
пациенток контрольной группы и достоверно не отличалась. Пациентки основной группы были менее социально благополучны: 31,9% (37)
беременных не состояли в браке, по сравнению с контрольной группой,
где в браке не состояли только 13,5% (7) обследованных беременных (p< 0,05). Беременные основной группы достоверно чаще имели вредные привычки, такие, как курение в 28,4%(33) случаев, по сравнению с контрольной группой, где курили 11,5% (6) беременных (p<0,05). В
основной группе 79,3% (92) пациенток имели постоянную работу, а 20,7% (24) были домохозяйками, по сравнению со здоровыми беременными, где 65,4% (34) пациенток были домохозяйками.
При анализе росто-весовых показателей в обследованных группах выявлено достоверное отличие показателей индекса массы тела у беременных основной группы по сравнению с контрольной. Достоверно меньше индекс массы тела был у беременных основной группы -
40
