
razdel_3
.pdf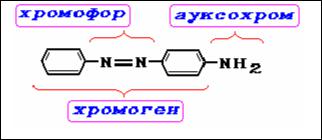
21
некоторые другие. Таким образом, общая схема красителя, согласно хромофорно-ауксохромной теории, выглядит следующим образом:
Хромофорно-ауксохромная теория имела большое значение для развития химии красителей и приведенная терминология употребляется в настоящее время. В дальнейшем эта теория расширялась, дополнялась и в новом виде включает современные представления о взаимодействии света с веществом.
В результате современная теория цветности объясняет цветность органических соединений особым электронным состоянием молекул,
имеющих на одном конце цепочки сопряженных двойных связей электронно-донорные заместители, а на другом - электронно-акцепторные заместители.
2.5. Энергия возбуждения молекул
Согласно современным представлениям, поглощение света в видимой и УФ-областях спектра связано с переходом электронов с нижних энергетических уровней на высшие. Естественно, что такие переходы связаны, в основном, с валентными электронами, которые слабее удерживаются ядром атома и поэтому для их "возбужения" требуется меньшая энергия. Переход электронов с одного энергетического уровня на другой проходит скачкообразным путем при поглощении кванта света:
Мкр + hn → М*кр
где, Мкр - молекула красителя в "нормальном" энергетическом состоянии, hn - квант света; h - постоянная Планка, n - частота колебания света; М*кр –
молекула красителя в возбужденном состоянии. Разность энергий
22
красителя в возбужденном (Е*кр) и исходном состоянии (Екр) называется
энергией возбуждения:
E = E*кр - Eкр = hn
Так как n = С / λ, уравнение энергии возбуждения можно переписать следующим образом:
E = hn = h С / λ ,
где С - скорость света. Чтобы рассчитать энергию возбуждения в пересчете на моль вещества, в уравнение нужно ввести число Авогадро
(N = 6,02х1023 1/моль):
E = hn = h С N / λ
Например, энергия возбуждения молекул при их взаимодействии со светом в видимой области спектра, т.е. в диапазоне длины волн 400-760
нм равна:
E
E
E
400 нм
500 нм
760 нм
=300 кДж/ моль
=240 кДж/ моль
=158 кДж/ моль
Таким образом, способностью избирательно поглощать свет в видимой области спектра, и соответственно, обладать окраской могут только те
вещества, для |
которых переход в возбужденное состояние возможен при |
поглощении |
энергии вдиапазоне 158 кДж/моль - 300 кДж/моль. |
Например, краситель родамин 6G в воде в димерной форме поглощает свет
при длине волны 500 нм, |
т.е. энергия возбужения молекулы этого |
|
красителя |
равна 240 кДж/моль. |
Димер профлавина в воде поглощает свет |
при длине |
волны 425 нм, в этом случае энергия возбуждения будет равна |
|
282кДж/моль.
Сдругой стороны, зная энергию возбуждения молекулы красителя,
можно рассчитать значение |
максимума |
поглощения молекулы |
этого |
|||
красителя. Например, |
D Е |
для перилена |
равна 278 |
кДж/моль, что |
||
соответствует максимуму поглощения |
этого |
соединения |
при |
432 нм. |
||
Таким образом, раствор перилена имеет желтый цвет. |
|
|
||||

23
2.6.Структура молекул и цветность
2.6.1.Сопряженные двойные связи в молекулах и цветность
Как |
известно, молекулы |
органических соединений |
могут |
иметь δ-, |
|||||
p- и n-электроны. δ -электроны образованы около атомов в |
молекулах, |
||||||||
связанных насыщенными связями, |
например, в |
связях |
насыщенных |
||||||
углеводородов: |
-С-Н, -С-С- |
и |
DЕ |
для перехода их |
в возбужденное |
||||
состояние |
составляет более |
800 |
кДж/моль, что соответствует энергии |
||||||
фотонов |
дальней |
ультрафиолетовой части спектра |
- 150 нм. В |
связи с |
|||||
этим насыщенные углеводороды |
представляют бесцветные соединения, а |
||||||||
максимумы их спектров поглощения находятся в УФ области спектра.
Вненасыщенных углеводородах двойная связь образована p-
электронами. Эти электроны более подвижны, легче переходят в возбужденное состояние и, таким образом, требуют кванты энергии для возбуждения с энергией, соизмеримой с энергией квантов видимой части спектра.
Наличие небольшого числа несопряженных двойных связей, однако,
недостаточно для перевода молекулы в возбужденное состояние под действием квантов видимой области спектра. Сопряжение двойных связей повышает подвижность p -электронов и чем длиннее цепочка двойных связей, тем p-электроны подвижнее. Для примера можно привести значения
DЕ в ряду ненасыщенных алифатических углеводородов:
Дальнейшее удлинение сопряженных двойных связей сдвигает максимум поглощения в длинноволновую часть спектра. Например, ликопен -
пигмент томатов, имеет одиннадцать сопряженных связей и,

24
соответственно, для возбуждения этого соединения требуется DЕ = 237
кДж/моль, что соответствует максимуму поглощения 506 нм.
Замкнутые сопряженные двойные связи часто встречаются в красителях и увеличение числа таких ароматических колец в молекуле приводит к уменьшению энергии возбуждения. Несколько примеров значенийDЕ и
соответствующих параметров бензола и некоторых полициклических соединений приведены на следующей схеме:
Таким |
образом, |
наличие |
в |
молекулах |
органических |
соединений |
|
|||
линейных |
или |
циклических |
цепочек |
сопряженных |
двойных |
св |
||||
уменьшает энергию возбуждения и |
сдвигает |
максимум поглощения |
света |
|
||||||
в их спектрах поглощения в длинноволновую часть спектра, |
т.е. |
приводит |
|
|||||||
к углублению цвета (батохромный сдвиг). |
|
|
|
|
|
|
||||
|
2.6.2. Поляризующие группы |
|
|
|
|
|
|
|||
Молекулы органических соединений могут содержать атомы |
с n- |
|
||||||||
электронами, которые не участвуют в связях между атомами. Эти |
|
|||||||||
неподеленные электроны возбуждаются квантами УФ-области спектра и, |
|
|||||||||
таким образом, не являются хромоформными структурами красителей. |
|
|||||||||
Однако |
такие группы с n-электронами, находясь в структуре красителя, |
|
||||||||
могут оказывать |
поляризующее |
действие |
на |
группы p-электронамис, |
|
|||||
вызывая |
их смещение и, |
таким образом, |
влиять на |
цветность |
|
|||||
красителя. |
Эти поляризующие |
группы, в зависимости от |
влияния на p- |
|
||||||

25
электроны, могут обладать электронно-донорными (ДЭ) свойствами -
"отталкивать" электроны или электронно-акцепторными (АЭ) свойствами
-"притягивать" электроны.
КДЭ относятся группы: -ОН, -NH2, -NHCH3, -N(CH3)2, -OCH3, -SH
и другие замещенные амино-, окси- и меркаптогруппы. В группу АЭ
можно отнести группы -NO2, -N=O, >C=O, -CНО, -CООН, >C=NH и
другие.
Особенно |
сильное |
влияние |
на цветность красителей |
оказывает |
||||
одновременное |
присоединение |
ДЭ |
иАЭ к противоположным концам |
|||||
цепочки сопряженных |
двойных |
|
связей. При |
этом |
АЭ-группы, |
|||
притягивающие электроны, образуют |
частичный отрицательный заряд, а |
|||||||
ДЭ-группы, соответственно, частичный положительный заряд: |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таким образом, поляризация молекул красителя приводит к батохромному
сдвигу цвета красителя и увеличению интенсивности окраски соединения
красителя.
Ионизация ДЭ- и АЭ-групп в молекулах красителя приводит к
батохромному или гипсохромному сдвигу при взаимодействии света с
красителем. Наибольшее значение в |
этом случае имеют ионизация ДЭ- |
||||
групп |
- гидроксильной |
группы |
(-ОН), |
аминогруппы |
(-NH2), |
меркаптогруппы (-SH) и АЭ-групп |
- карбонильной группы |
>C=O и |
|||
хинониминной группы >C=NH. |
|
|
|
||
Например, ионизация гидроксильной группы, происходящая в |
|||||
щелочной |
среде, приводит |
к появлению |
дополнительной |
пары n- |
|
электронов, в связи с чем группа приобретает отрицательный заряд, и
усиливается ее "электроннодонорность (а), а ионизация |
аминогруппы |
происходит в кислой среде и заключается в присоединении |
протона к |
атому азота и появлению положительного заряда (б): |
|

26
Как видно, неподеленная пара электронов у атома азотаисчезает,
используется на связь с протоном и, в результате, аминогруппа перестает быть донором электронов.
Таким образом, ионизация ДЭ-групп может привести к усилению или исчезновению их электрондонорных свойств.
Ионизация АЭ-групп (>C=O, >C=NH) также может происходить в кислой среде и приводить к присоединению протона к атому кислорода или азота:
Такая ионизация приводит к усилению электронакцепторных свойств, и
соответственно, к батохромному сдвигу цвета красителя. Таким образом,
ионизация ДЭ-групп, приводящая к усилению электрондонорности,
ионизация АЭ-групп, приводящая к усилению электронакцепторности,
приводит к батохромному сдвигу.
Противоположное действие ионизации на ДЭ- и АЭ-группы приводит к гипсохромному сдвигу.
2.6.3. Копланарность молекул красителя Копланарность молекулы (расположение атомов в одной плоскости)
облегчает смещение p-электронов по цепочке сопряженных двойных связей. Нарушение копланарности молекулы затрудняет взаимодействие p-
электронов в цепи сопряженных связей и приводит к гипсохромному сдвигу в спектре поглощения этой молекулы.

27
Чаще всего копланарность молекулы нарушается вследствие свободного вращения отдельных частей молекул вокруг-С-С - связи.
Например, в молекуле бинафтила возможен поворот двух нафталиновых ядер вокруг связи-С-С-, что нарушает сопряжениеp-электронов ароматических ядер и поэтому бинафтилбесцветное соединение. В
отличие от бинафтила в молекуле перилена вторая связь -С-С-
стабилизирует молекулу от поворота нафталиновых колец, поэтому молекула перилена имеет плоскую форму, и это соединение имеет желтый цвет (а):
Свободное вращение вокруг δ-связи -С-N= затруднительно, если атом углерода принадлежит ароматическому кольцу, а атом азота имеет неподеленную пару электронов. Взаимодействие этой пары электронов с π-электронами ароматического кольца затрудняет вращение вокруг -C-N=
связи, и поэтому молекулы, в которых ароматические кольца соединены азогруппами, как правило, планарны и окрашены. Фрагмент структуры таких молекул приведен на рисунке (б).
2.7. Комплексообразование с металлами
Если в молекулу красителя вводится атом металла может происходить углубление цвета (батохромный сдвиг). В качестве комплексообразователей используются металлы: хром, кобальт, никель, медь, железо, т.е. металлы,
атомы которых имеют вакантныеd-орбитали и являются хорошими

28
акцепторами электронов. В молекуле красителя атом металла (М) входит в устойчивый пятиили шестичленный цикл:
Атом металла, связываясь с кислородом оксигруппы или азотом |
||||||||
аминогруппы, |
замещает |
при |
этом |
атом водорода, а с |
кислородом |
|||
карбонильной |
группы |
образует |
координационную |
(донорно- |
||||
акцепторную) |
связь, т.е. |
образуется комплексное соединение. |
В |
|||||
образовавшемся комплексном соединении, |
в |
зависимости |
от |
|||||
комплексообразователя, |
электронная |
оболочка |
|
металла |
влияет |
на |
||
сопряженную |
систему |
двойных связей в |
молекуле |
красителя, таким |
||||
образом, приводит к батохромному сдвигу цвета |
красителя. |
Например, |
|||||||
краситель 1-нитрозо-2-нафтол при образовании комплексного соединения с |
|||||||||
Fe |
меняет |
оранжево-желтый |
цвет |
на |
зеленый, а |
в |
случае |
||
комплексообразования с Cr - до оливкового цвета: |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если при комплексообразовании не происходит изменений электронных оболочек атомов, входящих в краситель, то батохромный сдвиг не наблюдается. Например, красители, производные салициловой кислоты,
образуют комплексное соединение с металлами за счет неподеленных электронов кислорода карбоксильной группы, что не влияет на главную
29
систему сопряженных связей. В этом случае изменения окраски красителя не наблюдается.
2.8. Классификация красителей
Техническая классификация красителей основана на методах их применения, в основном, в текстильной промышленности: красители для натуральных волокон (кубовые, протравные, кислотные, основные и т.д.), красители для химических волокон, красители для нетканных материалов и т.д.
Другой принцип классификации основан на химической структуре красителей. Согласно этой классификации все красители можно подразделить на следующие основные классы:
1. Нитрокрасители. Содержат поляризующий электроноакцепторный заместитель - нитрогруппу (-NO2).
2.Нитрозокрасители - к цепочке сопряженных двойных связей присоединена нитрозогруппа (-NO), играющая роль электроноакцепторного заместителя.
3.Азокрасители - в цепочке двойных сопряженных связей имеется одна или несколько азогрупп (-N=N-). В зависимости от числа азогрупп в классе азокрасителей имеются моно-, ди- и полиазокрасители).
4.Арилметановые красители - хромоформная система арилметановых красителей содержит центральный атом углерода и цепочки двойных сопряженных связей в виде нескольких ароматических колец, на которых находятся электронно-донорные(ДЭ) и электронно-
акцепторные (АЭ) заместители: ДЭ-Аr-СR=Ar'=АЭ.

30
5.Ариламиновые красители имеют общую формулу: ДЭ-Аr-
N=Ar'=АЭ.
6.Сернистые красители - включают различные органические соединения, в молекулы которых входит сера в составе гетероциклов.
7.Индигоидные красители - включают индиго, тиоиндиго и их производные.
8.Антрахиноновые красители - красители, производные антрахинона.
9. Кубовые полициклические красители содержат в своей структуре несколько ароматических циклов и не менее двух карбонильных групп,
углеродные атомы которых принадлежат ароматическим структурам.
10. Фталоцианиновые красители состоят из молекул, образованных четырьмя остатками пиррола, связанных атомами азота:
