
razdel_2
.pdf
1
ОСНОВЫ ГИСТОХИМИИ
Раздел 2. Микротехника
С О Д Е Р Ж А Н И Е
(используйте гипертекст)
Глава 1. Фиксация тканей
1. Химическая фиксация (общие положения)
1.1. Альдегиды
1.2. Соли неорганических кислот 1.2.1. Хромовая кислота и ее соли 1.2.2. Соли ртути 1.2.3. Четырехокись осмия
1.3. Органические кислоты
1.3.1. Пикриновая кислота
1.3.2. Сульфосалициловая кислота
1.3.3. Трихлоруксусная кислота
1.4. Спирты
1.5. Ацетон
1.6. Фиксирующие смеси
Глава 2. Физические методы фиксации 2.1. Замораживание образцов ткани
2.1.1. Процесс кристаллизации воды в тканях при низких температурах
2.1.2. Криометоды. Прямое замораживание ткани до T = -10 - -20° С (без дегидратации)
2.1.3. Криометоды. Глубокое замораживание ткани до T = -78 - -196°С (без дегидратации)
2.1.4. Твердая углекислота. Жидкий азот 2.2. Сублимационная дегидратация тканей

2
2.2.1. Теоретические основы сублимационной сушки 2.2.2. Уровень вакуума в сушильной камере 2.2.3. Температурный режим сублимации 2.2.4. Сопротивление высушенного слоя 2.2.5. Определение конца сушки 2.2.6. Обработка лиофилизированной ткани
2.2.7. Артефакты, возникающие при сублимационно сушке тканей
2.2.8. Аппараты для лиофильной сушки ткани для гистохимического анализа
2.2.9. Лиофилизация растительной ткани
2.3. Замещение в замороженном состоянии Глава 3. Микротомия тканей
Общие положения 3.1. Приготовление блоков ткани для микротомии
3.1.1. Парафин
3.1.2. Целлоидин
3.2. Микротомы 3.2.1. Микротомы для пропитанной ткани
3.2.2. Ножи для микротомов 3.2.3. Микротомы для замороженной ткани 3.2.4. Криостат 3.2.5. Резаки, Вибратомы
3. 3. Манипуляции со срезами 3.3.1. Подготовка предметных и покровных стекол
3.3.2. Автоматы для гистологической обработки Контрольные вопросы Рекомендуемая литература

3
Глава 1. Фиксация тканей
Общие положения
Практическое осуществление гистохимических методов обычно состоит из двух операций: 1) приготовление тонкого среза тканей (или других типов цитологических и гистологических препаратов: мазки,
отпечатки и др.); 2) проведение гистохимической реакции в соответствии с поставленной задачей и анализ полученных препаратов.
Однако уже |
на первой стадии возникает |
ряд проблем, преодоление |
которых требует |
специальных дополнительных |
операций. Как известно, |
ткани животных |
(и растений) содержат около 80-90% воды и обладают |
|
такими |
вязко-эластичными |
свойствами, |
которые |
не |
позволяют без |
|
специальной дополнительной обработки, непосредственно |
из нативной |
|||||
ткани, |
сделать |
тонкие |
срезы ткани, |
годные |
для |
проведения |
гистохимической реакции и последующего микроскопического анализа.
(Тонкими срезами для цитологических (цитохимических) исследований обычно называются срезы толщиной 2-5 мкм; для гистологических исследований и проведения гистохимических реакций - 5 - 25 мкм)
Другая проблема связана с тем, что после умерщвления животных и извлечения ткани из организма в ткани продолжаются различные биохимические процессы, приводящие к нарушению морфологической и биохимической структуры, характерные для нативного состояния. Эти,
так называемые, постмортальные изменения, приводят к необратимым артефактам. Таким образом, на первом этапе гистохимической процедуры необходимо осуществить максимально быструю остановку биохимических процессов для уменьшения постмортальных изменений и изменения вязко-
упругих свойств ткани таким образом, чтобы было возможно изготовить тонкие срезы.
|
|
4 |
Для решения этих |
задач и подготовки образца нативной ткани для |
|
изготовления |
срезов |
(КРИОТОМИЯ ТКАНЕЙ) используются |
специальные операции - ФИКСАЦИЯ (химическая фиксация и фиксация с
использованием физических методовкриометоды, вакуумная
сублимационная сушка и др.) и ЗАЛИВКА фиксированного материала в
твердые материалы (парафин, полимерные смолы). |
|
Кроме этого, имеется ряд методов прямого изготовления |
срезов из |
замороженной ткани без предварительной химической |
фиксации |
образцов. |
|
1. Химическая фиксация (общие положения)
Химическая фиксация связана с использованием специальных
химических фиксаторов - соединений, приводящих к быстрой остановке биохимических процессов в тканях и клетках, после извлечения их из организмов и органов. Несомненно, что химические фиксаторы приводят к
определенным изменениям химического строения |
и |
химических |
свойств некоторых эндогенных химических субстратов клеток и тканей. |
||
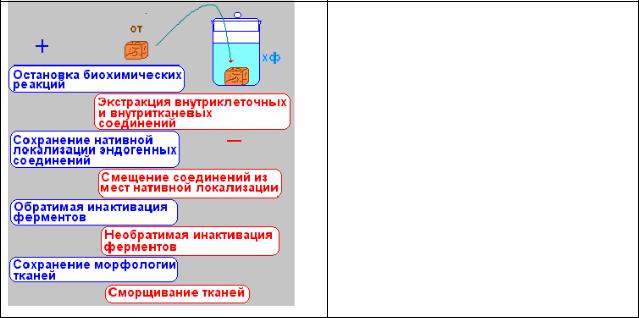
К химическим фиксаторам предъявляются три |
основные требования |
|
(рис.1): |
|
|
Рис.1. Схема химической фиксации (синим цветом выделены достоинства химической фиксации, красным цветом – возможные причины артефактов)
5
· прежде всего, фиксаторы не должны разрушать морфологическое
строение клеток и тканей;
·фиксаторы должны быстро проникать в ткань за счет диффузии и иметь высокую скорость взаимодействия с внутриклеточными и внутритканевыми соединениями;
· фиксаторы |
|
должны |
приводить |
к |
обратимым |
химиче |
|||
изменениям |
внутриклеточных |
и |
внутритканевых |
|
эндогенных |
||||
соединений, или к необратимым |
изменениям, которые, |
однако, не |
|||||||
влияют |
на |
качественные |
иколичественные |
параметры |
|||||
последующей гистохимической реакции. |
|
|
|
|
|
||||
В качестве химических фиксаторов используются альдегиды, |
кислоты, |
||||||||
соли неорганических кислот, спирты и другие соединения.
1.1. Альдегиды
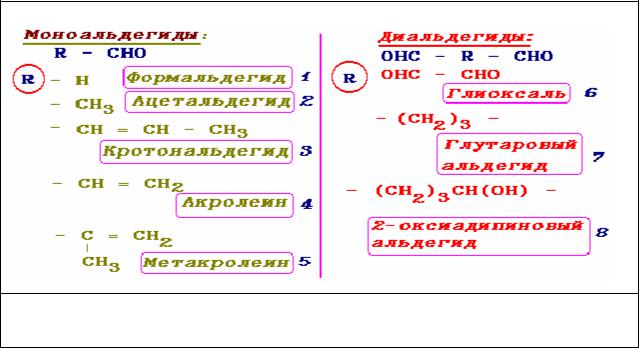
На рис. 2 приведены основные моно- и диальдегиды, используемые в качестве химических фиксаторов:
Рис. 2. Структура некоторых альдегидов – химических фиксаторов. 1 – 5 - моноальдегиды, 6 – 8 - диальдегиды
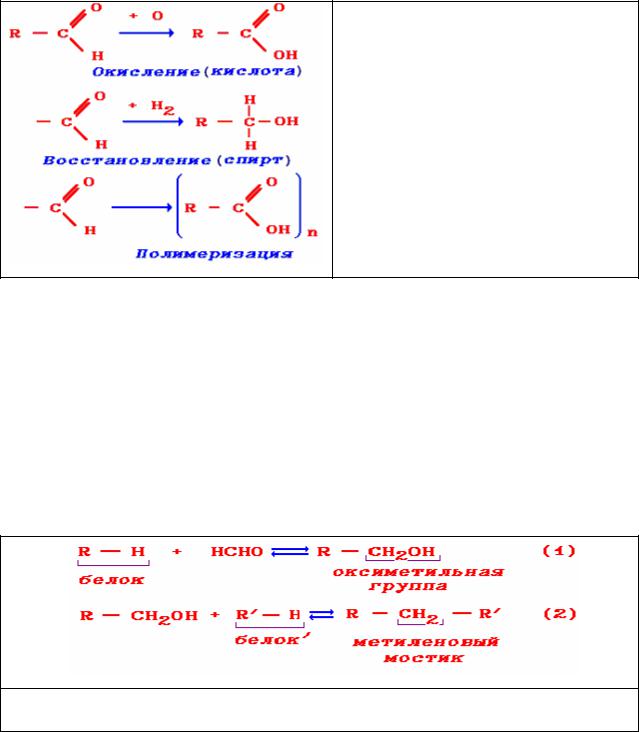
Из общих свойств альдегидов, нарушающих фиксирующие свойства,
необходимо отметить их окисление до кислот, восстановление до спиртов и полимеризацию (рис.3):
6
Рис.3. Основные реакции альдегидов
Фиксирующие действия альдегидов связаны, главным образом, с их
реакцией |
с |
тканевыми |
белками. |
Например, |
формальдегид |
вступает в |
реакцию |
с |
активным |
атомом |
водорода |
белков с |
образованием |
метиленового мостика. Реакция протекает в две стадии(рис.4): 1 стадия – образование промежуточного оксиметильного соединения, 2 – образование метиленового мостика между двумя молекулами белка:
Рис.4. Образование метиленовых мостиков при взаимодействии белков с альдегидами
Одним из самых распространенных химических фиксаторов являются растворы, приготовленные на основе формалина - 40% раствора формальдегида в воде.
Формальдегид - газ с резким запахом, растворим в воде. Насыщенный раствор формальдегида в воде называется формалином. При хранении в растворе формальдегид полимеризуется до плохо растворимого в воде

7
осадка белого цвета - параформа (параформ выпускается в виде тонкодисперсного белого порошка с сильным запахом формалина):
Реакции тканевых белков с глутаральдегидом, очень распространенным фиксатором, особенно для электронной микроскопии недостаточно изучены. Предположительно фиксирующей способностью обладают олигомеры глутаральдегида, которые образуются в результате его полимеризации в концентрированных растворах. В результате такой полимеризации возникает молекула фиксатора, максимальная последовательность которой содержит 5 атомов углерода, соединяющая
("сшивающая") три молекулы белка.
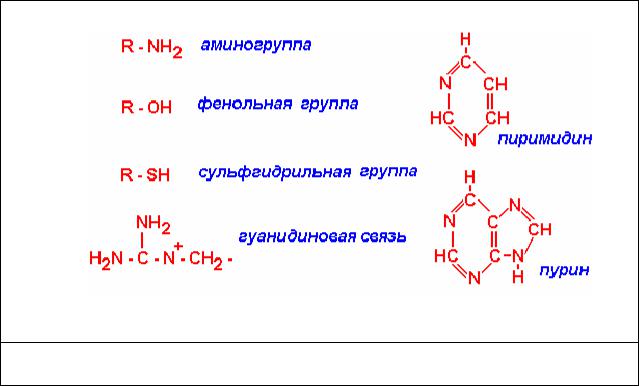
Как упоминалось выше, альдегиды, в основном, вступают в реакцию с активным водородом аминогруппы белков, сульфгидрильных связей,
гуаниновых и фенольных групп (рис. 5).
Реакции альдегидов с нуклеопротеидами связаны с их взаимодействием с пиримидиновыми, пуриновыми основаниями и с белковыми компонентами
(рис.6). С липидами формальдегид не взаимодействует, кроме фосфатидилэтаноламина. С углеводами формальдегид и другие альдегиды не реагируют. Стабилизация гликогена в тканях связана с влиянием альдегидов на белки, окружающие гликоген.
8
Рис.5. Основные химические группы и соединения, с которыми взаимодействуют альдегиды
Акролеин и кротональдегид содержат в своей молекуле этиленовую
группу, которая более реакционноспособна, однако, "сильная" фиксация
тканевых белков для гистохимических реакций менее предпочтительна, чем мягкая фиксация формальдегидом и глутаральдегидом.
Ацетальдегид и 2-оксиадипинальдегид - облают слабыми
фиксирующими свойствами и плохо сохраняют морфологическую структуру ткани и поэтому редко используются как химические фиксаторы. Так как 2-
оксиадипинальдегид |
лишь |
незначительно инактивирует |
некоторые |
ферменты, этот альдегид иногда используется в гистохимии ферментов. |
|||
Метиленовый мостик, образованный формальдегидом с |
молекулами |
||
белка, может разрываться |
(гидролизоваться), для чего |
требуется |
|
тщательная (длительная) промывка водой (рис.6).
9
Рис.6. Гидролиз метиленовых мостиков
Такие |
альдегиды, как |
глутаральдегид и акролеин вызывают более |
|||
"крепкие" |
сшивки белковых молекул, что |
может |
приводить |
к |
|
ингибированию активности |
многих ферментов. |
Поэтому |
формальдегид, |
||
ацетальдегид, оксиадипинальдегид являются более предпочтительными при
гистохимическом изучении ферментов.
Температура, длительность фиксации и концентрация альдегида не имеют большого значения для сохранности тонких структур и активности многих внутриклеточных соединений. Однако для гистохимического
анализа необходимо стремиться к уменьшению времени фиксации и предпочтительно проводить фиксацию при низкой температуре (+4 С).
Скорость диффузии альдегидов в ткань снижается в ряду: акролеин>
формальдегид>оксиадипинальдегид. В связи с этим необходимо стремиться
выбирать для фиксации образцы тканей меньшего |
размера |
(стремиться к |
уменьшению толщины тканевого образца). Иногда |
можно |
использовать |
смесь альдегидов: например, медленно проникающий глутаральдегид |
||
использовать в смеси с формальдегидом или акролеином и т.д.
Фиксация альдегидами обычно осуществляется путем погружения
образца ткани в |
растворы альдегидов(1, Рис. |
7); путем внутрисосудистой |
|
перфузии органа |
раствором фиксатора |
перед |
выделением образца ткани |
(2, Рис.7); в парах альдегидов при |
определенной влажности (3, Рис.7) |
||
(данный способ |
особенно часто используется в случае лиофилизированных |
||
тканей, см. ниже). |
|
|
|

10
Рис. 7. Методы использования альдегидов в качестве фиксаторов. 1 – погружение, 2 – перфузия, 3 – фиксация в парах.
Обозначения: ф – фиксатор, а – кусочки тканей, т – перфузируемый орган, к – контейнер с тканевыми образцами, п - параформ
Для поддержания рН фиксирующих растворов альдегидов на
физиологическом уровне (рН = 7,4 - 7,6) обычно используются
кокодилатный или фосфатный буферы. В сильно щелочных растворах
фиксатора возможна реакция Канницаро, в результате которой из
альдегидов образуются спирты и кислоты. Веронал-ацетатный буфер Михаэлиса и трисбуфер взаимодействуют с альдегидами и поэтому их
нельзя использовать для приготовления альдегидных фиксаторов.
При хранении водных растворов альдегидов в них образуются кислоты
(например, в формалине - муравьиная кислота), поэтому необходима
предварительная |
обработка |
исходных растворов |
альдегидов |
перед |
приготовлением из них фиксирующих растворов (нейтрализация кислот,
перегонка в вакууме, встряхивание с активированным углем, пропускание
через колонку с сефадексом G-10 и др.).
1.2.Соли неорганических кислот
1.2.1.Хромовая кислота и ее соли
Хромовая кислота образуется при взаимодействии хромового ангидрида с водой:
