
razdel_2
.pdf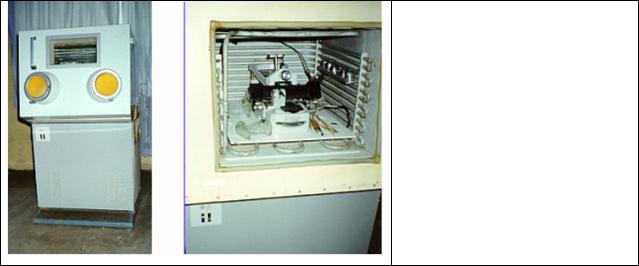
51
котором мне и моим коллегам удалосьработать много лет. На рис. 41
слева показан внешний вид криостата МК-20, а справа - вид холодильной камеры этого криостата, в которой находится специальный«качающийся микротом».
Рис.41. Криостат МК-20
Из зарубежных криостатов можно привести замечательный приборJung Cryocut 1800 (фирма Лейка), позволяющий изготавливать срезы толщиной 1- 6- мкм при температуре до -35 °С . Другой криостат этой же фирмыFrigocut 2800 оснащен двумя измерителями температурытемпературы камеры криостата и отдельного измерителя температуры образцов, что очень важно
при приготовлении качественных срезов. В нашем |
криостате -МК20 |
измеряется только температура камеры криостата |
и работающий на |
криостате должен внимательно следить за качеством резки: как только ткань
становиться более «мягкой» или начинает сильно сморщиваться на ноже, это значит, что температура ткани «поднялась» - необходимо сделать небольшой перерыв для «охлаждения» ткани (слова «поднялась» и «охлаждение» взяты
в кавычки, т.к. температура ткани |
все равно осталась |
в минусовом |
диапазоне). Температура ткани выше -7 |
- -8°С не дает возможности делать |
|
качественные срезы. Поэтому раздельное измерение и контроль температуры |
||
камеры и образца ткани выгодно отличает криостатFrigocut 2800 |
от других |
|
приборов. На этом криостате можно получать срезы толщиной0.5 - 60 мкм при температуре камеры до-40 °С (0.5 мкм - это очень тонкий срез!!! и не каждому криостату это под силу).

52
Рис.42. Два |
криостата |
фирмы «Цейсс». Слева - HM |
|
500M и справа - НМ 505Е |
|
Фирма «Микром», входящая в группу предприятий фирмы «Карл Цейсс» производит ряд микротомов и криостатов. Две модели криостатов этой фирмы показаны на рис. 42.
Криостат НМ 500 О обеспечен устройством для точного и безопасного !
(все операции около открытого ножа в криостате, как, например, в криостате МК-20, опасны и требуют повышенного внимания) подведения ножа к образцу ткани, температура камеры до -40 °С, толщина срезов в диапазоне
0.5 - 300 мкм (модификация данного криостата НМ500 О обеспечивает быстрое замораживание ткани и регулярное его охлаждение в диапазоне -5 - - 55 °С, модификация НМ 500 М имеет электрический привод резки, а модель НМ 500 ОМ имеет элементы приведенных двух модификаций криостата).
Криостат НМ 505 Е представляет удобный, компактный прибор с легко очищаемой камерой, в которой поддерживается температура до -35 °С ,
имеется автоматическая микро-макроподача ножа при изготовлении срезов толщиной от 1 до 500 мкм. Держатель ножа этого криостата позволяет, кроме использования обычных стандартных ножей, применять одноразовые лезвия и одноразовые лезвия из магнитного материала.
Как правило, все современные криостаты снабжены так называемыми
«антироллерными» устройствами, предотвращающими скручивание срезов во время резки, что позволяет получать качественные и серийные срезы
«легко» и надежно (вообще работа на криостатах, даже самых современных,
занятие сложное и требует усидчивости, внимания и тренировки).

53
3.2.5. Резаки, Вибратомы
Из образцов нативной ткани или после их химической фиксации, но
без заливки в специальные пропитывающие материалы, можно
приготовить |
срезы тканей толщиной |
выше25 микрон при |
помощи |
|
специальных |
микротомоврезаков и |
вибратомов. |
Например, |
на |
вибратомах фирмы "Lancer" (США, рис.43) или вибратоме Vibroslice - фирм
Campden Instruments (Англия) и Labortehnik (Германия) (рис.44) можно приготовить срезы толщиной 25-50 мкм из нативной ткани и серийные срезы из фиксированной ткани.
Рис. 43. Общий вид вибратома фирмы «Lancer» (США)
(Vibratome, Series 1000)
Рис.44. Вибратом фирмы Campden Instruments (Англия).
(Схема элементов управления работы вибратома см. рис.45)
В этих вибратомах образец ткани приклеивается к неподвижному держателю (подставке) при помощи специального клея(цианокрилатный клей полимеризуется при соприкосновении с водой).
|
|
|
|
54 |
Нож |
вибратома |
- |
лезвие |
безопасной бритвы совершает |
вертикальное
движение и продольное - вибрирующее. После каждого среза держатель
ножа передвигается вдоль оси резания на определенное расстояние, которое
определяет толщину срезов. Исследователь может задавать толщину срезов
и получать серии срезов заданной толщины.
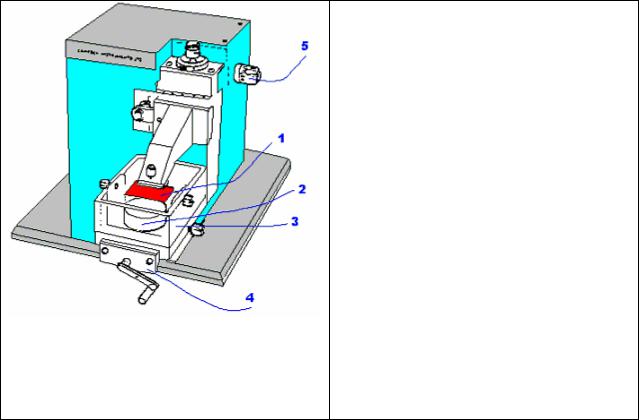
На рис. 45 показана схема вибратома фирмы «Campden Instruments».
Рис.45. Основные элементы управления работывибратома фирмы
«Campden Instruments»:
1 - режущий инструмент (лезвие бритвы), 2 - подставка для образца ткани,
3 - ванночка в которой находится образец ткани на подставке, 4 - ручка для перемещения ванночки с образцом ткани относительно
режущего инструмента, 5 - ручка для регуляции частоты
вибрации режущего инструмента.
Другая возможность микротомии нативной и фиксированной ткани (без
заливки в пропитывающие материалы) связана с использованием
специальных микротомов-резаков (рис.46):

55
Рис.46. Общий вид микротомарезака (Центр аналитической микроскопии).
(Блок питания и педаль дистанционного управления на рис. не показаны)
В таких резаках, впервые предложенных МакИльвейном, нож
(половинка лезвия безопасной бритвы), совершает только вертикальное движение (без продольной вибрации). В этом случае трудно получить срезы толщиной менее 100 мкм.
Образец ткани помещается на специальный столик, покрытый фильтровальной бумагой, смоченной физиологическим раствором. В одном из вариантов резака нашей конструкции ткань помещается в специальный держатель из агар-агара (6-8% раствор), а лезвие бритвы закрепляется на основании резака на боковой поверхности специальной ванночки.
Главным преимуществом микротомии на вибротомах или резаках
является отсутствие необходимости предобработки ткани промежуточными растворителями и заливочными материалами. Однако при помощи этих
видов микротомии невозможно получить серии |
тонких |
срезов. |
Срезы |
||||||||||
нативной |
ткани |
являются |
прекрасной моделью для |
изучения |
многих |
||||||||
динамических |
процессов |
в |
клетках |
и тканях |
in |
vitro |
- потребление |
||||||
кислорода, |
активные |
транспортные |
механизмы (захват, |
секреция), |
|||||||||
биосинтетические процессы и др. (метод переживающих срезов ткани). |
|||||||||||||
В гистохимии срезы нативной ткани используются не часто, |
хотя есть |
||||||||||||
методы, например, так называемый глиоксалевый метод на биогенные |
|||||||||||||
моноамины, в |
котором |
используются срезы |
тканей, |
приготовленные на |
|||||||||
вибратоме. Кроме этого, срезы тканей полученные на резаках и вибратомах |
|||||||||||||
успешно применяются в иммуногистохимии. С моей точки зрения, срезы из |
|||||||||||||
нативной |
ткани |
и фиксированной |
ткани |
без |
заливок |
в |
дополнительные |
||||||
56
материалы имеют большую перспективу в гистохимии, которая еще не достаточно раскрыта.
3.3.Манипуляции со срезами
3.3.1.Подготовка предметных и покровных стекол
Обычно срезы тканей помещаются на специальные предметные стекла
размером 76х26 мм, и толщиной 1,5 мм. Требования к толщине предметных
стекол приобретают особое значение, когда используются тонкие срезы и проводится анализ препаратов при больших увеличениях микроскопа.
Покровные стекла - тонкие стекла, которыми покрывают срезы после
проведения гистохимической реакции. Толщина покровных стекол играет важную роль при работе с объективами микроскопов с большой апертурой.
Это связано |
с тем, что |
каждый объектив характеризуется, |
в частности, |
|
рабочим расстоянием - |
расстоянием |
от его фронтальной линзы до |
||
поверхности |
препарата. |
Это расстояние |
уменьшается при |
увеличении |
апертуры обьектива. |
|
|
|
|
Предметные и покровные стекла после тщательного промывания и
обезжиривания обычно хранятся в смеси этилового спирта и эфира.
Для различных манипуляций со срезами используется определенный
инструментарий для переноса срезов, их раскладки на стеклах,
расправления и др. (пинцеты, иглы, кисточки из мягкой шерсти, тонкие
полоски фильтровальной бумаги и т.д.). Набор инструментария, как правило, является индивидуальным для каждого исследователя и
подбирается им с учетом личного навыка и исследуемой ткани.
Для приклеивания срезов к предметным стеклам используются
специальные клеи, что препятствует отклеиванию и порче срезов во время
гистохимических реакций. |
Один из таких |
клеев готовится на |
основе |
|
куриного белка, глицерина и желатины. Перед помещением срезов на |
||||
предметные |
стекла, на их |
поверхность тонким слоем наносится клей. Для |
||
маркировки |
препаратов |
на предметные |
стекла наносятся |
специальны |
57
надписи при помощи специальных чернил на основе смеси белка куриного яйца и черной туши или при помощи флолмастера. Один из наиболее
удачных способов нанесения маркировки заключается в том, что сначала один из краев предметного стекла матируется, а затем простым карандашом на матовой поверхности наносится соответствующая надпись. В этом случае надпись устойчива при попадании на нее воды и различных растворителей во время манипуляций с препаратами.
3.3.2. Автоматы для гистологической обработки
Различными фирмами выпускаются специальные автоматические
приборы для гистологической проводки образцов ,тканив которых
проводятся все операции от фиксации кусочков ткани до заливки их в парафин. В качестве примеров таких приборов можно привести установку
для автоматической проводкиHMP 300 (Zeiss) |
с микропроцессорным |
||||
управлением, |
Hypercenter |
XP |
(Shandon), автомат |
для гистологической |
|
проводки карусельного типа Citadel 1000/200 (Shandon) и мн. др. |
|
||||
Приборы |
этого |
типа |
представляют |
сложные |
технические |
автоматизированные |
системы и их |
использование |
оправдано |
в случае |
|||
проводки большого |
количества |
гистологического материала, например, |
|||||
при |
лабораторно-клинических |
гистологических |
анализах |
в |
крупных |
||
медицинских центрах. В обычной |
научно-исследовательской |
работе |
|||||
использование гистологических автоматов не эффективно. |
|
|
|||||
|
Контрольные вопросы |
1. |
Общие задачи химической фиксации. Проблемы химической фиксации, артефакты. |
2. |
Альдегиды, используемые для приготовления химических фиксаторов. |
3.Особенности применения формалина как фиксатора, параформ.
4.Глутаральдегид как химический фиксатор.
5.Взаимодействие белков с альдегидами. Использование альдегидной фиксации в гистохимии. Связь структуры альдегидов с их фиксирующей способностью.
6. |
Буферы и альдегидная фиксация. |
Хранение альдегидных фиксаторов. |
7. |
Формалиновые смеси (фиксаторы): |
жидкость Бэкера, Шабадаша, смесь Пирсона, |
солевой забуференный формалин. |
|
|
58
8.Ионы металлов как фиксаторы. Хромовая кислота, основные свойства, область использования, механизм фиксации.
9.Соли ртути, механизмы фиксации, область использования в гистохимии. Смесь сулема - уксусная кислота.
10.Четырехокись осмия, основные механизмы фиксации, область использования в гистохимии.
11.Пикриновая кислота, механизмы фиксации. Смесь Боуэна.
12.Сульфосалициловая кислота, механизмы фиксации.
13.Спирты как фиксаторы для гистохимии, механизмы действия. Спиртовые смеси (Жидкость Карнуа).
14.Ацетон - химический фиксатор, механизмы действия.
15.Что такое физическая "фиксация"?
16.Использование низких температур, общие принципы. Кристаллизация воды в тканях, значение для фиксации.
17.Общая классификация криометодов фиксации тканей для гистохимии. Прямое замораживание тканей (до -10 - -20 град. С, без дегидратации).
18. Глубокое замораживание тканей (до -78 - -196 град. С, без дегидратации).
19.Замораживание тканей при помощи твердой углекислоты.
20.Жидкий азот, замораживание ткани, скорость замораживания, использование "промежуточных жидкостей" (изопентан, пропан).
21.Сублимационная сушка тканей как "физическая" фиксация. Общие принципы сублимационной сушки.
22.Определение конца сублимации. Сопротивление высушенного слоя. Артефакты
при сублимационной сушке, методы их уменьшения.
23.Основные приемы обработки лиофилизированной ткани для гистохимических целей.
24.Метод замещения льда в тканях в замороженном состоянии, основные принципы.
25.Что такое микротомия тканей? "Толстые" и "тонкие" срезы.
26.Типы микротомии (классификация). Типы микротомов (ротационный, салазочный).
27.Криостат. Резаки и вибратомы.
28.Материалы для заливки тканей для микротомии (общая характеристика).
29.Водорастворимые пластмассы (поливиниловый спирт. полиэтиленгликоли). Гелеобразующие заливочные материалы (желатин, агар).
30.Парафин (способы заливки).
31.Заливка ткани в целлоидин.
32.Подготовка предметных и покровных стекол. Основные параметры предметных и
покровных стекол (толщина, размеры и др.). Маркировка предметных стекол.
33.Приклеивание срезов к предметным стеклам. Получение срезов на замораживающем микротоме: манипуляции со срезами.
34.Изготовление срезов из парафиновых блоков (перенос срезов, расправление срезов)
59
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА ( Раздел 2)
1.Ромейс Б. Микроскопическая техника, ИИЛ, М., 1954
2.Кисели Д. Практическая микротехника и гистохимия, Изд. АН Венгрии,
Будапешт, 1962
3.Лилли Р. Патогистологическая техника и практическая гистохимия. Мир,
М., 1980
4.Пирс Э. Гистохимия. Теоретическая и прикладная. ИИЛ, М., 1962
5.Конарев В.Г. Цитохимия и гистохимия растений, М., Высшая школа,1965
6.Дженсен У. Ботаническая гистохимия, М., Мир, 1965
7.Саркисов Д.С., Лопатенок А.А. Применение пластических масс для
заключения гистологических и анатомических препаратов, Медгиз, 1961, М.
8. Микроскопическая техника. Руководство. Под ред. Д.С.Саркисова и Ю.Л.Перова, Медицина, М., 1996, гл.1-4.
9. Бойчук Н.В., Исламов Р.Р., Улумбеков Э.Г., Челышев Ю.А. Гистология, Медицина, М., 1998
10. Gahan P.B. Plant histochemistry and cytochemistry. An introduction. Academic Press, London, 1984
