
razdel_2
.pdf31
которые чувствительны к посмертным изменениям и действию химических фиксаторов. В некоторых случаях сублимационная сушка является единственно возможным методом для гистохимической реакции.
Например, для прямого гистохимического выявления биогенных моноаминов
(катехоламины и индоламины) наиболее оптимальным методом подготовки ткани является сублимационная сушка т обработка лиофилизированной ткани в газообразном формальдегиде при определенной влажности и температуре.
2.2.7.Артефакты, возникающие при сублимационно сушке тканей
Главные |
артефакты, |
возникающие |
|
при |
сублимационной |
|
сушке |
|||||||||
тканевых образцов связаны, |
с |
нашей |
|
точки |
зрения, с |
нарушением |
||||||||||
температурного |
режима |
расплавления |
льда |
и |
|
разрушением |
|
ткани, |
||||||||
вызванным |
резким |
усилением |
испарения |
воды |
при |
плавлении |
льда |
|||||||||
образцах ткани в процессе сушки. |
|
|
|
|
|
|
|
|
|
|
|
|||||
Другая группа артефактов связана с недостаточной сушкой |
ткани, |
в |
||||||||||||||
результате которой, |
особенно |
внутри |
образца, |
имеется зона |
разрушенной |
|||||||||||
ткани. Такая зона не высохшей |
ткани |
может приводить к порче всего |
||||||||||||||
образца ткани. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если ткань |
хорошо |
высушена, |
она |
очень гигроскопична |
и |
при |
||||||||||
извлечении ее из сушильной камеры |
|
возможна |
конденсация |
воды из |
||||||||||||
воздуха, особенно, если высушенная |
ткань, |
извлеченная |
из |
камеры, |
||||||||||||
имеет температуру ниже комнатной. В |
связи с этим, |
в конце сушки, |
перед |
|||||||||||||
извлечением |
|
высушенной |
ткани |
|
из |
камеры, необходимо |
поднимать |
|||||||||
температуру образцов выше комнатной |
для предотвращения |
конденсации |
||||||||||||||
на их поверхности воды. Высушенную ткань обычно сохраняют для
последующих опытов |
в |
эксикаторе |
над |
пятиокисью фосфора, |
концентрированной серной |
кислотой |
или |
другими осушителями |
|
(активированный уголь, |
цеолиты и т.д.). |
|
|
|
32
Качество сушки и артефакты обычно оцениваются или
обнаруживаются, к сожалению, только при микроскопическом анализе ткани.
2.2.8.Аппараты для лиофильной сушки ткани для гистохимического анализа
Впериодической научной литературе, многочисленных обзорах и
монографиях |
описано |
много |
разных |
конструкций |
приборов |
|
лиофилизации |
гистологических |
образцов |
для |
гистохим |
||
исследований. Один из детальных обзоров таких аппаратов имеется в монографии Э.Пирса «Гистохимия» (см. список рекомендуемой литературы).
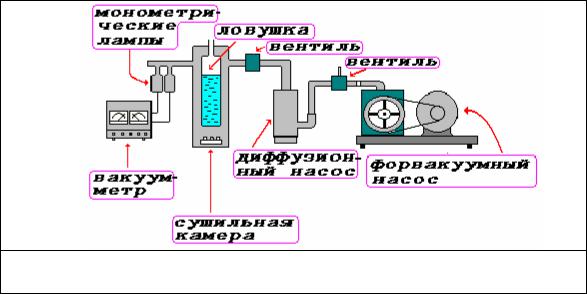
На рис. 22 представлена схема типичной вакуумной системы, используемой для
Рис. 22. Схема вакуумной системы для сублимации воды из тканевых образцов для гистохимического анализа
сублимационной сушки тканей для последующего гистохимического анализа.
На рис.23 представлен внешний вид уникального прибора для сублимационной сушки гистологического материала, разработанный в Центре аналитической микроскопии РАН в Пущино. Отличительной особенностью этого прибора является наличие шлюзовой камеры для ввода и вывода образцов ткани из сушильной камеры во время лиофилизаци гистологической ткани и встроенных электронных весов для взвешивания образцов ткани во время лиофильной сушки образцов тканей.

33
Рис. 23. Прибор для сублимационной сушки образцов ткани Центра аналитической микроскопии Института теоретической и экспериментальной биофизики РАН (Пущино). Слева – общий вид, справа – вид сушильной камеры
2.2.9. Лиофилизация растительной ткани
Все, что было описано выше относительно лиофилизации тканей для последующего гистохимического анализа относится к исследованиям ткани животных. Лиофилизация растительной ткани имеет свои особенности, что сильно отличает методы лиофилизации растительной ткани от лиофилизации ткани животных. В «Ботанической гистохимии» У.Дженсен подробно рассматривает особенности лиофилизации растительной ткани и замечает,
что «…техника лиофильной сушки– хороший пример тех осложнений, с
которыми приходится иногда сталкиваться при применении к растительному материалу методов, разработанных для ткани животных. В 1934 году Т.Гудспид и Ф.Убер впервые использовали технику лиофильной сушки для растительных тканей. При этом они обнаружили, что сушка этих тканей требует значительно больше времени и что , тканивысушенные этим способом, чрезвычайно плохо пропитываются парафином… После этого лиофильная сушка растительных тканей не практиковалась до1954 г. ..»..
Наиболее удовлетворительные и даже отличные результаты были получены
34
при использовании специального метода– лиофилизации при низком
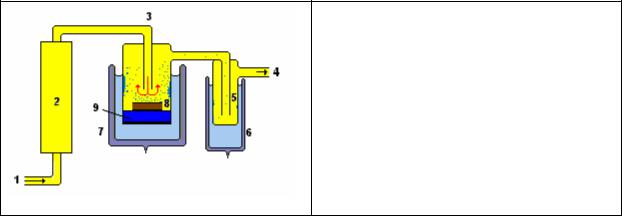
вакууме в токе газа. Схема аппарата для лиофильной сушки в токе газа
показана на рис. 24.
Рис.24. Схема прибора для лиофилизации в токе газа. 1 – газ (СО2 или N2), 2 – колонка с осушителем газа (CaCl2), 3 – трубка, подводящая газ в сушильную камеру, 4 – вакуумный насос, 5 – ловушка воды, 6,7 – Дьюары с охлаждающей жидкостью, 8 – контейнер с образцами тканей, 9 - парафин
После высушивания образцов растительной ткани в данной установке
сосуд 7 убирается, а сушильная камера нагревается, парафин расплавляется,
и высушенные образцы тканей пропитываются парафином в вакууме. Детали
использования лиофильной |
сушки для растительной ткани подроб |
|
описаны |
в «Ботанической |
гистохимии» У.Дженсена (см. список |
рекомендованной литературы). |
|
|
2.3. Замещение в замороженном состоянии
Для проведения дегидратации замороженной ткани |
при помощи |
|
сублимационной |
сушки требуется довольно сложная |
аппаратура, |
состоящая из вакуумных насосов, вентилей, трубопроводов, сушильных
камер, азотных (или другого типа) ловушек, систем измерения вакуума и
др., что является серьезным препятствием для широкого использования
лиофилизации в гистохимической практике.
Имеется другой метод для низкотемпературной дегидратации тканей,
основанный на растворении льдав замороженной ткани некоторыми
органическими растворителями. Для реализации этого метода не требуется
сложная аппаратура.
В.Симпсон в 1941 году впервые предложил в качестве органических
растворителей льда в замороженной ткани метилцеллозольв и этиловый
35
спирт, не замерзающие, соответственно, при температурах -78°С и - 40°С. Метилцеллозольв - монометиловый эфир этиленгликоля(2-
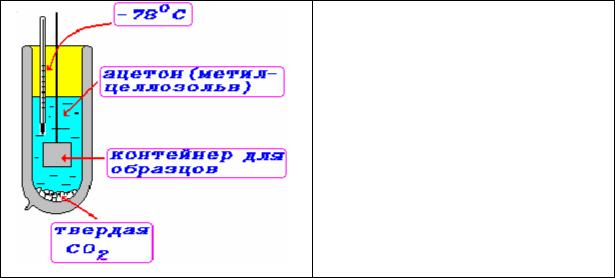
метоксиэтанола), не является химическим фиксатором, хорошо смешивается с водой. Поэтому в случае метилцеллозольва происходит только дегидратация ткани. Для замещения в замороженном состоянии метилцеллозольв охлаждается твердой углекислотой до температуры -78°С,
замороженная ткань опускается в специальных контейнерах в сосуд охлажденным метилцеллозольвом на некоторое время. Все операции проводятся в сосуде Дьюара с твердой углекислотой (рис.25).
Рис.25. Схема оснащения сосуда Дьюара для проведения замещения в замороженном состоянии
Так как температура плавления метилцеллозольва ниже температуры
твердой углекислоты, не требуется никаких дополнительных технических
средств. Лед в тканях растворяется метилцеллозольвом и замещается им. В
результате ткань обезвоживается и пропитывается метилцеллозольвом. Для замещения в замороженном состоянии используютсятакже другие
растворители: |
ацетон |
(температура |
плавления -95.35°С), н-бутанол |
(температура |
плавления |
-89.5°С), смесь этанола и метанола (температура |
|
плавления метанола -97.9°С), пропиленгликоль (температура плавления -
60°С) и др. |
Абсолютный этиловый спирт (температура |
плавления - |
|||
114.15°С) |
при |
температуре |
твердой |
углекислоты |
обладаетне |
фиксирующими свойствами, и приводит только к растворению льда и его замещению в тканях.

36
Глава 3. Микротомия тканей
Общие положения
Микротомия тканей - комплекс методик и соответствующих приборов для изготовления срезов тканей толщиной от2-3 мкм до 100-150 мкм. В
зависимости от вида предподготовки образцов тканей перед изготовлением срезов можно предложить следующую классификацию методов микротомии:
·Микротомия тканей, фиксированных химическими фиксаторами и залитых в пропитывающие среды,
·Микротомия замороженных тканей (без предварительной фиксации,
после фиксации, без заливки в пропитывающие среды).
· Микротомия |
нативных |
образцов |
тканей |
или |
образц |
фиксированной, не залитой в пропитывающие среды.
3.1. Приготовление блоков ткани для микротомии
Для микротомии фиксированных тканей в ряде случаев необходимо такую ткань пропитать различными материалами таким образом, чтобы при изготовлении срезов ткань не деформировалась. В качестве пропитывающих материалов используются:
·полимерные материалы, растворимые в воде, которые при высыхании полимеризуются до образования твердых полимерных блоков;
·водорастворимые материалы в нагретом виде, которые при комнатной температуре образуют гели, плотность которых можно увеличить специальной дальнейшей обработкой;

37
·материалы, растворимые в органических растворителях. В этом случае,
после химической фиксации водными растворами фиксаторов, вода из фиксированных тканей должна быть удалена, например,
последовательным
замещением органическими растворителями, замещением в
замороженном состоянии, лиофилизацией.
В случае лиофилизированного |
материала, образцы тканей можно |
||||
пропитывать |
прямо в |
расплавленных |
материалах(парафин) в специальной |
||
камер при небольшом вакууме(несколько |
десятков мм |
рт. ст.). |
|||
Конструкция |
одного |
из таких |
приборов |
используемых |
в Центре |
аналитической микроскопии, приведена на рис.26.
Рис.26. Установка для пропитывания в вакууме парафином гистологического материала. Слева: вид спереди, 1 – камера для образцов ткани, 2 – регулятор температуры, 3 – манометр; Справа: вид сверху, 1 – контейнер для тканевых образцов, 2 – термометр, 3 – контейнер с тканевыми образцами внутри заливочной камеры. Насос и шланги для охлаждения камеры не показаны. (Центр аналитической микроскопии).
Пропитка парафином тканевых образцов на этой установке производится
следующим образом. |
После включения установки терморегулятором |
устанавливается температура в ванночке +56°С. Крышка термостатируемой
38
камеры (1) для лиофилизированных тканей открывается и туда наливается |
|
||||
расплавленный парафин, |
крышка закрывается и камера подключается к |
||||
насосу |
– |
происходит |
дегазация парафина(уровень |
разряжения |
над |
парафином |
контролируется манометром). Затем, после |
впуска воздуха |
в |
||
камеру, ее крышка открывается, и в ячейки контейнера помещаются
лиофилизированные |
образцы |
тканей, крышка |
закрывается |
и |
камера |
откачивается. Видно |
как из тканевых образцов |
выходят пузырьки |
воздуха, |
||
после прекращения их выделения нагрев камеры выключается и установка
подключается |
к |
водопроводной |
системе– вода |
пропускается |
через |
|
специальные |
каналы в теле камеры и парафин |
быстро |
затвердев. |
|||
Контейнер с залитыми в парафин тканями вынимаетсяиз камеры и блоки |
||||||
тканей извлекаются из ячеек контейнера. |
|
|
|
|
||
3.1.1. Парафин |
|
|
|
|
|
|
Парафины |
имеют разную температуру плавления– от |
+45 - +50°С |
||||
(мягкий парафин) до +58 - +60°С (твердый парафин). |
Для |
пропитывания |
||||
тканей обычно рекомендуется парафин с более высокой |
температурой |
|||||
плавления. Смешиванием "мягкого" |
и "твердого" |
парафинов |
можно |
|||
получить парафины с разной температурой плавления. Так как парафин не растворяется в воде, для пропитывания им фиксированной ткани (в
случае водосодержащих фиксаторов), необходимо предварительно удалить из ткани воду и заместить ее органическими растворителями парафина.
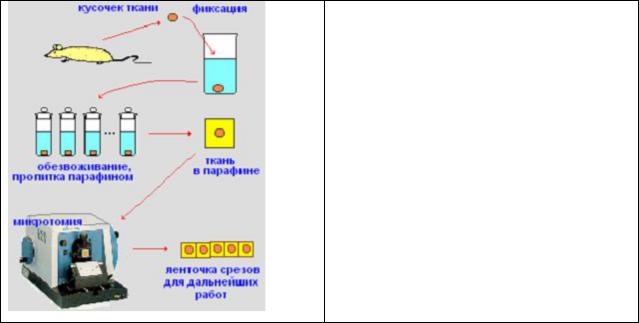
Для этой цели широко применяется ступенчатое, последовательное,
обезвоживание фиксированной ткани спиртами с возрастающей концентрацией (от 30% до 100%) с последующим замещением спирта одним из органических растворителей парафина: бензолом, хлороформом,
сероуглеродом, четыреххлористым углеродом, толуолом, ксилолом и др.(рис. 27).
39
Рис.27. Последовательность операций при заливке фиксированной ткани в парафин
Необходимо стремиться к применению более летучих растворителей, т.к.
при этом происходит более быстрое удаление растворителя из ткани при замещении его парафином. С этой точки зрения наиболее удобным являются сероуглерод и хлороформ.
В настоящее время выпускается три типа парафиновых смесей под общим названием Парапласты(«Regular», «Plus» и «Х-Tra»). Эти смеси включают кроме парафинов с разной температурой плавления разны полимерные добавки, придающие Парапластам разную твердость. На основе личного опыта показано, что заливка в Парапласт типа«Х-Tra» позволяет получать срезы толщиной 2-4 мкм, что соответствует паспортным данным.
Материал, залитый в другие типы Парапластов, позволяет успешно делать срезы толщиной 5-10 мкм (Парапласты выпускаются фирмой «Сигма»).
3.1.2. Целлоидин
Целлоидин является термопластическим материалом, представляющим смесь мононитроцеллюлозы, динитроцеллюлозы и камфоры (огнеопасен
!, растворим в органических растворителях, например, в смеси абсолютного этанола - диэтилового эфира). Раствор целлоидина используется для пропитки фиксированного, предварительно обезвоженного материала путем пропитки в серии растворов целлоидина с
|
|
|
|
|
40 |
повышающейся концентрацией. |
Окончательная |
заливка |
производится в |
||
растворе |
целлоидина |
с |
концентрацией |
8-12%. |
Уплотнение |
целлоидинового блока проводится в парах хлороформа, после чего блок
залитой ткани хранится в 70 - 80% растворе этилового спирта.
3.2.Микротомы
3.2.1.Микротомы для пропитанной ткани
Из образцов тканей, залитых в парафин, целлоидин или другие
материалы, срезы обычно приготавливаются с использованием двух типов
микротомов: ротационных и салазочных. В ротационном микротоме
массивный нож закреплен на основании микротома, а блок залитой ткани
находится в специальном держателе, закрепленном в подвижной части
микротома (рис. 28):
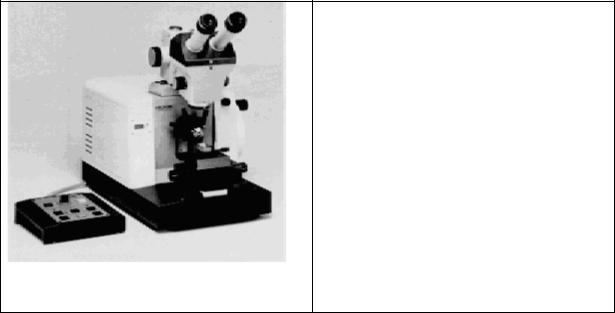
Рис.28. Современный ротационный микротом с электроприводом типа НМ 350 (фирма «Микром», Германия). Толщина срезов – 0.25 - 30 мкм. Держатель режущего инструмента позволяет использовать стандартные ножи, одноразовые лезвия, стеклянные, твердосплавные и алмазные ножи. На рисунке показан микротом со стереомикроскопом для наблюдения за процессом резки.
В салазочном микротоме наоборот нож закреплен в держателе, который является подвижным элементом относительно блока ткани (рис.29).
