
razdel_2
.pdf
11
Хромовая кислота сильный окислитель, в ткани проникает очень медленно - за 4 часа проникает на глубину 1,4 мм. Во время фиксации
хромовая кислота и ее соли вызывают осаждение цитоплазматических и
ядерных белков. |
Взаимодействуя с водой хроматы способны образовывать |
||||||||||||
комплексы |
Cr-O-Cr, |
которые |
|
могут |
вступать |
в |
реакцию |
с |
|||||
функциональными |
группами |
белков (карбоксильными, |
аминными, |
||||||||||
гидроксильными |
и |
др.), |
образуя |
мостики, аналогичные метиленовым, |
|||||||||
которые образуются при взаимодействии формальдегида с белками. |
|
||||||||||||
Считается, |
что |
ионы |
хрома, |
в |
основном, |
связываются |
с |
||||||
карбоксильными |
группами |
белков , |
ив |
конечном |
счете, |
как |
указывает |
||||||
Э.Пирс, действие хрома проявляется в разрыве внутренних (солевых)
связей в молекулах белка и увеличении количестваосновных групп,
находящихся в |
реактивном |
состоянии, что |
приводит |
к повышению |
||
ацидофильных свойств образующихся комплексов хром-белок. |
|
|||||
В гистохимических исследованиях соли хрома используются редко, |
за |
|||||
исключением |
некоторых |
|
специальных |
реакций, |
например |
в |
хромаффиновой |
реакции |
на |
катехоламины, а |
также |
для стабилизации |
|
липидов и нуклеиновых кислот.
1.2.2. Соли ртути
Соли ртути, главным образом, сулема (двухлористая ртуть),
используются для фиксации, в основном, благодаря избирательному взаимодействию с SH-группами белков. Хотя необходимо отметить, что как и другие ионы металлов, ионы ртути взаимодействуют также с карбоксильными и гидроксильными группами белков. Взаимодействие сулемы с SH-группами белков протекает в две стадии:
|
|
|
|
|
|
|
|
|
12 |
Вторая |
стадия реакции протекает |
|
медленно и, по-видимому, не |
||||||
имеет главного |
значения |
для |
процесса |
фиксации тканевых |
белков. |
||||
Реакция SH-групп белков |
с |
ртутью |
является необратимой, |
поэтому, |
|||||
например, |
при |
изучении |
нуклеиновых |
кислот (ртуть |
реагирует |
с |
|||
кислотными группами нуклеотидов) или |
|
сульфидрильных групп |
белков |
||||||
необходимо |
избегать ртутьсодержащих |
фиксаторов, хотя ряд |
реакций |
на |
|||||
белки (реакции Миллона, Сакагуши, тетразониевого сочетания) можно проводить после фиксаторов, в состав которых входят ионы ртути.
1.2.3. Четырехокись осмия |
|
|
|
|
|
Четырехокись |
осмия, или |
как часто ее |
называют |
"осмиевая |
|
кислота", один |
из широко |
используемых |
фиксаторов, |
особенно в |
|
электронной микроскопии. Фиксатор легко взаимодействует |
с липидами, |
||||
особенно с нейтральными липидами, содержащими |
остатки |
непредельных |
|||
карбоновых жирных кислот - олеиновой, линолевой, линоленовой. |
|||||
Механизм взаимодействия четырехокиси осмия с тканевыми липидами |
|||||
до конца не изучен, но считается, |
что этот фиксатор образует нестабильные |
||||
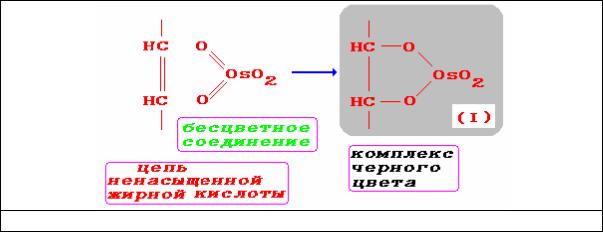
моноэфиры циклического типа в результате окисления двойных связей жирных кислот (рис. 8):
Рис. 8. Схема взаимодействия OsO4 с жирными кислотами
Соединение I может образовывать стабильные диэфиры при реакции с соединениями, содержащими гидроксильные группы (рис.9):
13
Рис.9. Образование диэфирных связей соединения I (рис.9) с цепями, содержащими гидроксильные группы
При избытке непредельных соединений осмиевая кислота может образовывать комплексные соединения (рис.10):
Рис. 10. Образование комплексных соединений OsO4 с непредельными соединениями
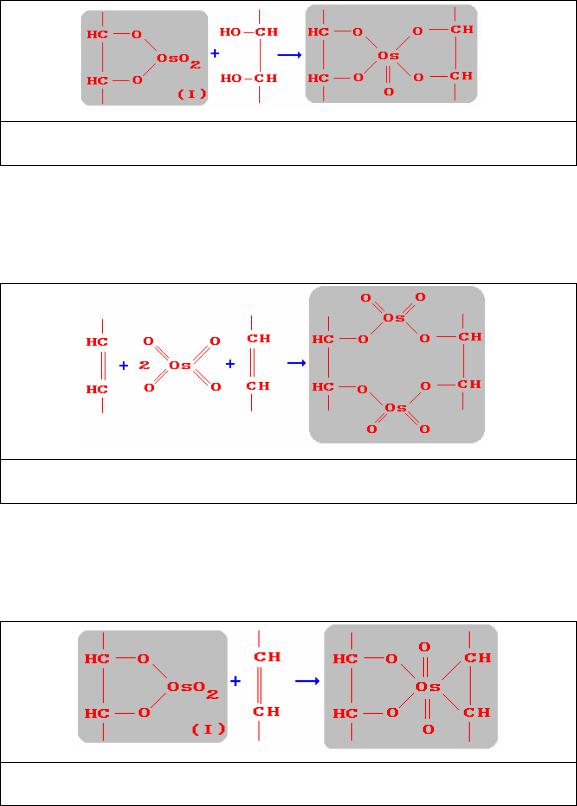
Согласно другим данным, осмиевая кислота может образовывать сшивки между двумя участками непредельных жирных кислот (рис.11):
Рис. 11. Образование сшивки соединения I (рис. 9) с непредельными жирными кислотами
Показано, что для четырехокиси осмия можно построить следующий
ряд активности взаимодействия с различными другими реакционными
группами химических соединений: SH-группы > -С=С-группы >

14
концевые аминогруппы > -S-S-группы > -СНО-группы >концевые
ОН-группы >-ОН-группы ароматического кольца.
1.3.Органические кислоты
1.3.1.Пикриновая кислота
Пикриновая кислота – 2,4,6- тринитрофенол, кристаллическое |
вещество |
|||
желтого |
цвета, растворимое в воде. Растворы пикриновой кислоты легко |
|||
диффундируют в ткани и вызывают коагуляцию тканевых белков. При этом |
||||
образуются солеподобные |
соединения, |
в которых белковая часть |
||
представляет катион, а остаток пикриновой |
кислоты - анион. |
Растворы |
||
2,4,6-тринитрофенола используются в чистом видекак фиксаторы редко, |
||||
обычно |
пикриновая кислота входит в состав фиксирующих .смесей |
|||
Наиболее |
распространен фиксатор Боуэна - смесь пикриновой |
кислоты, |
||
формальдегида и уксусной кислоты используется для фиксации тканевого |
||||
материала |
для иммуногистохимических методов, для фиксации гликогена и |
|||
мукополисахаридов. |
|
|
|
|
1.3.2. Сульфосалициловая кислота

15
Сульфосалициловая кислота вызывает коагуляцию белков потерюи коллоидными структурами цитоплазмы сольватных оболочек, что приводит к хорошей морфологической и биохимической сохранности тканей.
Сульфосалициловая кислота часто используется самостоятельно или в смеси с другими фиксаторами белков, углеводов, липидов, гликогена,
мукополисахаридов.
1.3.3.Трихлоруксусная кислота
Трихлоруксусная кислота, представляющая бесцветные кристаллы с острым запахом, хорошо растворимые в воде, широко используется в общей биохимии для осаждения белков. Однако в качестве гистохимического фиксатора на белки это соединение используется крайне редко.
1.4. Спирты
Из спиртов в качестве химических фиксаторов используются чаще всего этиловый (1) и метиловый (2) спирты:
|
|
(1) |
(2) |
|
|
Фиксирующее действие спиртов связано с осаждением белков. Точных данных о механизмах осаждения белков спиртами в настоящее время не имеется, однако, существует несколько предположений на этот счет.
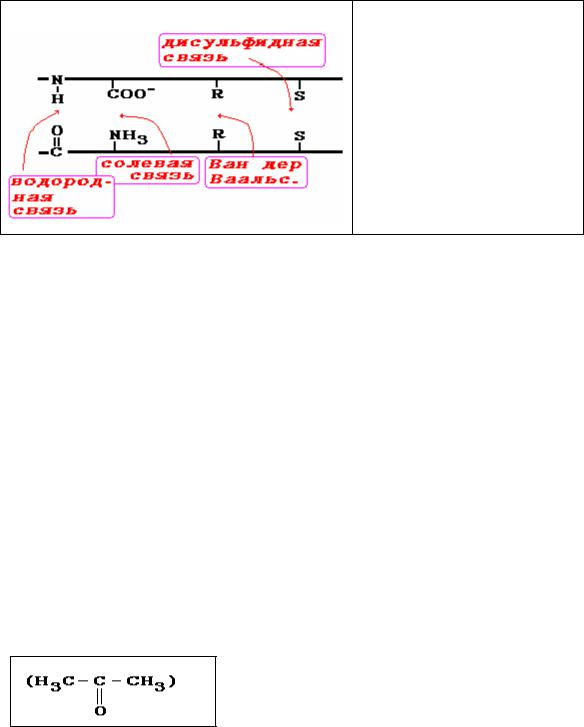
Например, считается, что под действием спиртов возможенразрыв поперечных сшивок в белковой цепи (рис. 12).
16
Рис.12. Возможные точки приложения спирта во время фиксации белков
Согласно другим |
данным, спирты могут нарушать сольватные |
|||
оболочки |
входящих в белки групп, "уплотнять молекулы" и вызывать |
|||
появление |
новых |
конфигураций функциональных групп |
в белковой |
|
молекуле. |
Фиксация |
белков спиртами в ряде случаев обратима, однако, |
||
большинство ферментов необратимо теряет активность после обработки |
||||
тканевых образцов или срезов ткани спиртами. Обычно спирты |
входят в |
|||
различные |
фиксирующие смеси, например, широко |
известный фиксатор |
||
Карнуа состоит из абсолютного спирта, хлороформа |
и уксусной кислоты и |
|||
широко используется для фиксации нуклеиновых кислот, белков, гликогена,
мукополисахаридов и др.
1.5. Ацетон
Ацетон |
(диметилкетон) |
представляет |
|
летучую |
, |
жид |
|
смешивающуюся с водой в любых соотношениях. Ацетон |
обезвоживает |
|
|||||
коллоиды цитоплазмы и приводит |
к осаждению белков, |
что не приводит к |
|
||||
глубоким |
изменениям в структуре белка и поэтому |
действие |
ацетона |
|
|||
обратимо |
при добавлении к фиксированным тканям воды. Однако, ацетон, |
|
|||||
также как и спирты, приводит к сильному сжатию |
ткани |
и |
это |
надо |
|||
учитывать при анализе морфологических характеристик ткани. |
|
|
|
||||
17
1.6.Фиксирующие смеси
Взаключение краткого обзора основных групп органических и неорганических соединений, используемых в качестве химических фиксаторов тканей, необходимо отметить, что в большинстве случаев для
гистохимической фиксации используются специальные фиксирующие
смеси, составленные из нескольких фиксирующих соединений,
рассмотренных выше. Для примера можно привести следующие широко используемые фиксаторы:
·Фиксатор Шаффера - смесь формалина и спирта;
·Фиксатор Ружа - смесь формалина и уксусной кислоты, которая предохраняет ткань от сморщивания);
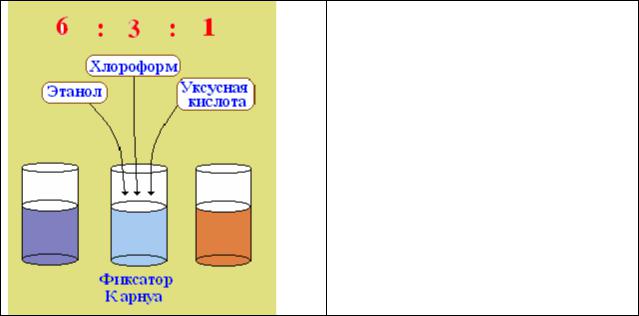
·Жидкость Карнуа - смесь этанола, хлороформа и уксусной кислоты
(рис.13);
·Фиксатор представляющий смесь сулемы и уксусной кислоты;
·Фиксатор Боуэна - смесь пикриновой кислоты, формалина и уксусной кислоты.
Рис.13. Фиксатор Карнуа
Из приведенных примеров видно, что часто к фиксирующим соединениям добавляется ледяная уксусная кислота, которая сама по себе
18
не обладает выраженными фиксирующими свойствами, но ее добавление в гистохимический фиксатор приводит обычно к ускорению диффузии основного фиксатора в ткань. Для этой же цели иногда используется диметилсульфоксид, который также увеличивает проницаемость тканей для основного фиксатора.

19
Глава 2. Физические методы фиксации
Физические методы фиксации тканей для гистохимических целей
основываются на использовании методов, связанных с действием низких
температур, в диапазоне -78 - -196 |
°С, |
на |
биологическую |
ткань. |
При |
|||
низкотемпературной |
фиксации |
|
тканей |
(криофиксации) |
для |
|||
гистохимического анализа |
происходят |
два |
процесса - резкое |
снижение |
||||
скорости биохимических |
процессов |
в |
тканях, |
связанных, в основном, с |
||||
сильным уменьшением активности тканевых ферментов и кристаллизация воды в тканях (в тканях 80-90% воды!), что приводит к возможности
изготовить из замороженных тканей срезы толщиной 5 - 150 мкм.
Физические методы фиксации применяются в условиях простой
низкотемпературной |
консервации ткани |
без дегидратации |
с |
хранением |
|||
образцов |
ткани |
при |
низкой |
. температуреДругой |
|
вариант |
|
низкотемпературной |
фиксации |
связан |
с |
обезвоживанием |
замороженной |
||
ткани при |
помощи |
сублимационной сушки |
ткани в вакууме |
при низкой |
|||
температуре (лиофильная сушка, «freeze-drying» ) или путем замещения
замороженной воды в тканях некоторыми органическими растворителями
также при низкой температуре(замещение в |
замороженном |
состоянии, |
|||
«freeze-substitution»). [Термин “…при |
низкой |
температуре..” обозначает |
|
||
температуру ниже температуры замораживания воды]. |
|
|
|||
Для |
замораживания |
ткани |
используются |
в |
|
низкотемпературные холодильники и некоторые хладоагенты– твердая |
|
||||
углекислота и жидкий азот. В научной литературе высказывается мнение, |
|
||||
что низкотемпературные методы не являются в общем смысле слова методом |
|
||||
фиксации ткани, т.к. многие метаболические процессы будут продолжаться в |
|
||||
ткани, как |
только она будет нагрета |
до температуры таяния |
.льдаТочно |
|
|
также при попадании воды в лиофилизированную ткань в ней возобновятся метаболические процессы, которые приведут к неисправимым артефактам в

20
гистохимическом препарате. Однако эти «недостатки» физических методов имеют важное значение для гистохимии, особенно в тех случаях, когда необходимо исследовать ферменты или эндогенные химические соединения,
которые под действием химических фиксаторов меняют местоположение в тканях и клетках(экстракция, растворение и др.) или разрушаются химическими фиксаторами.
2.1.Замораживание образцов ткани
2.1.1.Процесс кристаллизации воды в тканях при низких температурах
При замораживании ткани вода в ней, в зависимости от температуры,
находится в различных кристаллических состояниях от монокристаллического, поликристаллического до стекловидного состояния.
Это зависит от скорости замораживания. Можно выделить 3 зоны влияния скорости замораживания на состояние льда в тканях (Пушкарь и соавт.,1978)
(рис. 14):
I зона - |
скорость охлаждения меньше |
1 °C/с. Вода |
успевает выйти из |
|||||
клеток и происходит |
внеклеточная |
кристаллизация воды. |
Клетки резко |
|||||
изменяют |
форму |
и меняют размеры |
вследствие |
дегидратациии |
||||
гиперконцентрации веществ. |
|
|
|
|
|
|||
II зона |
- скорость |
охлаждения 1-100°C/с. При |
этом |
отмечается |
||||
образование |
довольно |
больших |
кристаллов |
льда |
внутриклеток, |
|||
вызывающих повреждение ультраструктуры клеток.
Рис.14. Образование кристаллов воды в тканях при разных скоростях замораживания
