
- •Ферменты как биологические катализаторы. Энергетический барьер химических реакций и способы его преодоления. Отличия ферментов от минеральных катализаторов.
- •Строение энзимов. Понятие об апоферменте, коферменте, холоферменте. Их роль. Химическая природа коферментов.
- •Функциональные центры ферментов, их строение и роль. Комплементарность субстрата и эффекторов структуре функциональных центров. Понятие о косубстрате.
- •Теории ферментативного катализа (теории Фишера и Кошланда; современные представления о механизме действия энзимов).
- •Специфичность энзимов. Виды специфичности (абсолютная субстратная и относительная субстратная, стереоспецифичность).
- •Изоэнзимы как множественные формы одного фермента. Особенности строения мультиэнзимных комплексов. Примеры мультиэнзимов и изоферментов.
- •Классификация и номенклатура ферментов. Характеристика отдельных классов. Примеры катализируемых реакций.
- •Применение ферментов в медицине. Использование ферментов в пищевой промышленности. Ферменты как компоненты моющих средств
Классификация и номенклатура ферментов. Характеристика отдельных классов. Примеры катализируемых реакций.
1. Ферменты называются добавлением суффикса -аза к названию субстрата, на который данный фермент действует. Например, уреаза катализирует гидролиз мочевины; ферменты, гидролизующие крахмал (амилон), были названы амилазами; гидро изующие жиры (липос) – липазами; ферменты, гидролизующие белки (протеины) – протеиназами.
2. Используются названия для групп ферментов, катализирующих сходные по механизму реакции. Их название строится по принципу — «субстрат-тип реакции». Например, ферменты, которые переносят остаток фосфорной кислоты от АТФ на другую молекулу, называются киназами (глюкокиназа катализирует перенос фосфорильного остатка от АТФ на глюкозу).
3. Тривиальные названия не показывают механизма действия, но они широко используются. Например, пепсин, трипсин и др.
4. Международный Совет Биохимиков (IUB) предложил систематическое название и классификацию ферментов по типу и механизму катализируемой реакции
В основу классификации ферментов положен тип реакций, подвергающихся каталитическому воздействию. Классы ферментов:
Оксидоредуктазы – катализируют окислительно-восстановительные реакции.
Трансферазы – переносят ту или иную функциональную группу от одного субстрата на другой.
Гидролазы – также участвуют в переносе групп, однако акцептором всегда является молекула воды.
Лиазы (синтазы) – катализируют расщепление или образование химических соединений или образование химических связей, при этом образуются или исчезают двойные связи.
Изомеразы – перемещают группы в пределах одной молекулы.
Лигазы (синтетазы) – катализируют энергозависимые реакции присоединения и поэтому их действие сопряжено с гидролизом АТФ.
Транслоказы —катализирует перенос ионов или молекул через мембраны или их разделение в мембранах. Этот класс ферментов сформировался из ранее принадлежащих другим классам ферментов
Оксидоредуктазы катализируют реакции, имеющие общий вид:
BH2 + A ↔ B + AH2
Где A — восстановитель (донор электронов), а B — окислитель (акцептор электронов). В биохимических превращениях окислительно-восстановительные реакции иногда выглядят сложнее.
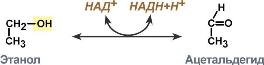
Здесь в качестве окислителя выступает НАД+, а глицеральдегид-3-фосфат является восстановителем.
Характерной особенностью деятельности оксидоредуктаз в клетке является их способность образовывать системы окислительно-восстановительных ферментов, в которых осуществляется многоступенчатый перенос атомов водорода от первичного субстрата к конечному акцептору, обычно кислороду, с образованием воды.
Другая особенность оксидоредуктаз состоит в том, что они ускоряют протекание химических процессов, связанных с высвобождением энергии.
Третья особенность оксидоредуктаз заключается в том, что имея несколько коферментов, они способны ускорять большое количество разных окислительно-восстановительных реакций. Один и тот же кофермент способен соединяться со многими апоферментами, образуя каждый раз оксидоредуктазу, специфичную по отношению определенному субстрату.
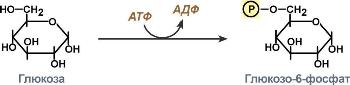
Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ. Реакции, катализируемые трансферазами, в общем случае выглядят так: A—X + B ↔ A + B—X. Молекула A здесь выступает в качестве донора группы атомов (X), а молекула B является акцептором группы. Часто в качестве донора в подобных реакциях переноса выступает один из коферментов. Многие из катализируемых трансферазами реакций являются обратимыми.
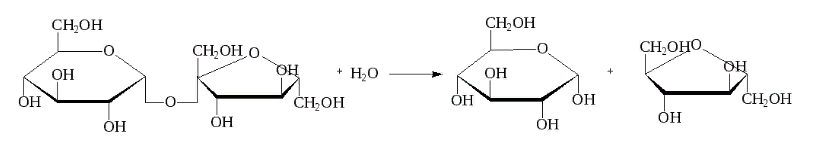
Гидролазы катализируют гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза. Общий вид реакции, катализируемой гидролазой, выглядит следующим образом:
A-B + H2O → A-OH + B-H.
Проявляют активность при наличии неизменённых сульфгидрильных SH— групп, если таковые занимают определённое положение в полипептидной цепи. Каталитическое действие заключается в соединении гидролаз с расщепляемым веществом и последующим отщеплением продуктов реакции с высвобождением самих гидролаз. Механизм имеет много общего с действием трансфераз. Гидролазы переносят отщепляемые группы на воду, но некоторые способны переносить их и на другие молекулы. Часть гидролаз выделена в кристаллической форме (уреаза, пепсин, трипсин, химотрипсин и др.).
Примером может служить гидролиз сахарозы на глюкозу и фруктозу:
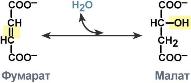
Лиазы – ускоряют негидролитические реакции распада органических соединений по связям C-C, C-N, C-O, C-S. При этом замыкаются двойные связи и выделяются такие простейшие продукты, как CO2, H2O, NH3. Некоторые из этих реакций являются обратимыми, и соответствующие ферменты в подходящих условиях катализируют реакции не только распада, но и синтеза.
Изомеразы
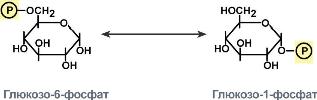
К этому классу относятся ферменты, ускоряющие геометрические или структурные изменения в пределах одной молекулы. Эти изменения могут заключаться во внутримолекулярном переносе атомов водорода, фосфатных или ацильных групп, в изменении пространственного расположения атомов, в перемещении двойных связей и т.д. Изомеразы, участвующие во внутримолекулярном переносе функциональных групп, имеют тривиальные названия – мутазы, например, Изомеразы, участвующие в реакциях инверсии у хиральных центров, имеют тривиальные названия – рацемазы и эпимеразы.
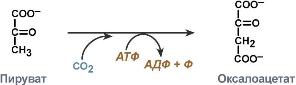
Лигазы, катализирующие образование химических связей C—C, C—S, C—O и C—N между субстратами. Главная их особенность – сопряженность синтеза с распадом АТФ. При отрыве от ее молекулы в присутствии лигаз одного или двух концевых остатков фосфорной кислоты выделяется большое количество энергии, используемой для активирования реагирующих веществ. Далее лигазы ускоряют соединение этих активированных субстратов.
Транслоказы катализируют реакции переноса молекул или ионов через мембраны, сопряженного с другими реакциями.
Например, при переносе протонов из матрикса митохондрии в межмембранное пространство через комплекс I электрон-транспортной цепи происходит восстановление убихинона до убихинола, и реакция описывается следующей схемой:
NADH + CoQ + 6 H+[side 1] = NAD+ + CoQH2 + 7 H+[side 2]
Второй пример — АТФ-синтаза, катализирующая реакцию переноса протонов из межмембранного пространства митохондрии в матрикс с образованием при этом молекулы АТФ из АДФ и неорганического фосфата, реакция описывается схемой [3]:
АДФ + Фн + 4 H+[side 1] → АТФ + H2O + 4 H+[side 2]
