
- •Ферменты как биологические катализаторы. Энергетический барьер химических реакций и способы его преодоления. Отличия ферментов от минеральных катализаторов.
- •Строение энзимов. Понятие об апоферменте, коферменте, холоферменте. Их роль. Химическая природа коферментов.
- •Функциональные центры ферментов, их строение и роль. Комплементарность субстрата и эффекторов структуре функциональных центров. Понятие о косубстрате.
- •Теории ферментативного катализа (теории Фишера и Кошланда; современные представления о механизме действия энзимов).
- •Специфичность энзимов. Виды специфичности (абсолютная субстратная и относительная субстратная, стереоспецифичность).
- •Изоэнзимы как множественные формы одного фермента. Особенности строения мультиэнзимных комплексов. Примеры мультиэнзимов и изоферментов.
- •Классификация и номенклатура ферментов. Характеристика отдельных классов. Примеры катализируемых реакций.
- •Применение ферментов в медицине. Использование ферментов в пищевой промышленности. Ферменты как компоненты моющих средств
Специфичность энзимов. Виды специфичности (абсолютная субстратная и относительная субстратная, стереоспецифичность).
Специфичность ферментов характеризует их способность катализировать определенные типы превращений тех или иных субстратов. Фермент может катализировать более одного типа превращений.
Ряд ферментов обладает абсолютной субстратной специфичностью, то есть катализирует превращение только одного субстрата. Примеры таких ферментов – глюкозооксидаза, многие дегидрогеназы. Известны ферменты широкой субстратной специфичности, такие как липазы, эстеразы, фосфатазы.
Распространены ферменты так называемой групповой специфичности, то есть такие, которые превращают ряд субстратов, обладающих характерным признаком. Так, α-амилаза гидролизирует линейные и разветвленные полимеры α-1,4-связанной глюкозы, химотрипсин – пептидные связи в белках, образованные остатками ароматических аминокислот.
Большинство ферментов проявляют абсолютную стереоспецифичность, превращая только L- или только D-форму субстрата. Стереоспецифичность проявляется также в отношении цис- и трансформы изомеров.
Изоэнзимы как множественные формы одного фермента. Особенности строения мультиэнзимных комплексов. Примеры мультиэнзимов и изоферментов.
Изоферменты – это изофункциональные белки. Они катализируют одну и ту же реакцию, но отличаются по некоторым функциональным свойствам в силу отличий по:
- аминокислотному составу;
- электрофоретической подвижности;
- молекулярной массе;
- кинетике ферментативных реакций;
- способу регуляции;
- стабильности и др.
Термин «множественные формы фермента» применим к белкам, катализирующим одну и ту же реакцию и встречающимся в природе в организмах одного вида. Термин «изофермент» применим только к тем множественным формам ферментов, которые появляются вследствие генетически обусловленных различий в первичной структуре белка (но не к формам, образовавшимся в результате модификации одной первичной последовательности).
Собственно множественные формы (истинные) — это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации и становятся разными, не смотря на то, что и катализируют одну и ту же реакцию.
Виды изоферментов:
Органные — ферменты гликолиза в печени и мышцах.
Клеточные — малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа — 4 субъединицы 2 типов).
Мутантные — образуются в результате единичной мутации гена.
Аллоферменты — кодируются различными аллелями одного и того же гена.
Пример 1. Изоферменты креатинкиназы (КК) образуются при объединении 2 субъединиц в димерную молекулу.
Креатинкиназа катализирует обратимую реакцию образования и распада креатинфосфата — вещества, которое участвует в запасании энергии.
Фермент КК является димером, состоящим из 2 субъединиц.Субъединицы В (мозговая) и М (мышечная) закодированы в разных генах.
Фермент КК представлен 3 изоферментами, которые различаются по электрофоретической подвижности:
— ВВ (КК-1) —мозговой, максимальное продвижение к аноду;
— MB (КК-2) —сердечный, средняя подвижность;
— ММ (КК-3) —мышечный, самый медленный.
Набор изоформ КК в разных тканях неодинаков.
Мультиферментные комплексы это надмолекулярные образования которые включают, несколько ферментов и коферментов. Они катализируют последовательные этапы реакции преобразования одного субстрата. Мультиэнзим или полиферментный комплексобразован за счет нековалентных взаимодействий, в его состав входит несколько индивидуальных ферментов; обычно эти ферменты функционально взаимосвязаны. Этот комплекс ферментов работает подобно конвейеру, в котором продукт передается от фермента к ферменту.
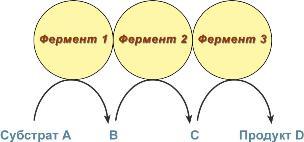
Примером может служить мультиэнзим, ускоряющий реакцию окислительного декарбоксилирования пировиноградной кислоты (рис.4). Этот полиферментный комплекс состоит из трех видов ферментов:
пируватдекарбоксилазы (1),
дигидролипоат-ацетилтрансферазы(2),
дегидрогеназы дигидролипоевой кислоты (3).
Такой принцип повышает
эффективность работы ферментов, так
как снижает случайность в контакте
реагирующих веществ с ферментом. П
 римером
мультиферментов являются реакции
окислительного декарбоксилирования
α-кетокислот (пирувата и
α-кетоглутарата) под
влиянием пируватдегидрогеназы и
α-кетоглутаратдегидрогеназы.
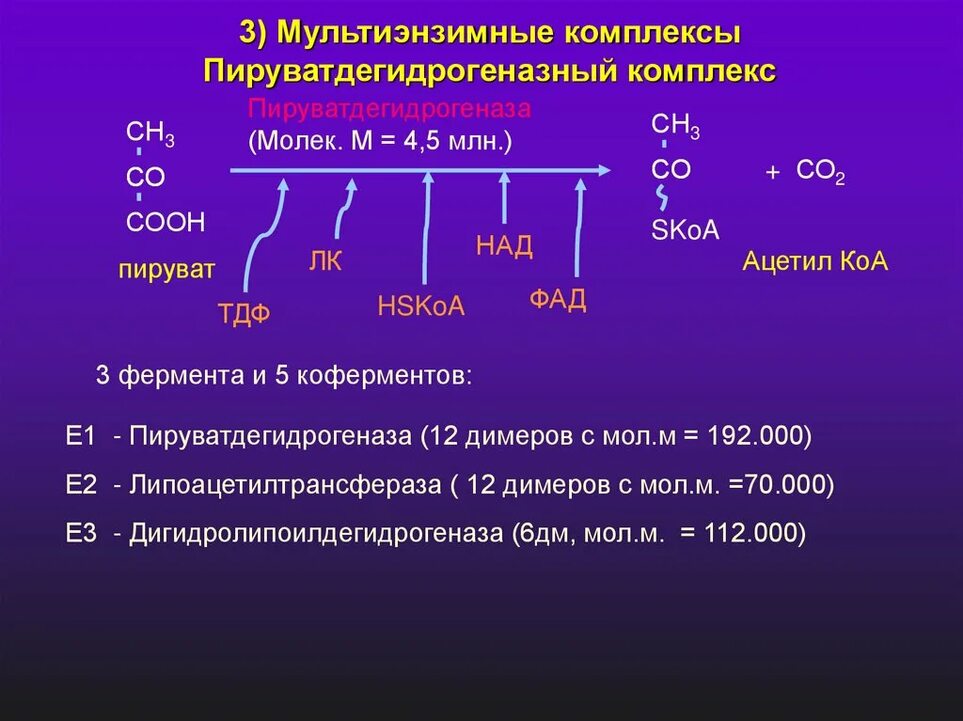
Например, пируватдегидрогеназный
комплекс включает 3 фермента и использует
5 коферментов: (Рисунки просто как
дополнительная информация с примером)
римером
мультиферментов являются реакции
окислительного декарбоксилирования
α-кетокислот (пирувата и
α-кетоглутарата) под
влиянием пируватдегидрогеназы и
α-кетоглутаратдегидрогеназы.
Например, пируватдегидрогеназный
комплекс включает 3 фермента и использует
5 коферментов: (Рисунки просто как
дополнительная информация с примером)
Мультиферментные комплексы, как правило, формируются на мембранах путем самосборки.
Регуляция ферментативной активности. Активаторы и ингибиторы ферментов. Виды активации и инактивации (частичный протеолиз, ковалентная модификация, действие ионов металлов, ассоциация- диссоциация субъединиц).
Регуляция активности ферментов может осуществляться путём взаимодействия ферментов с различными биологическими компонентами или чужеродными соединениями, которые называются регуляторами ферментов. Они могут либо ускорять, либо замедлять ферментативную реакцию.
Активаторы – это вещества, увеличивающие скорость ферментативной реакции.
Виды активаторов:
Вещества, влияющие на область активного центра. К ним относятся ионы металлов (Na+, K+, Fe2+, Co2+, Cu2+, Ca2+, Zn2+, Mg2+, Mn2+ и др.). В ряде случаев ионы металлов выполняют функцию кофактора фермента. В других случаях они способствуют присоединению субстрата к активному центру фермента.
Аллостерические эффекторы (бывают и активаторы и ингибиторы), которые связываются с аллостерическим (регуляторным) участком апофермента. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению структуры активного центра, что сказывается на связывании и превращении субстрата в активном центре. Аллостерическими эффекторами ферментов наиболее часто выступают различные метаболиты, а также гормоны, ионы металлов, нуклеозиды - АТФ, АДФ, АМФ.
Вещества, вызывающие модификации, не затрагивающие активный центр фермента. Возможно несколько вариантов таких модификаций:
- активация путём присоединения специфической модифицирующей группы к молекуле фермента.
- активация путём перехода неактивного предшественника - профермента в активный фермент за счёт частичного протеолиза.
- активатор вызывает диссоциацию субъединиц фермента, имеющего четвертичную структуру (отщепление одной из субъединиц фермента).
Ингибиторами называют вещества, вызывающие снижение активности фермента. (Сам по себе факт торможения ферментативной реакции в присутствии какого-либо вещества ещё не говорит о том, что это вещество – ингибитор. Любые денатурирующие агенты вызывают инактивацию фермента и торможение ферментативной реакции. Ингибиторы, в отличие от денатурирующих агентов, действуют в малых концентрациях и вызывают специфическое снижение ферментативной активности).
По прочности связывания с ферментом ингибиторы делятся на обратимые и необратимые. Если сильно разбавить раствор фермента с обратимым ингибитором, то их комплекс распадается и активность фермента восстанавливается.
По механизму действия ингибиторы делятся на конкурентные и неконкурентные.
Конкурентные ингибиторы имеют структурное сходство с молекулой субстрата, что позволяет им занять место субстрата в активном центре фермента: E + S + I → EI + S.
Встраиваясь вместо субстрата в активный центр, такой ингибитор не даёт ферментативной реакции осуществиться.
Неконкурентные ингибиторы не имеют структурного сходства с субстратами. Они или связываются с каталитическими группами активного центра фермента, или, связываясь с ферментом вне активного центра, изменяют конформацию активного центра таким образом, что это препятствует превращению субстрата.
E + S + I → ESI
Виды активации и инактивации:
Ограниченный (частичный) протеолиз проферментов.
Н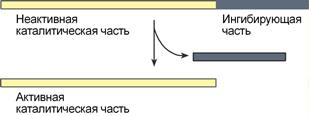 екоторые
ферменты синтезируются в клетке
первоначально неактивными и после
секреции из клетки переходят в активную
форму. Неактивные предшественники
называются проферменты (зимогены). Под
действием активатора происходит
частичный гидролиз профермента с
отщеплением от него неактивного пептида,
в результате чего открывается активный
центр. Так происходит активация ферментов
желудочно-кишечного тракта, переваривающих
белки пищи. Например, фермент пепсиноген,
синтезированный в клетках желудка,
затем в просвете желудка под действием
соляной кислоты превращается в активный
пепсин путём удаления неактивного
участка полипептидной цепи:
екоторые
ферменты синтезируются в клетке
первоначально неактивными и после
секреции из клетки переходят в активную
форму. Неактивные предшественники
называются проферменты (зимогены). Под
действием активатора происходит
частичный гидролиз профермента с
отщеплением от него неактивного пептида,
в результате чего открывается активный
центр. Так происходит активация ферментов
желудочно-кишечного тракта, переваривающих
белки пищи. Например, фермент пепсиноген,
синтезированный в клетках желудка,
затем в просвете желудка под действием
соляной кислоты превращается в активный
пепсин путём удаления неактивного
участка полипептидной цепи:
Ковалентная модификация
Ковалентная модификация — это механизм регуляции активности ферментов за счет присоединения в регуляторном центре фермента с помощью ковалентной связи атомной группировки или отщепления этой группировки. Это приводит к изменению конформации белка-фермента, что сопровождается изменением структуры активного центра и эффективности катализа. Для эффективной работы этого механизма требуется два дополнительных фермента: один фермент обеспечивает присоединение группировки-модулятора к регуляторному ферменту, второй фермент обеспечивает удаление этой группировки.
Отщепление группировки обеспечивает восстановление исходной конформации фермента, а следовательно, и возвращение к исходному уровню его каталитической активности.
В качестве модифицирующих группировок чаще всего выступают остатки фосфорной кислоты. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы.
Например, в мышцах ферменты гликогенфосфорилаза и гликогенсинтаза
при нагрузке фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена и сжигание глюкозы, а гликогенсинтаза при этом неактивна.
в
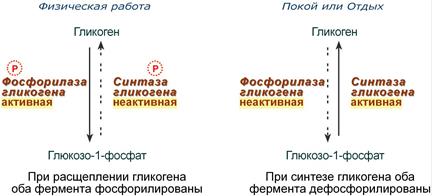 о
время отдыха при синтезе гликогена оба
фермента дефосфорилируются, синтаза
при этом становится активной, фосфорилаза
– неактивной.
о
время отдыха при синтезе гликогена оба
фермента дефосфорилируются, синтаза
при этом становится активной, фосфорилаза
– неактивной.
Действие ионов металлов
Роль ионов металлов в механизме каталитического действия ферментов многообразна и не всегда поддается однозначной интерпретации.
Для одной группы ферментов характерно наличие одного или нескольких прочно связанных ионов металлов, принимающих участие в каталитических процессах (металлоферменты).
Другая группа ферментов не содержит непосредственно связанных ионов металлов, но проявляет каталитическую активность только в их присутствии {металлозависимые или металлоактивируемые ферменты).
Для третьей группы ферментов металлы не являются обязательными участниками каталитической реакции, однако их присутствие в системе влияет на активность ферментов (металлонезависимые ферменты).
В ряде случаев ионы металлов (Со2+, Mg2+, Zn2+, Fe2+) выполняют функции простетических групп ферментов, или служат акцепторами и донаторами электронов. В других случаях они способствуют присоединению субстрата к активному центру и образованию фермент-субстратного комплекса. Наконец, имеются экспериментальные доказательства прямого участия металлов (например, ионов Са2+ в молекуле амилазы слюны) в формировании и стабилизации активного центра и всей трехмерной структуры молекулы фермента.
Ассоциация-диссоциация субъединиц
А ссоциация
и диссоциация характерны для олигомерных
ферментов (имеющих 2 и более субъединиц).
Ассоциация субъединиц чаще всего
приводит к активации фермента, а
диссоциация олигомерного фермента на
отдельные субъединицы в большинстве
случаев ведет к потере ферментом
активности.
ссоциация
и диссоциация характерны для олигомерных
ферментов (имеющих 2 и более субъединиц).
Ассоциация субъединиц чаще всего
приводит к активации фермента, а
диссоциация олигомерного фермента на
отдельные субъединицы в большинстве
случаев ведет к потере ферментом
активности.
Часто ассоциация и диссоциация связаны с процессами фосфорилирования и дефосфорилирования.
