
- •Кафедра биохимии и биоинформатики
- •Глава 1. Понятие о происхождении электронных спектров поглощения. 4
- •Глава 2. Особенности электронных спектров поглощения органических и неорганических соединений в ультрафиолетовой и видимой областях спектра. 5
- •Глава 3. Информация, получаемая о структуре вещества с помощью регистрации электронных спектров. 11
- •Введение
- •Глава 1. Понятие о происхождении электронных спектров поглощения.
- •Глава 2. Особенности электронных спектров поглощения органических и неорганических соединений в ультрафиолетовой и видимой областях спектра.
- •2.1 Органические соединения
- •Р исунок 3 - Схема расположения энергетических уровней и типы электронных переходов в органических молекулах
- •2.2 Неорганические соединения
- •Глава 3. Информация, получаемая о структуре вещества с помощью регистрации электронных спектров.
- •Заключение
- •Список используемой литературы
Глава 2. Особенности электронных спектров поглощения органических и неорганических соединений в ультрафиолетовой и видимой областях спектра.
2.1 Органические соединения
Поглощение органическим веществом излучения с длиной волны 100–800нм (1 нм = 10–9 м) ведет к возбуждению валентных электронов. Регистрируемые спектры называют электронными спектрами поглощения (ЭСП). Эти спектры разделяют на УФ-спектры (100–400 нм) и спектры в видимой области (400–800 нм). Такое разделение обусловлено тем, что поглощение веществом света в интервале 400–800 нм воспринимается зрительным аппаратом человека как цвет.
Электронные спектры поглощения регистрируют на специальных приборах — спектрофотометрах (рис. 2).
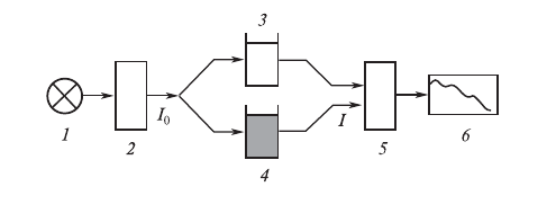
Рисунок 2 – Схема спектрофотометра
1 – источник излучения, 2 – монохроматор, 3 – кювета с исследуемым веществом, 4 – кювета сравнения, 5 – регистрирующее устройство, 6 – самописец.
Современная трактовка природы электронных спектров поглощения основана на молекулярно-орбитальном подходе. Согласно этому подходу, электроны в молекуле находятся на орбиталях со строго определенной энергией.
Относительное расположение энергетических уровней валентных электронов в молекулах органических соединений представлено на рис. 3.
Р исунок 3 - Схема расположения энергетических уровней и типы электронных переходов в органических молекулах
Электроны одинарных связей — σ-электроны — занимают связывающую σ-орбиталь, электроны кратных связей — π-электроны — занимают связыващую π-орбиталь. Электроны неподеленных пар гетероатомов (n-электроны), не участвующие в образовании химической связи, занимают несвязывающую n-орбиталь. В основном состоянии все связывающие и несвязывающие молекулярные орбитали заняты. При поглощении кванта излучения электроны переходят со связывающих и несвязывающих орбиталей на разрыхляющие σ*- или π*-орбитали.
При этом осуществляется тот электронный переход, энергия которого равна энергии кванта поглощенного излучения. В молекуле органического соединения возможны четыре типа электронных переходов: σ → σ*, π → π*, n → σ*, n → π*. Эти типы электронных переходов так же показаны на рис. 3.
Наибольшая энергия необходима для перехода σ → σ*, т. е. для возбуждения электронов наиболее прочной σ-cвязи. Поэтому алканы и циклоалканы, содержащие толь ко σ-cвязи, поглощают излучение с длиной волны λ <200 нм (дальняя УФ-область).
В насыщенных соединениях, содержащих гетероатомы c НЭП (амины, спирты, простые эфиры, тиолы и т. д.), возможны не только σ → σ*-, но и n → σ*-переходы. Соответственно в спектре могут наблюдаться две полосы поглощения. Энергия перехода n → σ* меньше, чем энергия σ → σ*- перехода (см. рис. 3). Следовательно, поглощение, от вечающее n → σ*-переходу, находится в более длинноволновой области — от 170 до 230 нм.
Практическое значение для идентификации органических соединений имеют переходы n → π* и π → π*, поскольку соответствующие им длины волн поглощения попадают в рабочий диапазон прибора от 200 до 1000 нм.
Группы, вызывающие поглощение света в этой области электронного спектра, называют хромофорами. Поглощение в диапазоне от 200 до 1000 нм обусловливают хромофоры, содержащие хотя бы одну кратную связь.
Энергия π → π*-перехода значительно меньше энергии σ → σ*-перехода (см. рис. 3). Поэтому поглощение, со ответствующее π → π*-переходу, наблюдается в более длинно волновой области.
Наличие в молекуле ненасыщенного соединения гетероатома с НЭП делает возможным электронный переход n → π*, имеющий наименьшую энергию в сравнении с другим и электронными переходами.
Переходу n → π* соответствует наиболее длинноволновая полоса поглощения. Полосы поглощения, соответствующие n → π*-переходам, имеют малую интенсивность. Значение коэффициента поглощения ε таких полос обычно ниже 100 и всегда не выше 2000.
