
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ 89
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •1. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •1.2.1 Радикало-функциональная номенклатура
- •1.2.2 Систематическая (заместительная) номенклатура
- •1.3 Вопросы и упражнения для самопроверки:
- •2. ИЗОМЕРИЯ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ
- •2.1 Структурная изомерия
- •2.2 Стереоизомерия
- •2.2.1.1 Геометрическая изомерия или цис-транс-изомерия один из видов стереоизомерии, возникающий при разном расположении одинаковых заместителей по одну или по разные стороны плоскости π связи или неароматического цикла (Рис.2.1).
- •2.2.1.2 Хиральность.
- •2.2.1.3 Оптическая изомерия. Энантиомеры и диастереомеры
- •2.2.1.4 Относительная и абсолютная конфигурации
- •2.2.2.2 Конформации циклических алифатических соединений. Теория напряжения Байера
- •2.3 Вопросы и упражнения для самопроверки
- •3.1. Образование ковалентных связей
- •3.2.3 Ароматичность
- •3.3 Взаимное влияние атомов в молекуле
- •3.3.1 Индуктивный эффект
- •3.3.2 Мезомерный эффект
- •3.4. Вопросы и упражнения для самопроверки
- •4. КИСЛОТНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •4.1 Теория Бренстеда-Лоури, протолитическая
- •4.2. Вопросы и упражнения для самопроверки
- •5. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- •5.1 Механизмы органических реакций
- •5.2.1 Гидратация алкенов. Роль кислотного катализатора
- •5.2.2 Реакции присоединения к асимметричным алкенам (правило Марковникова)
- •5.2.3 Реакция присоединения к α, β-ненасыщенным карбонильным соединениям
- •5.3.1 Галогенирование бензола
- •5.3.2 Ориентирующее действие заместителей в бензольном ядре. Ориентанты первого и второго рода
- •5.4 Нуклеофильное замещение у насыщенного атома углерода
- •5.5 Механизм и стереохимия реакций элиминирования (Е)
- •5.6 Окисление и восстановление органических соединений
- •5.6.1 Окисление гидроксильных и оксо-групп
- •5.6.2 Окисление непредельных и ароматических соединений
- •5.6.3 Реакции восстановления
- •5.6.4 Обратимые окислительно-восстановительныесистемы
- •5.7. Вопросы и упражнения для самопроверки
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- •6.1 Способы получения альдегидов и кетонов
- •6.2 Химические свойства альдегидов и кетонов (карбонильных соединений)
- •6.2.1 Реакция альдегидов с нуклеофилами
- •6.2.1.1 Особенности реакций присоединения к альдегидам и асимметричным кетонам
- •6.2.1.2. Реакции присоединения спиртов. Образование полуацеталей и ацеталей
- •6.2.2 Реакции конденсации
- •6.2.2.1 Кето-енольная таутомерия альдегидов и кетонов. Альдольное присоединение
- •6.2.2.2 Кротоновая конденсация или альдольно - кротоновая конденсация
- •6.3 Окисление и восстановление альдегидов и кетонов
- •6.4 Вопросы и упражнения для самопроверки
- •7. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
- •7.1. Основные пути получения карбоновых кислот:
- •7.2. Малоновый синтез карбоновых кислот
- •7.3. Классификация карбоновых кислот
- •7.4 Химические свойства карбоновых кислот
- •7.4.2. Восстановление карбоновых кислот
- •7.4.3. Декарбоксилирование карбоновых кислот
- •7.5. Дикарбоновые кислоты
- •7.6. Угольная кислота и ее производные
- •7.7. Вопросы и упражнения для самопроверки
- •8. ПОЛИ- И ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ
- •8.1. Аминоспирты
- •8.2 Классификация одноосновных гидроксикислот
- •8.2.1 Получение гидроксикислот
- •8.2.2 Специфические реакции гидроксикислот
- •8.3. Многоосновные гидроксикислоты
- •8.4. Оксокислоты
- •8.5 Вопросы и упражнения для самопроверки
- •9. АМИНОКИСЛОТЫ
- •9.1. Изомерия аминокислот
- •9.2. Классификации аминокислот
- •9.2.1. Классификации аминокислот по биологической ценности
- •9.2.2. Классификации аминокислот на основе химического строения аминокислот
- •9.2.2.3. Современная классификация α-аминокислот
- •9.4. Кислотно-основные свойства аминокислот
- •9.5. Способы получения аминокислот
- •9.6. Химические свойства
- •9.7. Специфические реакции α, β, γ, δ-аминокислот
- •9.8. Качественные реакции на аминокислоты, пептиды, белки.
- •9.9. Методы количественного определения аминокислот
- •9.10. Редко встречающиеся аминокислоты
- •9.11.2 Вторичная структура полипептидной цепи
- •9.11.3 Третичная структура белков
- •9.12. Вопросы и упражнения для самопроверки
- •Классификация углеводов
- •10.1. Моносахариды, классификация
- •10.2. Циклическое строение моносахаридов
- •10.3. Химические свойства моносахаридов
- •10.3.1. Реакции полуацетального гидроксила
- •10.3.3. Окисление и восстановление моносахаридов
- •10.3.4. Изомеризация в щелочной среде
- •10.4. Качественные реакции моносахаридов. Отличительные реакции пентоз и гексоз
- •10.5. Производные моносахаридов
- •10.6. Олигосахариды
- •10.6.1. Химические свойства олигосахаридов
- •10.7. Полисахариды
- •10.7.1. Гомополисахариды
- •10.7.2. Гетерополисахариды
- •10.8. Гликопротеины
- •10.9. Вопросы и упражнения для самопроверки
- •11. БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- •11.1. Пятичленные ароматические гетероциклы
- •11.2. Шестичленный ароматический гетероцикл
- •11. 3. Нуклеиновые кислоты (НК)
- •11.3.1 Нуклеозиды
- •11.3.2. Нуклеотиды
- •11.3.3. Нуклеозидциклофосфаты
- •11.3.4. Рибо- и дезокси-рибонуклеиновые кислоты
- •11.4. Вопросы и упражнения для самопроверки
- •12. ЛИПИДЫ
- •12.1. Высшие жирные кислоты
- •12.2. Классификация омыляемых липидов
- •12.2.1. Простые липиды
- •12.2.1.1.Химические свойства простых липидов
- •12.2.2 Сложные липиды
- •12.2.2.2. Гликолипиды
- •12.3. Неомыляемые липиды
- •12.3.1 Терпены (изопреноиды)
- •12.3.3. Стероиды
- •12.4. Вопросы и упражнения для самопроверки
- •13. Методы, используемые для изучения соединений в органической химии
- •Литература
содержат остатки многоатомных спиртов (глицерина или сфингозина), жирных кислот, фосфорной кислоты и азотистых оснований. В зависимостиотвидаспирта,фосфолипидыподразделяютсянаглицерофосфолипиды и сфингофосфолипиды. Гликолипиды содержат двухатомный ненасыщенный аминоспирт сфингозин, остатки моноили олигосахаридов и жирных кислот.
В живых организмах омыляемые липиды выполняют несколько важных функций. В них запасена энергия, освобождающаяся при окислительном расщеплении. Липиды, наряду с белками, являются основными структурными компонентами клеточных мембран.
12.2.1. Простые липиды
К ним относятся воск, жиры и масла.
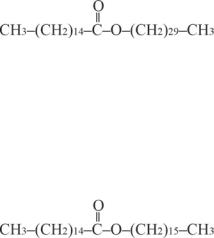
Воски представляют собой смесь сложных эфиров высших одноатомных спиртовивысшихжирныхкислот.Так,пчелиныйвоск состоит в основном из мирицилового эфира пальмитиновой кислоты:
Воски природного происхождения, покрывая поверхность кожи, меха, листьев и плодов, выполняют защитную функцию благодаря их физико-химическимсвойствам. Областиихприменениямногообразны. Цетилпальмитат, спермацет, который получали при охлаждении жидкого животного жира, заключённого в фиброзном спермацетовом мешке в голове кашалота, использовали в парфюмерии и медицине для приготовления мазей:
Жиры и масла (растительные жиры), триацилглицериды, представляют собой сложные эфиры глицерина и высших жирных кислот. Простые триацилглицериды содержат остатки одинаковых
220
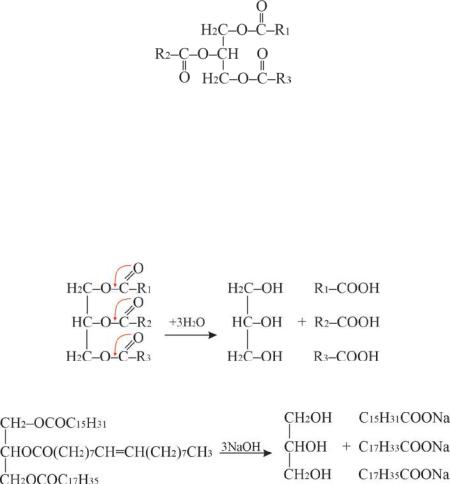
кислот (R1=R2=R3) а смешанные – остатки различных кислот. Твёрдые триацилглицериды содержат в основном остатки насыщенных кислот, а жидкие триацилглицериды – ненасыщенных.
триацилглицерид
12.2.1.1.Химические свойства простых липидов
Гидролиз липидов протекает как в кислой, так и в щелочной средах. Продуктами полного гидролиза простых липидов являются глицерин и смесь высших жирных кислот, в случае щелочного гидролиза – мыла (Рис. 12.3).
(а)
липаза
жир |
глицерин жирные крслоты |
(б)
1-пальмито-2-олеостеарин |
глицерин |
мыла |
Рис. 12.3 Схема гидролиза триацилглицеридов под действием ферментов (а) и в щелочной среде(б)
221
В результате неполного гидролиза триацилглицеридов образуются
моноацилглицерины и диацилглицерины:
Триацилглицерин + H2O |
липаза |
Диацилглицерин |
||||
R1–COOH |
||||||
|
|
|
|
|||
+H2O, липаза |
Моноацилглицерин |
+H2O, липаза |
Глицерин |
|||
R3–COOH |
R2–COOH |
|||||
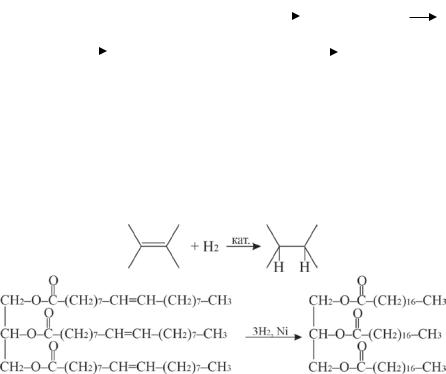
Реакции присоединения протекают по двойным связям остатков ненасыщенных жирных кислот. Большое значение имеет процесс гидрирования (гидрогенизации). В каталитических условиях происходит присоединение водорода к двойным связям, при этом жидкие масла превращаются в твёрдые жиры (получение маргарина) (Рис. 12.4).
Триолеин (жидкий) |
Триcтеарин (твердый) |
Олеиновый триглицерид, |
Стеариновый триглицерид |
Рис. 12.4 Гидрогенизация триолеина
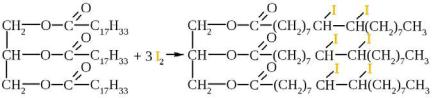
Присоединение йода протекает легко, эта реакция является одной из аналитических характеристик жиров, йодное число, условная величина, характеризующая содержание в 100 г образца двойных связей(непредельных соединений), выраженнаявграммахйода.(Табл.
12.3).
222
|
Йодное число |
Таблица 12.3 |
|
|
|
|
|
|
|
|
|
Жир или |
Иодное число |
Число омыления |
|
масло |
I2(г)/100г. образца |
(мг KOH / 1г. жира) |
|
|
|
|
|
Сливочное |
27 |
220 |
|
|
|
|
|
Свиной жир |
53 |
200 |
|
|
|
|
|
Оливковое |
85 |
192 |
|
|
|
|
|
Кукурузное |
121 |
192 |
|
|
|
|
|
Льняное |
190 |
192 |
|
|
|
|
|
Реакции окисления липидов и высших карбоновых кислот протекают по месту двойных связей. Окисление кислородом воздуха, которое сопровождается гидролизом молекулы триацилглицерина, приводит к образованию низкомолекулярных жирных кислот, в частности, масляной, а также альдегидов.
Перекисное окисление липидов (ПОЛ) – свободнорадикальный цепной процесс, протекающий также в биомембранах и липопротеинах, сопровождающийся окислительной деградацией полиненасыщенных жирных кислот с образованием свободнорадикальных и молекулярных продуктов. Реакции ПОЛ постоянно происходят в организме в норме с низкой скоростью во избежание повреждающего действия. Перекисное окислениелипидовиграетважнуюрольвпроцессеапоптоза,обновления и регулирования структуры мембран и их функций (рецепторов, работе ионных каналов, высвобождении биологически активных веществ,
223
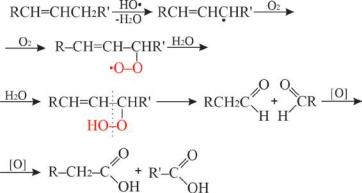
передаче сигналов между клетками и т.д). Чрезмерная активность ПОЛ может приводить к нарушению жизнедеятельности клеток (их преждевременное старение, разрушение, нарушение транспорта веществ, связывания ферментов и рецепторов). Повышенная активность ПОЛ может быть причиной развития сердечно-сосудистых заболеваний (атеросклероза и сопутствующей патологии), поражения ЦНС, воспалительных процессов, заболеваний респираторного тракта, одним из факторов новообразований, нарушения функции иммунной системы. В результате окисления железа (II) в водном растворе и в организме образуются радикалы, атакующие метиленовые группы, расположенные рядом с двойными связями в структуре жирных кислот. В организме цепной процесс инициируются радикалами HO. или HO2., образующимися при окислении иона железа (II) в водной среде кислородом. При атаке таким радикалом по метиленовой группе липида, соседней с двойной связью, получается новый радикал аллильноготипа
(Рис. 12.5).
Рис. 12.5 Схема перекисного окисления липидов
Свободнорадикальные процессы с определенной интенсивностью важны для нормального метаболизма тканей. Однако в условиях активизации процесса развиваются поражения различной природы. Поэтому важно регулировать интенсивность процессов перекисного
224
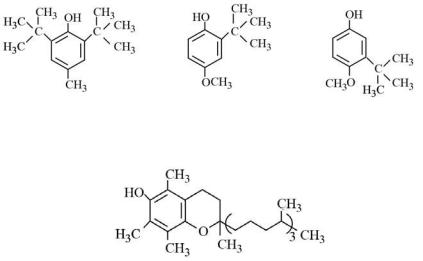
окисления липидов, в том числе антиоксидантную защиту применяемых пищевых продуктов. С этой целью в хранящиеся продукты добавляют антиоксиданты природного и искусственного происхождения, а используемый антиоксидант указывается на упаковке вместе с другими ингредиентами. Наиболее распространенные этикетки включают«BHT» – бутилированныйгидрокситолуол, и«BHA» – бутилированный гидроксианизол:
Оба указанных соединения являются производными фенола, проявляютантиоксидантнуюактивность,взаимодействуютсосвободными радикалами, препятствуя развитию цепной реакции.
витамин Е (альфа-токоферол)
Эти соединения действуют подобно витамину Е (α-токоферол), мощному природному антиоксиданту в организме животных.
β-окисление насыщенных кислот – очень важный процесс.
Окислению кислот предшествует гидролиз сложных эфиров, а затем насыщенные кислоты окисляются с расщеплением углеродного скелета. При окислении жиров выделяется энергия – 37,7 кДж/г (гликоген и крахмал дают 16,7 кДж/г).
225
