
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ 89
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •1. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •1.2.1 Радикало-функциональная номенклатура
- •1.2.2 Систематическая (заместительная) номенклатура
- •1.3 Вопросы и упражнения для самопроверки:
- •2. ИЗОМЕРИЯ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ
- •2.1 Структурная изомерия
- •2.2 Стереоизомерия
- •2.2.1.1 Геометрическая изомерия или цис-транс-изомерия один из видов стереоизомерии, возникающий при разном расположении одинаковых заместителей по одну или по разные стороны плоскости π связи или неароматического цикла (Рис.2.1).
- •2.2.1.2 Хиральность.
- •2.2.1.3 Оптическая изомерия. Энантиомеры и диастереомеры
- •2.2.1.4 Относительная и абсолютная конфигурации
- •2.2.2.2 Конформации циклических алифатических соединений. Теория напряжения Байера
- •2.3 Вопросы и упражнения для самопроверки
- •3.1. Образование ковалентных связей
- •3.2.3 Ароматичность
- •3.3 Взаимное влияние атомов в молекуле
- •3.3.1 Индуктивный эффект
- •3.3.2 Мезомерный эффект
- •3.4. Вопросы и упражнения для самопроверки
- •4. КИСЛОТНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •4.1 Теория Бренстеда-Лоури, протолитическая
- •4.2. Вопросы и упражнения для самопроверки
- •5. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- •5.1 Механизмы органических реакций
- •5.2.1 Гидратация алкенов. Роль кислотного катализатора
- •5.2.2 Реакции присоединения к асимметричным алкенам (правило Марковникова)
- •5.2.3 Реакция присоединения к α, β-ненасыщенным карбонильным соединениям
- •5.3.1 Галогенирование бензола
- •5.3.2 Ориентирующее действие заместителей в бензольном ядре. Ориентанты первого и второго рода
- •5.4 Нуклеофильное замещение у насыщенного атома углерода
- •5.5 Механизм и стереохимия реакций элиминирования (Е)
- •5.6 Окисление и восстановление органических соединений
- •5.6.1 Окисление гидроксильных и оксо-групп
- •5.6.2 Окисление непредельных и ароматических соединений
- •5.6.3 Реакции восстановления
- •5.6.4 Обратимые окислительно-восстановительныесистемы
- •5.7. Вопросы и упражнения для самопроверки
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- •6.1 Способы получения альдегидов и кетонов
- •6.2 Химические свойства альдегидов и кетонов (карбонильных соединений)
- •6.2.1 Реакция альдегидов с нуклеофилами
- •6.2.1.1 Особенности реакций присоединения к альдегидам и асимметричным кетонам
- •6.2.1.2. Реакции присоединения спиртов. Образование полуацеталей и ацеталей
- •6.2.2 Реакции конденсации
- •6.2.2.1 Кето-енольная таутомерия альдегидов и кетонов. Альдольное присоединение
- •6.2.2.2 Кротоновая конденсация или альдольно - кротоновая конденсация
- •6.3 Окисление и восстановление альдегидов и кетонов
- •6.4 Вопросы и упражнения для самопроверки
- •7. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
- •7.1. Основные пути получения карбоновых кислот:
- •7.2. Малоновый синтез карбоновых кислот
- •7.3. Классификация карбоновых кислот
- •7.4 Химические свойства карбоновых кислот
- •7.4.2. Восстановление карбоновых кислот
- •7.4.3. Декарбоксилирование карбоновых кислот
- •7.5. Дикарбоновые кислоты
- •7.6. Угольная кислота и ее производные
- •7.7. Вопросы и упражнения для самопроверки
- •8. ПОЛИ- И ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ
- •8.1. Аминоспирты
- •8.2 Классификация одноосновных гидроксикислот
- •8.2.1 Получение гидроксикислот
- •8.2.2 Специфические реакции гидроксикислот
- •8.3. Многоосновные гидроксикислоты
- •8.4. Оксокислоты
- •8.5 Вопросы и упражнения для самопроверки
- •9. АМИНОКИСЛОТЫ
- •9.1. Изомерия аминокислот
- •9.2. Классификации аминокислот
- •9.2.1. Классификации аминокислот по биологической ценности
- •9.2.2. Классификации аминокислот на основе химического строения аминокислот
- •9.2.2.3. Современная классификация α-аминокислот
- •9.4. Кислотно-основные свойства аминокислот
- •9.5. Способы получения аминокислот
- •9.6. Химические свойства
- •9.7. Специфические реакции α, β, γ, δ-аминокислот
- •9.8. Качественные реакции на аминокислоты, пептиды, белки.
- •9.9. Методы количественного определения аминокислот
- •9.10. Редко встречающиеся аминокислоты
- •9.11.2 Вторичная структура полипептидной цепи
- •9.11.3 Третичная структура белков
- •9.12. Вопросы и упражнения для самопроверки
- •Классификация углеводов
- •10.1. Моносахариды, классификация
- •10.2. Циклическое строение моносахаридов
- •10.3. Химические свойства моносахаридов
- •10.3.1. Реакции полуацетального гидроксила
- •10.3.3. Окисление и восстановление моносахаридов
- •10.3.4. Изомеризация в щелочной среде
- •10.4. Качественные реакции моносахаридов. Отличительные реакции пентоз и гексоз
- •10.5. Производные моносахаридов
- •10.6. Олигосахариды
- •10.6.1. Химические свойства олигосахаридов
- •10.7. Полисахариды
- •10.7.1. Гомополисахариды
- •10.7.2. Гетерополисахариды
- •10.8. Гликопротеины
- •10.9. Вопросы и упражнения для самопроверки
- •11. БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- •11.1. Пятичленные ароматические гетероциклы
- •11.2. Шестичленный ароматический гетероцикл
- •11. 3. Нуклеиновые кислоты (НК)
- •11.3.1 Нуклеозиды
- •11.3.2. Нуклеотиды
- •11.3.3. Нуклеозидциклофосфаты
- •11.3.4. Рибо- и дезокси-рибонуклеиновые кислоты
- •11.4. Вопросы и упражнения для самопроверки
- •12. ЛИПИДЫ
- •12.1. Высшие жирные кислоты
- •12.2. Классификация омыляемых липидов
- •12.2.1. Простые липиды
- •12.2.1.1.Химические свойства простых липидов
- •12.2.2 Сложные липиды
- •12.2.2.2. Гликолипиды
- •12.3. Неомыляемые липиды
- •12.3.1 Терпены (изопреноиды)
- •12.3.3. Стероиды
- •12.4. Вопросы и упражнения для самопроверки
- •13. Методы, используемые для изучения соединений в органической химии
- •Литература
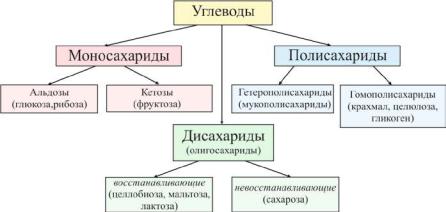
10. УГЛЕВОДЫ Классификация углеводов
Углеводы широко распространены в природе, являются компонентами всех клеток живых организмов и выполняют разнообразные функции.
Углеводы являются поставщиками энергии, конструкционными материалами, субстратами и регуляторами биохимических процессов. Углеводы– первичные продукты фотосинтеза (изCO2 и воды) и являются «мостом» между неорганическими и органическими веществами.
Углеводы условно делят на моносахариды, олигосахариды и полисахариды. В основе такого деления лежит способность молекул углеводов подвергаться гидролизу и результаты гидролиза. Более детальная классификация приведена на рис.10.1
Рис. 10.1 Классификация углеводов
Моносахариды – это простейшие углеводы, не гидролизующиеся с образованием более простых углеводов (глюкоза, фруктоза и др).
Олигосахаридами называются углеводы, гидролизующиеся с образованием 2-10 молекул моносахаридов (сахароза, лактоза и др).
166
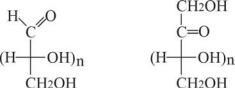
Полисахаридами называются высокомолекулярные углеводы, при гидролитическом расщеплении которых получаются сотни и тысячи молекул моносахаридов и их производных (гликоген, крахмал, гепарин и др).
Олиго- и полисахаридные цепи часто входят в состав смешанных биополимеров, из которых особенно важную роль играют гликопротеины. Углеводные компоненты входят в состав сложных липидов (цереброзидов, ганглиозидов).
10.1. Моносахариды, классификация
Моносахариды – это полигидроксикарбонильные соединения (полигидроксиалъдегиды и полигидроксикетоны).
альдозы (n=1-7) |
кетозы (n=1-6) |
Моносахариды классифицируются по:
а) характеру карбонильной группы: с группой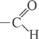 (альдозы), с
(альдозы), с
группой > С = О (кетозы), б) числу атомов С в цепи.
По числу атомов углерода моносахариды подразделяются на триозы, тетрозы, пентозы, гексозы, гептозы и т.д., Следовательно, с
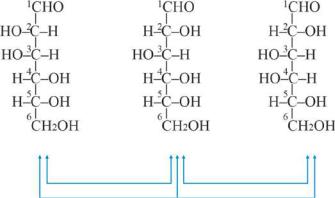
учётом обоих признаков, эти моносахариды делятся на альдозы и кетозы. Семейство альдоз представлено на рис .10.2.
В молекулах моносахаридов обычно содержится несколько хиральных центров.
167
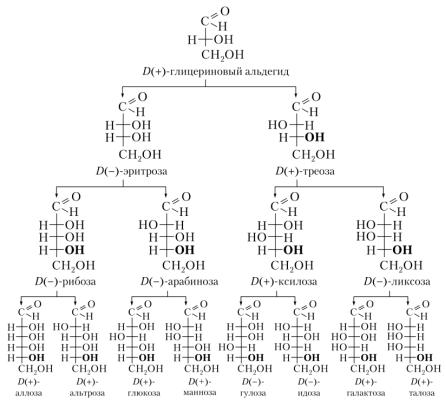
Рис. 10.2 Структура представителей семейства D -альдоз
Это служит причиной существования большого числа стереоизомеров, соответствующих одной и той же структурной формуле (Рис10.2). Конкретное название моносахарида определяется конфигурацией всех асимметрических атомов углерода.
Принадлежность к D- или L- рядам определяется по конфигурации последнего асимметрического атома С (сравнивается с конфигурацией D- глицеринового альдегида). Число стереоизомеров определяется по формуле 2n, где «n» число асимметрических атомов углерода. У альдопентоз (n=3) имеется 8 (2 3) стереоизомеров (4 зеркальные пары энантиомеров), а у альдогексоз (n=4) –16 (24) стереоизомеров (8 пар
168
энантиомеров). В природе моносахариды D- ряда встречаются гораздо чаще, хотя известны и L - моносахариды.
Кроме оптических изомеров– энантиомеров, являющихся зеркальными отображениями, моносахариды существуют также в виде диастереомеров, т.е. таких изомеров, которые не являются зеркальными отражениями друг друга (см. раздел 2.2.1.3). Если оптические изомеры отличаются конфигурацией только одного из асимметрических атомов, такие изомеры называются эпимерами, например, глюкоза и галактоза.
D-маноза |
D-глюкоза |
D-галактоза |
эпимеры эпимеры
диастереомеры
Для изображения стереоизомеров моносахаридов используются проекционные формулы Фишера. Знак вращения плоскости поляризации света моносахаридами не связан с их принадлежностью к D и L- рядам. Он определяется экспериментально. Так, среди альдопентоз и альдогексоз D-стереохимического ряда имеются как лево-, так и правовращающие соединения.
10.2. Циклическое строение моносахаридов
Открытым строением моносахаридов невозможно было объяснить все химические свойства моносахаридов. Было доказано, что моно-
169
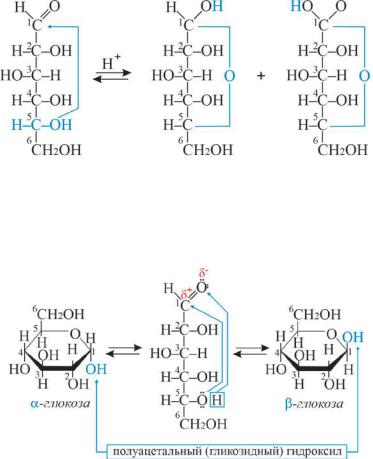
сахариды, будучи гидроксикарбонильными соединениями, самопроизвольно превращаются в полуацетали, которые имеют циклическое строение.Так, вглюкозе, в клешневидной конформации, карбонильная группа и спиртовая группа 5-ого углеродного атома сближаются и нуклеофильный атом кислорода (например, гидроксила при С-5) атакует электрофильный атом С карбонильной группы.
D-глюкоза |
α-D-глюкопираноза |
β-D-глюкопираноза |
В результате циклизации атом С-1 становится асимметрическим. «ОН» группа, которая образуется при циклизации, называется полуацетальной (гликозидной) и может находиться как над, так и под плоскостью цикла, а углерод карбонильной группы называется аномерным.
циклическая |
альдегидная |
циклическая |
полуацетальная |
форма глюкозы |
полуацетальная |
форма глюкозы |
|
форма глюкозы |
|
170 |
|
Оба стереоизомера не являются зеркальным отражением один другого. Они диастереомеры и называются аномерами. Для моносахаридов D-ряда принято считать α-аномером тот изомер, ОН группа которого находится под плоскостью цикла, и β-аномером – над плоскостью цикла.
Еслициклическаяформаобразуетсяза счётгидроксильнойгруппы С-5, образуется шестичленный цикл (пиранозный); если за счёт гидроксильной группы С-4, образуются пятичленные циклы (фуранозные).
Циклические формы моносахаридов принято изображать в виде плоских многоугольников, так называемых перспективных формул Хеуорса. Заместители, находящиеся слева от углеродной цепи в проекции Фишера, в формуле Хеуорса располагают над плоскостью цикла; заместители, расположенные справа – под плоскостью. В формулах пираноз атом О в цикле изображают в правом углу, атом С-1 дляальдоз
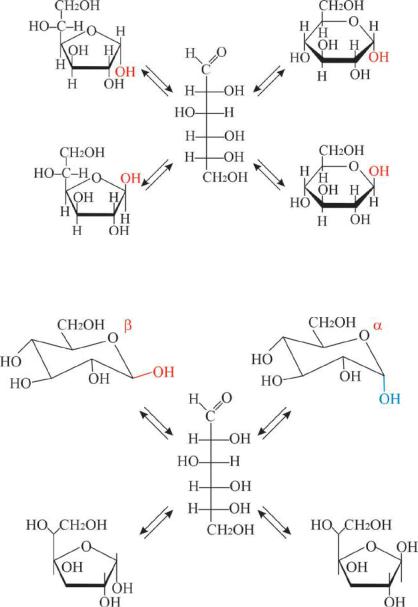
– справа. В растворе имеются все пять форм моносахаридов, которые находятся в динамическом равновесии (Рис. 10.3). Причиной образования равновесной смеси линейной и циклических форм моносахаридов является цикло-оксо-таутомерия. Конформационный анализ показывает, что D-глюкопираноза – наиболее устойчивый стереоизомер альдогексоз; в ней СН2ОН и все ОН группы (за исключением полуацетальной группы α-аномера) занимают экваториальное положение, поэтому в растворах преобладают именно пиранозные формы (Рис. 10.4). Характерной особенностью водных растворов моносахаридов является мутаротация – изменение величины угла вращения плоскости поляризованного света свежеприготовленных растворов при стоянии. Мутаротация обусловлена цикло-оксо- таутомерией. Соотношение таутомеров различно для каждого моносахарида. Более устойчивы пиранозные формы. Но и формулы Хеуорса не полностью отражают строение моносахаридов, так как шестичленный пиранозный цикл неплоский. Наиболее устойчивая конформация цикла – кресло (Рис. 10.4).
171
α-D-глюкофураноза |
α-D-глюкопираноза (36%) |
D-глюкоза |
|
(ациклическая форма) |
|
β-D-глюкофураноза |
β-D-глюкопираноза (64%) |
Рис. 10.3 Схема цикло-оксо-таутомерных превращений глюкозы
β-D-глюкопираноза(64%)
α-D-глюкопираноза(36%)
α-D- глюкофураноза |
β-D- глюкофураноза |
Рис. 10.4 Конформационный состав D-глюкопираноз
172
