
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ 89
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •1. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •1.2.1 Радикало-функциональная номенклатура
- •1.2.2 Систематическая (заместительная) номенклатура
- •1.3 Вопросы и упражнения для самопроверки:
- •2. ИЗОМЕРИЯ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ
- •2.1 Структурная изомерия
- •2.2 Стереоизомерия
- •2.2.1.1 Геометрическая изомерия или цис-транс-изомерия один из видов стереоизомерии, возникающий при разном расположении одинаковых заместителей по одну или по разные стороны плоскости π связи или неароматического цикла (Рис.2.1).
- •2.2.1.2 Хиральность.
- •2.2.1.3 Оптическая изомерия. Энантиомеры и диастереомеры
- •2.2.1.4 Относительная и абсолютная конфигурации
- •2.2.2.2 Конформации циклических алифатических соединений. Теория напряжения Байера
- •2.3 Вопросы и упражнения для самопроверки
- •3.1. Образование ковалентных связей
- •3.2.3 Ароматичность
- •3.3 Взаимное влияние атомов в молекуле
- •3.3.1 Индуктивный эффект
- •3.3.2 Мезомерный эффект
- •3.4. Вопросы и упражнения для самопроверки
- •4. КИСЛОТНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •4.1 Теория Бренстеда-Лоури, протолитическая
- •4.2. Вопросы и упражнения для самопроверки
- •5. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- •5.1 Механизмы органических реакций
- •5.2.1 Гидратация алкенов. Роль кислотного катализатора
- •5.2.2 Реакции присоединения к асимметричным алкенам (правило Марковникова)
- •5.2.3 Реакция присоединения к α, β-ненасыщенным карбонильным соединениям
- •5.3.1 Галогенирование бензола
- •5.3.2 Ориентирующее действие заместителей в бензольном ядре. Ориентанты первого и второго рода
- •5.4 Нуклеофильное замещение у насыщенного атома углерода
- •5.5 Механизм и стереохимия реакций элиминирования (Е)
- •5.6 Окисление и восстановление органических соединений
- •5.6.1 Окисление гидроксильных и оксо-групп
- •5.6.2 Окисление непредельных и ароматических соединений
- •5.6.3 Реакции восстановления
- •5.6.4 Обратимые окислительно-восстановительныесистемы
- •5.7. Вопросы и упражнения для самопроверки
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- •6.1 Способы получения альдегидов и кетонов
- •6.2 Химические свойства альдегидов и кетонов (карбонильных соединений)
- •6.2.1 Реакция альдегидов с нуклеофилами
- •6.2.1.1 Особенности реакций присоединения к альдегидам и асимметричным кетонам
- •6.2.1.2. Реакции присоединения спиртов. Образование полуацеталей и ацеталей
- •6.2.2 Реакции конденсации
- •6.2.2.1 Кето-енольная таутомерия альдегидов и кетонов. Альдольное присоединение
- •6.2.2.2 Кротоновая конденсация или альдольно - кротоновая конденсация
- •6.3 Окисление и восстановление альдегидов и кетонов
- •6.4 Вопросы и упражнения для самопроверки
- •7. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
- •7.1. Основные пути получения карбоновых кислот:
- •7.2. Малоновый синтез карбоновых кислот
- •7.3. Классификация карбоновых кислот
- •7.4 Химические свойства карбоновых кислот
- •7.4.2. Восстановление карбоновых кислот
- •7.4.3. Декарбоксилирование карбоновых кислот
- •7.5. Дикарбоновые кислоты
- •7.6. Угольная кислота и ее производные
- •7.7. Вопросы и упражнения для самопроверки
- •8. ПОЛИ- И ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ
- •8.1. Аминоспирты
- •8.2 Классификация одноосновных гидроксикислот
- •8.2.1 Получение гидроксикислот
- •8.2.2 Специфические реакции гидроксикислот
- •8.3. Многоосновные гидроксикислоты
- •8.4. Оксокислоты
- •8.5 Вопросы и упражнения для самопроверки
- •9. АМИНОКИСЛОТЫ
- •9.1. Изомерия аминокислот
- •9.2. Классификации аминокислот
- •9.2.1. Классификации аминокислот по биологической ценности
- •9.2.2. Классификации аминокислот на основе химического строения аминокислот
- •9.2.2.3. Современная классификация α-аминокислот
- •9.4. Кислотно-основные свойства аминокислот
- •9.5. Способы получения аминокислот
- •9.6. Химические свойства
- •9.7. Специфические реакции α, β, γ, δ-аминокислот
- •9.8. Качественные реакции на аминокислоты, пептиды, белки.
- •9.9. Методы количественного определения аминокислот
- •9.10. Редко встречающиеся аминокислоты
- •9.11.2 Вторичная структура полипептидной цепи
- •9.11.3 Третичная структура белков
- •9.12. Вопросы и упражнения для самопроверки
- •Классификация углеводов
- •10.1. Моносахариды, классификация
- •10.2. Циклическое строение моносахаридов
- •10.3. Химические свойства моносахаридов
- •10.3.1. Реакции полуацетального гидроксила
- •10.3.3. Окисление и восстановление моносахаридов
- •10.3.4. Изомеризация в щелочной среде
- •10.4. Качественные реакции моносахаридов. Отличительные реакции пентоз и гексоз
- •10.5. Производные моносахаридов
- •10.6. Олигосахариды
- •10.6.1. Химические свойства олигосахаридов
- •10.7. Полисахариды
- •10.7.1. Гомополисахариды
- •10.7.2. Гетерополисахариды
- •10.8. Гликопротеины
- •10.9. Вопросы и упражнения для самопроверки
- •11. БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- •11.1. Пятичленные ароматические гетероциклы
- •11.2. Шестичленный ароматический гетероцикл
- •11. 3. Нуклеиновые кислоты (НК)
- •11.3.1 Нуклеозиды
- •11.3.2. Нуклеотиды
- •11.3.3. Нуклеозидциклофосфаты
- •11.3.4. Рибо- и дезокси-рибонуклеиновые кислоты
- •11.4. Вопросы и упражнения для самопроверки
- •12. ЛИПИДЫ
- •12.1. Высшие жирные кислоты
- •12.2. Классификация омыляемых липидов
- •12.2.1. Простые липиды
- •12.2.1.1.Химические свойства простых липидов
- •12.2.2 Сложные липиды
- •12.2.2.2. Гликолипиды
- •12.3. Неомыляемые липиды
- •12.3.1 Терпены (изопреноиды)
- •12.3.3. Стероиды
- •12.4. Вопросы и упражнения для самопроверки
- •13. Методы, используемые для изучения соединений в органической химии
- •Литература

9.5. Способы получения аминокислот
Лабораторные методы получения аминокислот:
1) Циангидринныйсинтезведутсоченьбольшимизбытком аммиака с последующим гидролизом полученного аминонитрила в аминокислоту. Этим способом возможен синтез только α-аминокислот:
циангридрин α-аминонитрил
α- аминокислота
2) Аммонолиз α-галогенкарбоновых кислот:
2-аминокарбоновая кислота
хлоруксусная кислота |
аминоуксусная кислота |
|
(глицин) |
В организме биосинтез α-аминокислот осуществляется из α-кето- кислот – продуктов метаболизма углеводов. Возможны два пути превращения кетокислот в аминокислоты.
Восстановительное аминирование (in vivo) приводит к образованию только L-аминокислот, что обусловлено стереоспецифическим строением ферментов, катализирующих данные реакции. Восстановительное аминирование кетокислот идет с участием фермента, имеющего в качестве кофермента НАДН +H
α-кетокислота α-аминокислота
142
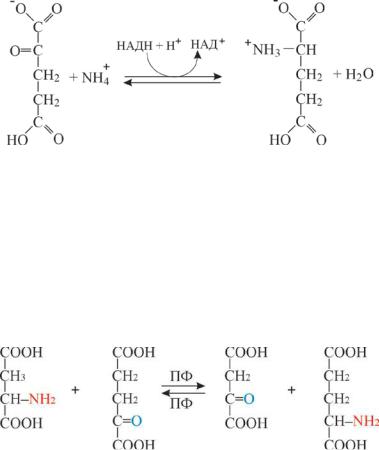
При восстановительном аминировании α-кетокислот присоединение аммиака происходит с одновременным их восстановлением, с образованием аминокислот. В качестве α-кетокислот чаще участвуют пировиноградная кислота, которая восстанавливается в аланин, щавелевоуксусная, переходящая в аспарагиновую кислоту и α – кетоглутаровая кислота, восстанавливающаяся в глутаминовую кислоту:
α - кетоглутаровая кислота |
глутаминовая кислота |
Трансаминирование – основной путь биосинтеза α-аминокислот. Реакция протекает с участием ферментов трансаминаз и кофермента пиридоксальфосфата. Фактически переаминирование сводится к взаимномуобменудвухфункциональныхгрупп– аминнойикарбонильной, то есть ферментативная реакция обратимого переноса аминогруппы с аминокислоты на кетокислоту (α-кетоглутаровую или оксалоацетат) без промежуточного образования аммиака (Рис 9.2).
аспартат α - кетоглутарат оксалоацетат глутамат
143
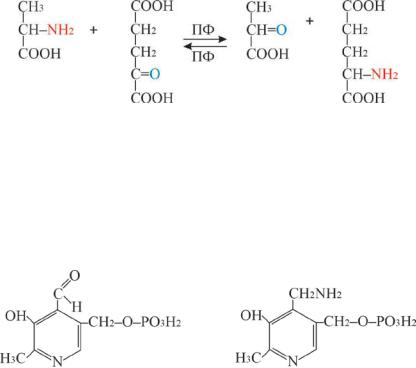
аланин α- кетоглутарат пируват глутамат
Рис. 9.2 Схема ферментативной реакции переноса аминогруппы
саминокислоты на кетокислоту без промежуточного образования аммиака
Вэтом процессе пиридоксальфосфат используется как временное хранилище аминогруппы для передачи ее от α-аминокислоты к кетокислоте:
пиридоксальфосфат (ПФ) пиридоксаминфосфат
9.6. Химические свойства
Аминокислоты являются амфотерными соединениями, так как содержат и кислотную и основную группу. Аминокислотам присущи все свойства как карбоновых кислот, так и аминов. В частности,
образованиесолейсоснованиями,образованиеэфиров,галогенангидридов, амидов благодаря присутствию карбоксильной группы, а также образование солей с сильными кислотами, образование оснований Шиффа, амидов за счет наличия аминогруппы.
Поэтому α-аминокислоты образуют соли как со щелочами, так и с кислотами:
144
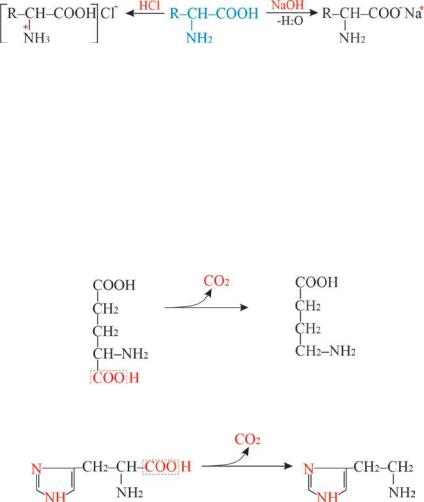
гидрохлорид α-аминокислоты α-аминокислота |
натриевая соль |
|
α-аминокислоты |
Ряд специфических реакций обусловлен наличием СООН и NН2 групп у одного и того же атома углерода. В основном это ферментативные реакции.
1) Декарбоксилирование α-аминокислот При декарбоксилировании ряда α-аминокислот в организме, с
участием фермента декарбоксилазы, образуются биогенные амины (γ-аминомасляная кислота, гистамин):
декарбоксилаза
ПФ (vit B6)
глутаминовая кислота |
γ-аминомасляная кислота |
|
Декарбоксилаза |
|
гистдина |
|
ПФ (vit B6) |
гистидин |
гистамин |
2) Дезаминирование (удаление NН3).
Дезаминирование - это важный путь превращения аминокислот в соответствующие α-кетокислоты в результате отщепления амино-
145
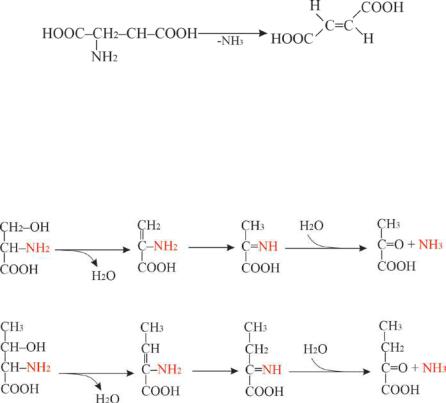
группы в виде аммиака. Дезаминирование может быть неокислительным и окислительным. Неокислительное дезаминирование характерно для бактерий, грибов. Потеря аминогруппы без участия кислорода происходит путём отщепления аммиака под действием ферментов с образованием α, β-непредельных кислот:
аспартаза
аспарагиновая кислота |
фумаровая кислота |
В печени человека присутствуют специфические пиридоксальфосфатзависимые ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот серина и треонина. В случае серина в результате образуется пировиноградная кислота (пируват), а треонина – α-кетобутират:
сериндегидра-
таза ПФ
серин |
пируват |
треониндегидра
таза ПФ
треонин |
α-кетобутират |
Окислительное дезаминирование происходит с участием фер-
ментов оксидаз с выделением NНз и образованием соответствующей α-кетокислоты:
146
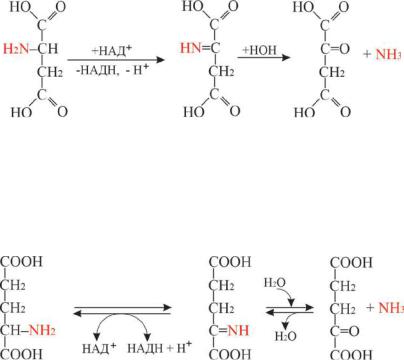
аспарагиновая |
α-иминоянтарная |
щавелевоуксусная |
кислота |
кислота |
кислота |
В тканях наиболее активно происходит дезаминирование глутаминовой кислоты с участием фермента глутаматдегидрогеназы (обратимый процесс):
глутаматдегидрогеназа
глутамат |
α-иминоглутарат |
α-кетоглутарат |
Вышеприведённые пути дезаминирования осуществляются только ферментативным путём.
3) Гидроксилирование некоторых аминокислот, с образованием аминокислот играющих важную роль как в составе белков, так и в качестве субстратов для образования биогенных аминов, осуществляется в организме и не имеет аналогий в химии in vitro (например, гидроксилирование фенилаланина в тирозин(см. главу 5.6.2).
4) Образование амидов, являющихся важнейшими среди производных аминокислот (два из них входят в состав белков):
147
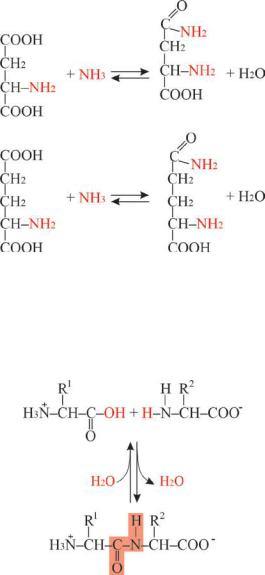
аспарагин
аспарагиновая кислота
глутаминовая кислота |
глутамин |
В белках и пептидах аминокислоты связаны пептидной связью(вид амиднойсвязи), возникающейпривзаимодействииα-аминогруппы одной аминокислоты скарбоксильной группой другой. Схематически образование пептидной связи показано на рис.9.3.
Рис.9.3 Образование пептидной связи
148
Таблица 9.1
Названия аминокислот, аминокислотных радикалов в пептидах
Однобуквен- |
Трехбуквен- |
|
Полное |
Название |
ное |
ное |
|
название |
радикала в |
обозначение |
обозначение |
|
аминокислоты |
пептидах |
|
|
|
|
|
A |
Ala |
|
Аланин |
Аланил |
R |
Arg |
|
Аргинин |
Аргинил |
N |
Asn |
|
Аспарагин |
Аспарагинил |
D |
Asp |
|
Аспарагиновая |
Аспартил |
|
кислота |
|||
|
|
|
|
|
C |
Cys |
|
Цистеин |
Цистеинил |
Q |
Gln |
|
Глутамин |
Глутаминил |
E |
Glu |
|
Глутаминовая |
Глутамил |
|
кислота |
|||
|
|
|
|
|
G |
Gly |
|
Глицин |
Глицил |
H |
His |
|
Гистидин |
Гистидил |
I |
Ile |
|
Изолейцин |
Изолейцил |
L |
Leu |
|
Лейцин |
Лейцил |
K |
Lys |
|
Лизин |
Лизил |
M |
Met |
|
Метионин |
Метионил |
F |
Phe |
|
Фенилаланин |
Фенилаланил |
P |
Pro |
|
Пролин |
Пролил |
S |
Ser |
|
Серин |
Серил |
T |
Thr |
|
Треонин |
Треонил |
W |
Trp |
|
Триптофан |
Триптофанил |
|
(триптофил) |
|||
|
|
|
|
|
Y |
Tyr |
|
Тирозин |
Тирозил |
V |
Val |
|
Валин |
Валил |
|
|
149 |
|
|
