
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ 89
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •1. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •1.2.1 Радикало-функциональная номенклатура
- •1.2.2 Систематическая (заместительная) номенклатура
- •1.3 Вопросы и упражнения для самопроверки:
- •2. ИЗОМЕРИЯ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ
- •2.1 Структурная изомерия
- •2.2 Стереоизомерия
- •2.2.1.1 Геометрическая изомерия или цис-транс-изомерия один из видов стереоизомерии, возникающий при разном расположении одинаковых заместителей по одну или по разные стороны плоскости π связи или неароматического цикла (Рис.2.1).
- •2.2.1.2 Хиральность.
- •2.2.1.3 Оптическая изомерия. Энантиомеры и диастереомеры
- •2.2.1.4 Относительная и абсолютная конфигурации
- •2.2.2.2 Конформации циклических алифатических соединений. Теория напряжения Байера
- •2.3 Вопросы и упражнения для самопроверки
- •3.1. Образование ковалентных связей
- •3.2.3 Ароматичность
- •3.3 Взаимное влияние атомов в молекуле
- •3.3.1 Индуктивный эффект
- •3.3.2 Мезомерный эффект
- •3.4. Вопросы и упражнения для самопроверки
- •4. КИСЛОТНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •4.1 Теория Бренстеда-Лоури, протолитическая
- •4.2. Вопросы и упражнения для самопроверки
- •5. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- •5.1 Механизмы органических реакций
- •5.2.1 Гидратация алкенов. Роль кислотного катализатора
- •5.2.2 Реакции присоединения к асимметричным алкенам (правило Марковникова)
- •5.2.3 Реакция присоединения к α, β-ненасыщенным карбонильным соединениям
- •5.3.1 Галогенирование бензола
- •5.3.2 Ориентирующее действие заместителей в бензольном ядре. Ориентанты первого и второго рода
- •5.4 Нуклеофильное замещение у насыщенного атома углерода
- •5.5 Механизм и стереохимия реакций элиминирования (Е)
- •5.6 Окисление и восстановление органических соединений
- •5.6.1 Окисление гидроксильных и оксо-групп
- •5.6.2 Окисление непредельных и ароматических соединений
- •5.6.3 Реакции восстановления
- •5.6.4 Обратимые окислительно-восстановительныесистемы
- •5.7. Вопросы и упражнения для самопроверки
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- •6.1 Способы получения альдегидов и кетонов
- •6.2 Химические свойства альдегидов и кетонов (карбонильных соединений)
- •6.2.1 Реакция альдегидов с нуклеофилами
- •6.2.1.1 Особенности реакций присоединения к альдегидам и асимметричным кетонам
- •6.2.1.2. Реакции присоединения спиртов. Образование полуацеталей и ацеталей
- •6.2.2 Реакции конденсации
- •6.2.2.1 Кето-енольная таутомерия альдегидов и кетонов. Альдольное присоединение
- •6.2.2.2 Кротоновая конденсация или альдольно - кротоновая конденсация
- •6.3 Окисление и восстановление альдегидов и кетонов
- •6.4 Вопросы и упражнения для самопроверки
- •7. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
- •7.1. Основные пути получения карбоновых кислот:
- •7.2. Малоновый синтез карбоновых кислот
- •7.3. Классификация карбоновых кислот
- •7.4 Химические свойства карбоновых кислот
- •7.4.2. Восстановление карбоновых кислот
- •7.4.3. Декарбоксилирование карбоновых кислот
- •7.5. Дикарбоновые кислоты
- •7.6. Угольная кислота и ее производные
- •7.7. Вопросы и упражнения для самопроверки
- •8. ПОЛИ- И ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ
- •8.1. Аминоспирты
- •8.2 Классификация одноосновных гидроксикислот
- •8.2.1 Получение гидроксикислот
- •8.2.2 Специфические реакции гидроксикислот
- •8.3. Многоосновные гидроксикислоты
- •8.4. Оксокислоты
- •8.5 Вопросы и упражнения для самопроверки
- •9. АМИНОКИСЛОТЫ
- •9.1. Изомерия аминокислот
- •9.2. Классификации аминокислот
- •9.2.1. Классификации аминокислот по биологической ценности
- •9.2.2. Классификации аминокислот на основе химического строения аминокислот
- •9.2.2.3. Современная классификация α-аминокислот
- •9.4. Кислотно-основные свойства аминокислот
- •9.5. Способы получения аминокислот
- •9.6. Химические свойства
- •9.7. Специфические реакции α, β, γ, δ-аминокислот
- •9.8. Качественные реакции на аминокислоты, пептиды, белки.
- •9.9. Методы количественного определения аминокислот
- •9.10. Редко встречающиеся аминокислоты
- •9.11.2 Вторичная структура полипептидной цепи
- •9.11.3 Третичная структура белков
- •9.12. Вопросы и упражнения для самопроверки
- •Классификация углеводов
- •10.1. Моносахариды, классификация
- •10.2. Циклическое строение моносахаридов
- •10.3. Химические свойства моносахаридов
- •10.3.1. Реакции полуацетального гидроксила
- •10.3.3. Окисление и восстановление моносахаридов
- •10.3.4. Изомеризация в щелочной среде
- •10.4. Качественные реакции моносахаридов. Отличительные реакции пентоз и гексоз
- •10.5. Производные моносахаридов
- •10.6. Олигосахариды
- •10.6.1. Химические свойства олигосахаридов
- •10.7. Полисахариды
- •10.7.1. Гомополисахариды
- •10.7.2. Гетерополисахариды
- •10.8. Гликопротеины
- •10.9. Вопросы и упражнения для самопроверки
- •11. БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- •11.1. Пятичленные ароматические гетероциклы
- •11.2. Шестичленный ароматический гетероцикл
- •11. 3. Нуклеиновые кислоты (НК)
- •11.3.1 Нуклеозиды
- •11.3.2. Нуклеотиды
- •11.3.3. Нуклеозидциклофосфаты
- •11.3.4. Рибо- и дезокси-рибонуклеиновые кислоты
- •11.4. Вопросы и упражнения для самопроверки
- •12. ЛИПИДЫ
- •12.1. Высшие жирные кислоты
- •12.2. Классификация омыляемых липидов
- •12.2.1. Простые липиды
- •12.2.1.1.Химические свойства простых липидов
- •12.2.2 Сложные липиды
- •12.2.2.2. Гликолипиды
- •12.3. Неомыляемые липиды
- •12.3.1 Терпены (изопреноиды)
- •12.3.3. Стероиды
- •12.4. Вопросы и упражнения для самопроверки
- •13. Методы, используемые для изучения соединений в органической химии
- •Литература
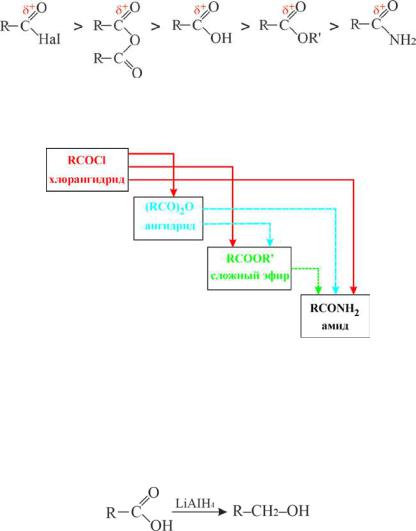
Следовательно, из производных карбоновых кислот, представленных в ряду слева возможно образование производных карбоновых кислот, находящихся справа:
7.4.2. Восстановление карбоновых кислот
Восстановление карбоновых кислот протекает с большим трудом. Обычные восстановители в этих условиях не эффективны. Алюмогидрид лития (очень сильный восстановитель) превращает карбоновые кислоты в соответствующие спирты:
7.4.3. Декарбоксилирование карбоновых кислот
Важной для организма реакцией карбоновых кислот является декарбоксилирование. Установлено, что декарбоксилирование монокарбоновых насыщенных кислот, как правило, протекает в жестких
113
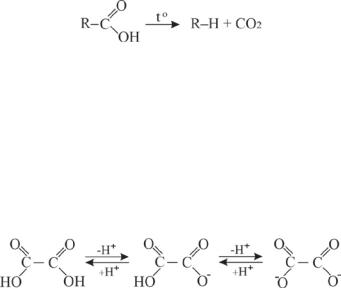
условиях. Декарбоксилирование облегчается для кислот, содержащих в α-положении электроноакцепторные группы (обладающие –I и –М эффектами).
7.5. Дикарбоновые кислоты
Дикарбоновые кислоты имеют две константы ионизации, поскольку содержат две карбоксильные группы. Когда две карбоксильные группы расположены в молекуле рядом, как например в щавелевой (этандиовой) кислоте, то значения рК1 и рК2 заметно различаются: рК1<рК2. Это происходит потому, что одна недиссоциированная карбоксильная группа действует как электроноакцепторный заместитель, повышая кислотность другой группы:
pK1 = 1.1 |
pK2 = 4.2 |
В то же время рК 2 намного больше, чем рК1, поскольку отрицательный заряд на анионе препятствует следующей ступени ионизации, в результате которой образуется вторая отрицательно заряженная группа на близкомрасстоянииотпервой.Чемдальшенаходятсядруг от друга карбоксильные группы (т.е. чем длиннее углеродная цепь), тем ближе друг к другу значения рК1 и рК2.
Дикарбоновые кислоты имеют химические свойства, подобные монокарбоновым кислотам, т.е. участвуют в реакциях образования солей, сложных эфиров, ацилгалогенидов, амидов, а также в реакциях декарбоксилирования.
Щавелевая (C2H2O4) и малоновая кислоты (СН2(СO2Н)2)
достаточно сильные органические кислоты и при нагревании легко декарбоксилируются благодаря электроотрицательному эффекту
114
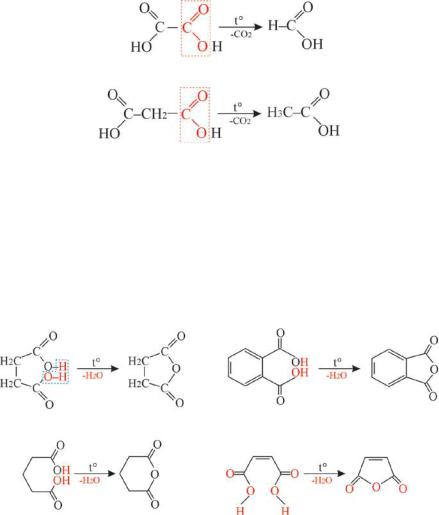
второй карбоксильной группы в составе молекулы:
щавелевая кислота |
муравьиная кислота |
малоновая кислота |
уксусная кислота |
Янтарная кислота (СН2СO2Н)2 (бутандиовая кислота) широко распространена в живой ткани, являясь промежуточным соединением в цикле тракарбоновых кислот. Отличительным свойством янтарной, глутаровой, малеиновой и фталевой кислот от других дикарбоновых кислотявляетсяобразованиеимициклическихангидридовпринагревании
(Рис. 7.7).
|
|
янтарный |
|
|
фталевый |
|
|
|
фталевая |
||
янтарная |
|
||||
|
ангидрид |
|
ангидрид |
||
кислота |
|
|
кислота |
||
|
|
|
|
||
|
|
|
|
|
|
глутаровая |
|
|
|
малеиновый |
|
глутаровый |
малеиновая |
||
|
|
|
ангидрид |
|
кислота |
|
ангидрид |
||
|
кислота |
Рис. 7.7 Схемы образования циклических ангидридов при нагревании некоторых дикарбоновых кислот
115
7.6. Угольная кислота и ее производные
Угольная кислота и ее функциональные производные благодаря определенному структурному сходству с карбоновыми кислотами и их функциональными производными, а также роли в биологических системах, также рассматриваются в этой главе.
Фосген (COCl2 ), дихлорангидрид угольной кислоты, жидкость c низкойтемпературойкипения (Ткип. = 8,2OС)изапахом прелого сенаили гнилыхяблок,оченьядовит,вызываетотек легких, применяетсякакБОВ (боевое отравляющее веществоудушающего действия).
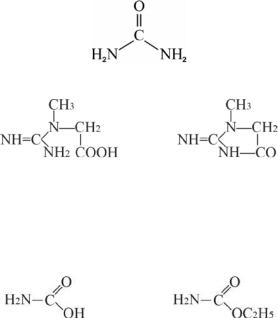
Угольная кислота образует два ряда амидов: кислые (карбаминовая кислота) и средние (мочевина и ее производные). Мочевина (карбамид)- полный амид угольной кислоты, важнейший азотсодержащий конечный продукт обмена белков у человека:
мочевина (карбамид)
креатин креатинин
Амино- и алкоксипроизводные угольной кислоты имеют широкий спектр применения. Например, этиловый эфир карбаминовой кислоты (уретан, наркотическое соединение) обладает анальгетическими свойствами и применяется для анестезии:
карбаминовая кислота |
уретан |
116
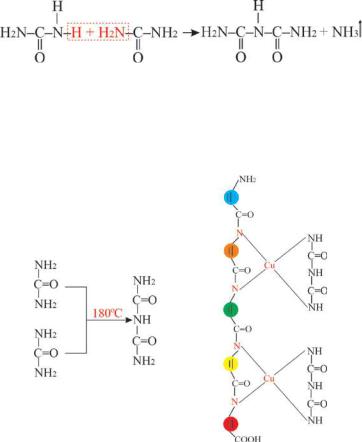
В условиях медленного нагревания мочевинывыделяется аммиак и образуется биурет, который образует пурпурное хелатное
мочевина биурет
комплексное соединение с двухвалентным ионом меди (II) в основной среде (биуретовая реакция) (Рис.7.8а).
2H2N–CO–NH–CO–NH2 + Cu(OH)2 + 2NaOH
розово-лиловый цвет
Рис. 7.8 (а ) Биуретовая реакция
Биуретовая реакция используется для качественного и количественного определения в белках пептидных связей, которые в щелочной среде образуют с сульфатом меди (ІІ) окрашенные солеобразные комплексы (7.8 б).
117
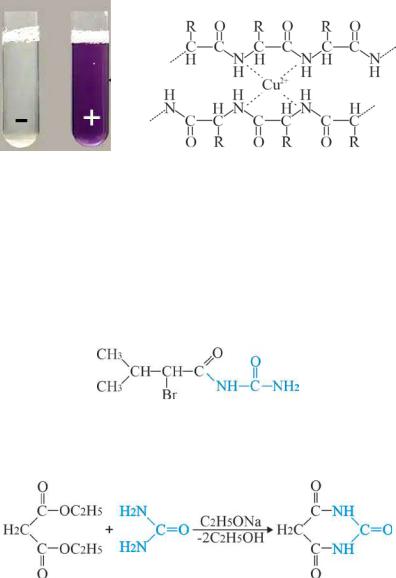
Рис. 7.8 (б) биуретовая реакция
Уреиды и уреидокислоты
Наибольшийинтересвмедицинепредставляютзамещенныепроизводные мочевины и карбоновых кислот, уреиды и уреидокислоты. Уреиды - это соединения, в которых ОН-группа карбоксильной группы карбоновой кислоты заменена остатком мочевины. Например, уреид бромизовалериановой кислоты бромурал, или бромизовал обладает слабым снотворным эффектом:
уреид бромизовалериановой кислоты
При нагревании диэтилмалоната с мочевиной вприсутствии этоксида натрия образуется циклический уреидбарбитуровая кислота:
диэтиловый эфир |
мочевина |
барбитуровая кислота |
малоновой кислоты |
|
|
|
|
118 |
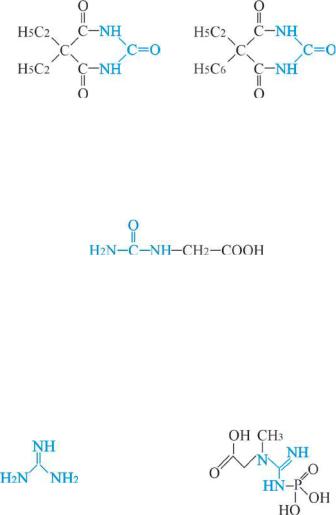
Благодаря подвижным водородам метиленовой группы это очень сильная кислота. Барбитуровая кислота является родоначальным соединением огромного ряда седативных средств, например, 5,5- диэтилбарбитуровой кислоты (веронала) и 5-этил-5-фенилбарбитуро- вой кислоты, фенобарбитала (люминала):
веронал люминал
Циклические уреиды, барбитуровая кислота и ее производные, веронал, люминал и др. имеют широкую область применения.
Уреидокислоты – это такие соединения, в которых водород углеводородного радикала заменен остатком мочевины, например,
Гидантоиновая кислота
Гуанидин
Одним из производных мочевины является гуанидин, который по структуре является иминомочевиной и обладает основными свойствами. Остаток гуанидина входит в состав аминокислоты аргинина, макроэргического соединения – креатинфосфата (участвующего в запасании энергии в мышечной ткани):
гуанидин
креатинфосфат
119
