
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ 89
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •1. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •1.2.1 Радикало-функциональная номенклатура
- •1.2.2 Систематическая (заместительная) номенклатура
- •1.3 Вопросы и упражнения для самопроверки:
- •2. ИЗОМЕРИЯ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ
- •2.1 Структурная изомерия
- •2.2 Стереоизомерия
- •2.2.1.1 Геометрическая изомерия или цис-транс-изомерия один из видов стереоизомерии, возникающий при разном расположении одинаковых заместителей по одну или по разные стороны плоскости π связи или неароматического цикла (Рис.2.1).
- •2.2.1.2 Хиральность.
- •2.2.1.3 Оптическая изомерия. Энантиомеры и диастереомеры
- •2.2.1.4 Относительная и абсолютная конфигурации
- •2.2.2.2 Конформации циклических алифатических соединений. Теория напряжения Байера
- •2.3 Вопросы и упражнения для самопроверки
- •3.1. Образование ковалентных связей
- •3.2.3 Ароматичность
- •3.3 Взаимное влияние атомов в молекуле
- •3.3.1 Индуктивный эффект
- •3.3.2 Мезомерный эффект
- •3.4. Вопросы и упражнения для самопроверки
- •4. КИСЛОТНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •4.1 Теория Бренстеда-Лоури, протолитическая
- •4.2. Вопросы и упражнения для самопроверки
- •5. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- •5.1 Механизмы органических реакций
- •5.2.1 Гидратация алкенов. Роль кислотного катализатора
- •5.2.2 Реакции присоединения к асимметричным алкенам (правило Марковникова)
- •5.2.3 Реакция присоединения к α, β-ненасыщенным карбонильным соединениям
- •5.3.1 Галогенирование бензола
- •5.3.2 Ориентирующее действие заместителей в бензольном ядре. Ориентанты первого и второго рода
- •5.4 Нуклеофильное замещение у насыщенного атома углерода
- •5.5 Механизм и стереохимия реакций элиминирования (Е)
- •5.6 Окисление и восстановление органических соединений
- •5.6.1 Окисление гидроксильных и оксо-групп
- •5.6.2 Окисление непредельных и ароматических соединений
- •5.6.3 Реакции восстановления
- •5.6.4 Обратимые окислительно-восстановительныесистемы
- •5.7. Вопросы и упражнения для самопроверки
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- •6.1 Способы получения альдегидов и кетонов
- •6.2 Химические свойства альдегидов и кетонов (карбонильных соединений)
- •6.2.1 Реакция альдегидов с нуклеофилами
- •6.2.1.1 Особенности реакций присоединения к альдегидам и асимметричным кетонам
- •6.2.1.2. Реакции присоединения спиртов. Образование полуацеталей и ацеталей
- •6.2.2 Реакции конденсации
- •6.2.2.1 Кето-енольная таутомерия альдегидов и кетонов. Альдольное присоединение
- •6.2.2.2 Кротоновая конденсация или альдольно - кротоновая конденсация
- •6.3 Окисление и восстановление альдегидов и кетонов
- •6.4 Вопросы и упражнения для самопроверки
- •7. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
- •7.1. Основные пути получения карбоновых кислот:
- •7.2. Малоновый синтез карбоновых кислот
- •7.3. Классификация карбоновых кислот
- •7.4 Химические свойства карбоновых кислот
- •7.4.2. Восстановление карбоновых кислот
- •7.4.3. Декарбоксилирование карбоновых кислот
- •7.5. Дикарбоновые кислоты
- •7.6. Угольная кислота и ее производные
- •7.7. Вопросы и упражнения для самопроверки
- •8. ПОЛИ- И ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ
- •8.1. Аминоспирты
- •8.2 Классификация одноосновных гидроксикислот
- •8.2.1 Получение гидроксикислот
- •8.2.2 Специфические реакции гидроксикислот
- •8.3. Многоосновные гидроксикислоты
- •8.4. Оксокислоты
- •8.5 Вопросы и упражнения для самопроверки
- •9. АМИНОКИСЛОТЫ
- •9.1. Изомерия аминокислот
- •9.2. Классификации аминокислот
- •9.2.1. Классификации аминокислот по биологической ценности
- •9.2.2. Классификации аминокислот на основе химического строения аминокислот
- •9.2.2.3. Современная классификация α-аминокислот
- •9.4. Кислотно-основные свойства аминокислот
- •9.5. Способы получения аминокислот
- •9.6. Химические свойства
- •9.7. Специфические реакции α, β, γ, δ-аминокислот
- •9.8. Качественные реакции на аминокислоты, пептиды, белки.
- •9.9. Методы количественного определения аминокислот
- •9.10. Редко встречающиеся аминокислоты
- •9.11.2 Вторичная структура полипептидной цепи
- •9.11.3 Третичная структура белков
- •9.12. Вопросы и упражнения для самопроверки
- •Классификация углеводов
- •10.1. Моносахариды, классификация
- •10.2. Циклическое строение моносахаридов
- •10.3. Химические свойства моносахаридов
- •10.3.1. Реакции полуацетального гидроксила
- •10.3.3. Окисление и восстановление моносахаридов
- •10.3.4. Изомеризация в щелочной среде
- •10.4. Качественные реакции моносахаридов. Отличительные реакции пентоз и гексоз
- •10.5. Производные моносахаридов
- •10.6. Олигосахариды
- •10.6.1. Химические свойства олигосахаридов
- •10.7. Полисахариды
- •10.7.1. Гомополисахариды
- •10.7.2. Гетерополисахариды
- •10.8. Гликопротеины
- •10.9. Вопросы и упражнения для самопроверки
- •11. БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- •11.1. Пятичленные ароматические гетероциклы
- •11.2. Шестичленный ароматический гетероцикл
- •11. 3. Нуклеиновые кислоты (НК)
- •11.3.1 Нуклеозиды
- •11.3.2. Нуклеотиды
- •11.3.3. Нуклеозидциклофосфаты
- •11.3.4. Рибо- и дезокси-рибонуклеиновые кислоты
- •11.4. Вопросы и упражнения для самопроверки
- •12. ЛИПИДЫ
- •12.1. Высшие жирные кислоты
- •12.2. Классификация омыляемых липидов
- •12.2.1. Простые липиды
- •12.2.1.1.Химические свойства простых липидов
- •12.2.2 Сложные липиды
- •12.2.2.2. Гликолипиды
- •12.3. Неомыляемые липиды
- •12.3.1 Терпены (изопреноиды)
- •12.3.3. Стероиды
- •12.4. Вопросы и упражнения для самопроверки
- •13. Методы, используемые для изучения соединений в органической химии
- •Литература
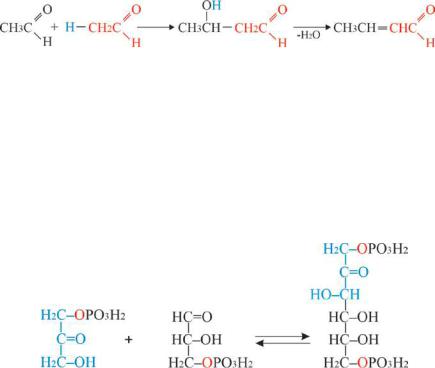
6.2.2.2 Кротоновая конденсация или альдольно - кротоновая конденсация
На первой стадии механизм идентичен описанному в отношении альдольной конденсации. На второй стадии происходит отщепление воды отполученногоальдолясобразованиемнепредельного альдегида. В случае ацетальдегидов образуется кротоновый альдегид (Рис. 6.5).
3- гидроксибутаналь |
кротоновый |
(альдоль) |
альдегид |
Рис. 6.5. Схема механизма кротоновой конденсации
Реакции альдольного присоединения очень важны в метаболизме, особенно в углеводном обмене веществ. Например, альдольная конденсация фосфоглицеринового альдегида с диоксиацетонфосфатом легкопротекаетпод влияниемфермента альдолазы.Врезультате реакции соединения двух триоз (С3) образуется 1.6-дифосфо- фруктоза:
диоксиацетон- |
глицеральдегид- |
фруктозо-1,6- |
фосфат |
3-фосфат |
дифосфат |
6.3 Окисление и восстановление альдегидов и кетонов
Альдегиды легко окисляются в соответствующие карбоновые кислоты в отличие от кетонов, которые вступают в реакции окисления с большим трудом. Окисление альдегидов можно провести как с
99
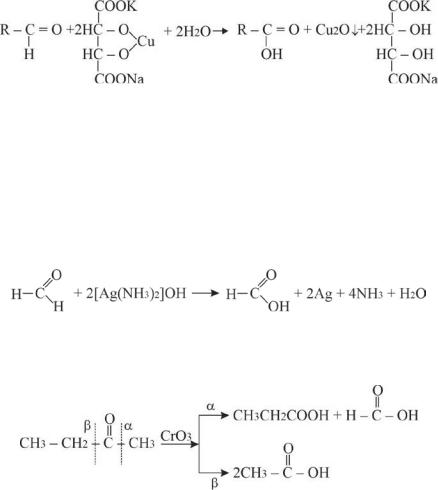
помощью обычных сильных окислителей (хромовая кислота, перманганат калия, азотная кислота), так и под действием слабых окислителей (щелочныерастворысоединениймеди(II) илисеребра(I)). Этиреакции называют качественными реакциями на альдегиды. Наиболее часто применяются реакция Феллинга и реакция серебряного зеркала, Толленса:
|
оксид |
|
меди (I) |
|
(красный) |
реакция Феллинга |
натрий-калий |
(синий) |
виннокислый |
|
(сегнетова соль) |
|
Реакция Феллинга |
Реактив Феллинга, щелочной раствор комплексного тартрата меди (II), иреактивТолленса(аммиачныйрастворнитратасеребра)окисляют простые альдегиды, образуя оксид меди (I) и металлическое серебро (реакция серебряного зеркала) соответственно:
Реакция серебряного зеркала
Окисление кетонов протекает с большим трудом, в присутствии сильных окислителей, с разрывом С – С связей:
100

Галоформная реакция
Расщепление соединений, содержащих ацетильную группу (уксусный альдегид, ацетон), под действием щелочи и галогена с образованием галоформа (хлороформ, бромоформ или йодоформ), называется галоформной реакцией. Если в качестве реагентов используютсяйодигидроксиднатрия,врезультатереакциисуксусным альдегидом образуется йодоформ, органическое соединение с химической формулой СНІ3, с сильным характерным запахом:
|
|
|
|
|
|
|
|
|
|
|
δ− I δ+ |
δ+ O δ− |
|
|
|||||||||||||
|
|
|
O |
3I2; 3NaOH I |
I |
O |
|
|
|
||||||||||||||||||
|
|
|
|
C C |
|
|
|
|
δ− I |
|
C |
|
C |
|
|
|
|
|
|||||||||
CH3 |
|
C |
|
|
H |
|
|
H |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
-3NaI; -3H2O |
I |
|
|
δ− I |
|
|
|
|
|||||||||||||||||
|
|
|
H |
|
|
|
|||||||||||||||||||||
уксусный альдегид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
NaOH |
|
CHI3 +HCOONa |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
йодоформ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Йодоформ применяется |
|
в |
качестве |
|
антисептика; хлоро- |
|||||||||||||||||||||
форм (СНCl3), душистая и сильно летучая жидкость, широко используется в анестезиологии.
Восстановление карбонильных соединений
Следует помнить, что степень окисления любого атома углерода в органических соединениях равна алгебраической сумме числа всех его связей с атомами более электроотрицательных элементов (кислород, азот), учитываемых со знаком (+), и числа связей с атомами водорода, учитываемых со знаком (-). Связи с соседними атомами углерода не учитываются.
В карбонильной группе альдегидов и кетонов «карбонильный» атомуглерода находитсявпромежуточнойстепениокисления; поэтому карбонильная группа может быть, как окислена, так и восстановлена. Альдегиды восстанавливаются в первичные спирты, кетоны – во вторичные, водородом, в присутствии катализатора (Ni), при этом восстанавливается и двойная углерод-углеродная связь. С
101
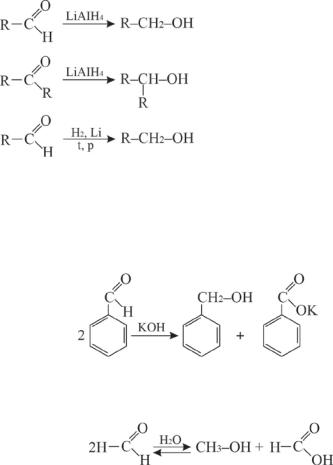
помощью алюмогидрида лития LiAlH4, восстановление происходит, не затрагивая двойные углерод-углеродные связи:
первичный спирт
вторичный спирт
первичный спирт
Альдегиды, не имеющие α-водородных атомов, в присутствии концентрированных щелочей вступают в реакцию Канницаро, в результате которой происходит самоокисление и самовосстановление альдегидной группы (реакция диспропорционирования):
Однако в случае формальдегида реакция протекает в водной среде. При этом образуются муравьиная кислота и метанол:
102
