
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ 89
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •1. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •1.2.1 Радикало-функциональная номенклатура
- •1.2.2 Систематическая (заместительная) номенклатура
- •1.3 Вопросы и упражнения для самопроверки:
- •2. ИЗОМЕРИЯ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ
- •2.1 Структурная изомерия
- •2.2 Стереоизомерия
- •2.2.1.1 Геометрическая изомерия или цис-транс-изомерия один из видов стереоизомерии, возникающий при разном расположении одинаковых заместителей по одну или по разные стороны плоскости π связи или неароматического цикла (Рис.2.1).
- •2.2.1.2 Хиральность.
- •2.2.1.3 Оптическая изомерия. Энантиомеры и диастереомеры
- •2.2.1.4 Относительная и абсолютная конфигурации
- •2.2.2.2 Конформации циклических алифатических соединений. Теория напряжения Байера
- •2.3 Вопросы и упражнения для самопроверки
- •3.1. Образование ковалентных связей
- •3.2.3 Ароматичность
- •3.3 Взаимное влияние атомов в молекуле
- •3.3.1 Индуктивный эффект
- •3.3.2 Мезомерный эффект
- •3.4. Вопросы и упражнения для самопроверки
- •4. КИСЛОТНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •4.1 Теория Бренстеда-Лоури, протолитическая
- •4.2. Вопросы и упражнения для самопроверки
- •5. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- •5.1 Механизмы органических реакций
- •5.2.1 Гидратация алкенов. Роль кислотного катализатора
- •5.2.2 Реакции присоединения к асимметричным алкенам (правило Марковникова)
- •5.2.3 Реакция присоединения к α, β-ненасыщенным карбонильным соединениям
- •5.3.1 Галогенирование бензола
- •5.3.2 Ориентирующее действие заместителей в бензольном ядре. Ориентанты первого и второго рода
- •5.4 Нуклеофильное замещение у насыщенного атома углерода
- •5.5 Механизм и стереохимия реакций элиминирования (Е)
- •5.6 Окисление и восстановление органических соединений
- •5.6.1 Окисление гидроксильных и оксо-групп
- •5.6.2 Окисление непредельных и ароматических соединений
- •5.6.3 Реакции восстановления
- •5.6.4 Обратимые окислительно-восстановительныесистемы
- •5.7. Вопросы и упражнения для самопроверки
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- •6.1 Способы получения альдегидов и кетонов
- •6.2 Химические свойства альдегидов и кетонов (карбонильных соединений)
- •6.2.1 Реакция альдегидов с нуклеофилами
- •6.2.1.1 Особенности реакций присоединения к альдегидам и асимметричным кетонам
- •6.2.1.2. Реакции присоединения спиртов. Образование полуацеталей и ацеталей
- •6.2.2 Реакции конденсации
- •6.2.2.1 Кето-енольная таутомерия альдегидов и кетонов. Альдольное присоединение
- •6.2.2.2 Кротоновая конденсация или альдольно - кротоновая конденсация
- •6.3 Окисление и восстановление альдегидов и кетонов
- •6.4 Вопросы и упражнения для самопроверки
- •7. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
- •7.1. Основные пути получения карбоновых кислот:
- •7.2. Малоновый синтез карбоновых кислот
- •7.3. Классификация карбоновых кислот
- •7.4 Химические свойства карбоновых кислот
- •7.4.2. Восстановление карбоновых кислот
- •7.4.3. Декарбоксилирование карбоновых кислот
- •7.5. Дикарбоновые кислоты
- •7.6. Угольная кислота и ее производные
- •7.7. Вопросы и упражнения для самопроверки
- •8. ПОЛИ- И ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ
- •8.1. Аминоспирты
- •8.2 Классификация одноосновных гидроксикислот
- •8.2.1 Получение гидроксикислот
- •8.2.2 Специфические реакции гидроксикислот
- •8.3. Многоосновные гидроксикислоты
- •8.4. Оксокислоты
- •8.5 Вопросы и упражнения для самопроверки
- •9. АМИНОКИСЛОТЫ
- •9.1. Изомерия аминокислот
- •9.2. Классификации аминокислот
- •9.2.1. Классификации аминокислот по биологической ценности
- •9.2.2. Классификации аминокислот на основе химического строения аминокислот
- •9.2.2.3. Современная классификация α-аминокислот
- •9.4. Кислотно-основные свойства аминокислот
- •9.5. Способы получения аминокислот
- •9.6. Химические свойства
- •9.7. Специфические реакции α, β, γ, δ-аминокислот
- •9.8. Качественные реакции на аминокислоты, пептиды, белки.
- •9.9. Методы количественного определения аминокислот
- •9.10. Редко встречающиеся аминокислоты
- •9.11.2 Вторичная структура полипептидной цепи
- •9.11.3 Третичная структура белков
- •9.12. Вопросы и упражнения для самопроверки
- •Классификация углеводов
- •10.1. Моносахариды, классификация
- •10.2. Циклическое строение моносахаридов
- •10.3. Химические свойства моносахаридов
- •10.3.1. Реакции полуацетального гидроксила
- •10.3.3. Окисление и восстановление моносахаридов
- •10.3.4. Изомеризация в щелочной среде
- •10.4. Качественные реакции моносахаридов. Отличительные реакции пентоз и гексоз
- •10.5. Производные моносахаридов
- •10.6. Олигосахариды
- •10.6.1. Химические свойства олигосахаридов
- •10.7. Полисахариды
- •10.7.1. Гомополисахариды
- •10.7.2. Гетерополисахариды
- •10.8. Гликопротеины
- •10.9. Вопросы и упражнения для самопроверки
- •11. БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- •11.1. Пятичленные ароматические гетероциклы
- •11.2. Шестичленный ароматический гетероцикл
- •11. 3. Нуклеиновые кислоты (НК)
- •11.3.1 Нуклеозиды
- •11.3.2. Нуклеотиды
- •11.3.3. Нуклеозидциклофосфаты
- •11.3.4. Рибо- и дезокси-рибонуклеиновые кислоты
- •11.4. Вопросы и упражнения для самопроверки
- •12. ЛИПИДЫ
- •12.1. Высшие жирные кислоты
- •12.2. Классификация омыляемых липидов
- •12.2.1. Простые липиды
- •12.2.1.1.Химические свойства простых липидов
- •12.2.2 Сложные липиды
- •12.2.2.2. Гликолипиды
- •12.3. Неомыляемые липиды
- •12.3.1 Терпены (изопреноиды)
- •12.3.3. Стероиды
- •12.4. Вопросы и упражнения для самопроверки
- •13. Методы, используемые для изучения соединений в органической химии
- •Литература
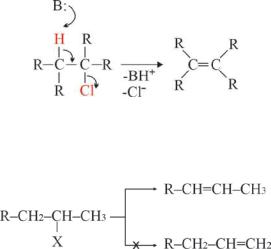
Необходимо также отметить, что в реакциях элиминирования всегда образуется более замещенный алкен, посколькупромежуточный карбкатион тем более стабилен, чем более замещён:
Вприведенномпримерепреимущественнопроисходитотщепление атома водорода в β-положении с образованием более замещённого алкена.
5.6 Окисление и восстановление органических соединений
Реакции окисления и восстановления имеют большое значение в процессах метаболизма, окислительном фосфорилировании, что составляет основу клеточного дыхания. Энергия которая выделяется в результате окисления питательных веществ, запасается в форме высокоэнергетических соединений, таких как АТФ, а затем расходуется в процессе метаболизма. Реакции окисления являются одним из этапов детоксикации и выведения ксенобиотиков из организма.
В органической химии под окислением понимают процесс удаления из молекулы атомов водорода, потерю (перенос) электронов или образование более полярных связей из менее полярных. В качестве примера можно привести следующий окислительно-восстановитель- ный ряд:
81

|
[O] |
|
[O] |
|
|
O |
[O] |
H |
|
O |
[O] |
|
CO2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
CH4 [H] |
CH3OH |
[H] |
H C H |
[H] |
|
C OH |
|
|
|||||
|
|
|
оксид |
||||||||||
метан |
метанол |
|
формаль- |
|
муравьиная |
|
|||||||
|
|
углерода (IV) |
|||||||||||
|
|
|
|
|
дегид |
|
кислота |
||||||
|
|
|
|
|
|
|
|
|
|||||
Существует несколько механизмов окислительно-восстановитель- ныхреакций:I) Прямойпереносэлектрона(одноэлектронныйперенос).
Например, окислительно-восстановительная пара Fe2+ -1e Fe3+ может отдавать свои электроны любому восстанавливающемуся соединению.
Fe3+ может отдавать свои электроны любому восстанавливающемуся соединению.
II) Перенос атома водорода (свободнорадикальный разрыв связи).
III) Перенос электронов от донора к акцептору в форме гидрид иона Н–.
IV) Перенос электронов при прямом взаимодействии органических восстановителей с кислородом, приводящий к продукту с ковалентно-связанным кислородом:
Подобный процесс имеет место при алифатическом гидроксилировании, ответственным за биотрансформацию лекарственных средств. Благодаря этому процессу происходит повышение полярности и гидрофильности лекарственных средств, что способствует их выведению из организма.
Взаимодействие лекарственных средств с кислородом происходит в микросомах. Алифатическому гидроксилированию подвергаются, например, бутамид, хлорпропамид, диазепам и другие ксенобиотики.
82
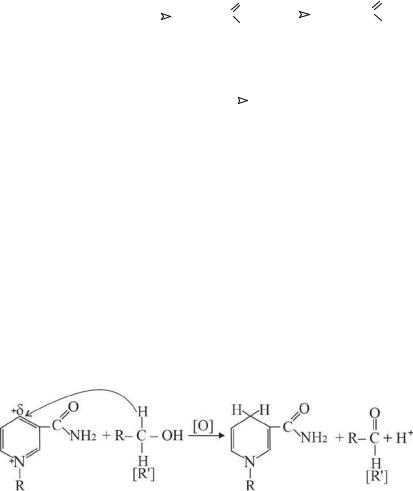
5.6.1 Окисление гидроксильных и оксо-групп
Спирты обладают большей способностью к окислению, чем насыщенные углеводороды:
|
|
H |
|
|
[O] |
|
|
|
|
|
O |
|
[O] |
|
|
|
|
|
|
|
|
O |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
C |
|
|
|
|
|
CH3 |
|
C |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
CH CH O H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
этанол |
|
H |
|
этаналь |
|
|
|
уксусная кислота |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
[O] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
C |
|
COOH |
|
|
|
|
|
CH |
|
C |
|
COOH |
|
|||||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
O |
|
||||||||||
|
|
|
молочная кислота |
|
|
|
|
|
пировиноградная кислота |
|
||||||||||||||||||||||
В приведённых выше представлены схемы окисления соединений, содержащих гидроксильные группы у первичного (этанол) и вторичного (молочная кислота) атомов углерода. В этих реакциях происходит разрыв С–Н связи. В образовавшейся при окислении молочной кислоты пировиноградной кислоте атом углерода, подвергающийся окислению, не связан с атомами водорода. В таком случае окисление идёт с трудом в очень жёстких условиях и с разрывом С–С связи. Следовательно, третичные спирты и кетонные группы устойчивы к окислению.
Указанныевышереакциикатализируютсяферментами,такназываемыми НАД+ – зависимыми дегидрогеназами. Реакции окисления с участием НАД+ происходят по механизму гидридного переноса.
НАД+ R-аденинди- |
окисляющийся |
НАДН+H+ |
нуклеотид |
субстрат |
|
Рис. 5.10 Схема переноса гидрид иона с участием НАД+-зависимых дегидрогеназ
83
Присоединение гидрид-иона приводит к образованию восстановленной формы – НАДН (Рис. 5.10). Очевидно, что НАДН может выступать в роли поставщика гидрид иона, т.е. участвовать в реакциях восстановления. С участием НАД+ протекает также окислительное дезаминирование α-аминокислот (см раздел 8.6).
С помощью этих реакций осуществляется катаболизм α-амино- кислот в организме, а освобождающийся аммиак включается в цикл мочевинообразования.
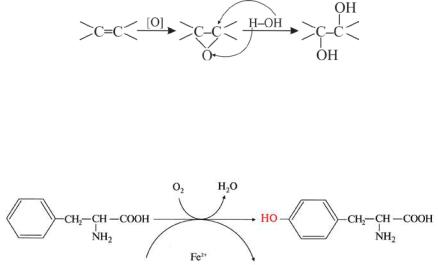
5.6.2 Окисление непредельных и ароматических соединений
Окисление С=С связей в организме происходит ферментными системами мембран эндоплазматического ретикулума гепатоцитов при участии цитохрома Р450 и приводит к образованию эпоксидов.
алкен |
эпоксид |
диол |
Гидролиз эпоксидов приводит к образованию диолов.
В организме человека синтез заменимой α-аминокислоты тирозина происходит путем ароматического гидроксилирования незаменимой α- аминокислоты фенилаланина:
|
фенилаланин- |
|
фенилаланин |
гидроксилаза |
|
тирозин |
||
|
Реакция протекает сначала с образованием эпоксида, который превращается в σ-комплскс. При дальнейшем переходе протона к кислороду ароматичность восстанавливается:
84
