
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ 89
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •1. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •1.2.1 Радикало-функциональная номенклатура
- •1.2.2 Систематическая (заместительная) номенклатура
- •1.3 Вопросы и упражнения для самопроверки:
- •2. ИЗОМЕРИЯ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ МОЛЕКУЛ
- •2.1 Структурная изомерия
- •2.2 Стереоизомерия
- •2.2.1.1 Геометрическая изомерия или цис-транс-изомерия один из видов стереоизомерии, возникающий при разном расположении одинаковых заместителей по одну или по разные стороны плоскости π связи или неароматического цикла (Рис.2.1).
- •2.2.1.2 Хиральность.
- •2.2.1.3 Оптическая изомерия. Энантиомеры и диастереомеры
- •2.2.1.4 Относительная и абсолютная конфигурации
- •2.2.2.2 Конформации циклических алифатических соединений. Теория напряжения Байера
- •2.3 Вопросы и упражнения для самопроверки
- •3.1. Образование ковалентных связей
- •3.2.3 Ароматичность
- •3.3 Взаимное влияние атомов в молекуле
- •3.3.1 Индуктивный эффект
- •3.3.2 Мезомерный эффект
- •3.4. Вопросы и упражнения для самопроверки
- •4. КИСЛОТНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •4.1 Теория Бренстеда-Лоури, протолитическая
- •4.2. Вопросы и упражнения для самопроверки
- •5. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- •5.1 Механизмы органических реакций
- •5.2.1 Гидратация алкенов. Роль кислотного катализатора
- •5.2.2 Реакции присоединения к асимметричным алкенам (правило Марковникова)
- •5.2.3 Реакция присоединения к α, β-ненасыщенным карбонильным соединениям
- •5.3.1 Галогенирование бензола
- •5.3.2 Ориентирующее действие заместителей в бензольном ядре. Ориентанты первого и второго рода
- •5.4 Нуклеофильное замещение у насыщенного атома углерода
- •5.5 Механизм и стереохимия реакций элиминирования (Е)
- •5.6 Окисление и восстановление органических соединений
- •5.6.1 Окисление гидроксильных и оксо-групп
- •5.6.2 Окисление непредельных и ароматических соединений
- •5.6.3 Реакции восстановления
- •5.6.4 Обратимые окислительно-восстановительныесистемы
- •5.7. Вопросы и упражнения для самопроверки
- •6. ОСНОВНЫЕ КЛАССЫ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- •6.1 Способы получения альдегидов и кетонов
- •6.2 Химические свойства альдегидов и кетонов (карбонильных соединений)
- •6.2.1 Реакция альдегидов с нуклеофилами
- •6.2.1.1 Особенности реакций присоединения к альдегидам и асимметричным кетонам
- •6.2.1.2. Реакции присоединения спиртов. Образование полуацеталей и ацеталей
- •6.2.2 Реакции конденсации
- •6.2.2.1 Кето-енольная таутомерия альдегидов и кетонов. Альдольное присоединение
- •6.2.2.2 Кротоновая конденсация или альдольно - кротоновая конденсация
- •6.3 Окисление и восстановление альдегидов и кетонов
- •6.4 Вопросы и упражнения для самопроверки
- •7. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
- •7.1. Основные пути получения карбоновых кислот:
- •7.2. Малоновый синтез карбоновых кислот
- •7.3. Классификация карбоновых кислот
- •7.4 Химические свойства карбоновых кислот
- •7.4.2. Восстановление карбоновых кислот
- •7.4.3. Декарбоксилирование карбоновых кислот
- •7.5. Дикарбоновые кислоты
- •7.6. Угольная кислота и ее производные
- •7.7. Вопросы и упражнения для самопроверки
- •8. ПОЛИ- И ГЕТЕРОФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ
- •8.1. Аминоспирты
- •8.2 Классификация одноосновных гидроксикислот
- •8.2.1 Получение гидроксикислот
- •8.2.2 Специфические реакции гидроксикислот
- •8.3. Многоосновные гидроксикислоты
- •8.4. Оксокислоты
- •8.5 Вопросы и упражнения для самопроверки
- •9. АМИНОКИСЛОТЫ
- •9.1. Изомерия аминокислот
- •9.2. Классификации аминокислот
- •9.2.1. Классификации аминокислот по биологической ценности
- •9.2.2. Классификации аминокислот на основе химического строения аминокислот
- •9.2.2.3. Современная классификация α-аминокислот
- •9.4. Кислотно-основные свойства аминокислот
- •9.5. Способы получения аминокислот
- •9.6. Химические свойства
- •9.7. Специфические реакции α, β, γ, δ-аминокислот
- •9.8. Качественные реакции на аминокислоты, пептиды, белки.
- •9.9. Методы количественного определения аминокислот
- •9.10. Редко встречающиеся аминокислоты
- •9.11.2 Вторичная структура полипептидной цепи
- •9.11.3 Третичная структура белков
- •9.12. Вопросы и упражнения для самопроверки
- •Классификация углеводов
- •10.1. Моносахариды, классификация
- •10.2. Циклическое строение моносахаридов
- •10.3. Химические свойства моносахаридов
- •10.3.1. Реакции полуацетального гидроксила
- •10.3.3. Окисление и восстановление моносахаридов
- •10.3.4. Изомеризация в щелочной среде
- •10.4. Качественные реакции моносахаридов. Отличительные реакции пентоз и гексоз
- •10.5. Производные моносахаридов
- •10.6. Олигосахариды
- •10.6.1. Химические свойства олигосахаридов
- •10.7. Полисахариды
- •10.7.1. Гомополисахариды
- •10.7.2. Гетерополисахариды
- •10.8. Гликопротеины
- •10.9. Вопросы и упражнения для самопроверки
- •11. БИОЛОГИЧЕСКИ АКТИВНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- •11.1. Пятичленные ароматические гетероциклы
- •11.2. Шестичленный ароматический гетероцикл
- •11. 3. Нуклеиновые кислоты (НК)
- •11.3.1 Нуклеозиды
- •11.3.2. Нуклеотиды
- •11.3.3. Нуклеозидциклофосфаты
- •11.3.4. Рибо- и дезокси-рибонуклеиновые кислоты
- •11.4. Вопросы и упражнения для самопроверки
- •12. ЛИПИДЫ
- •12.1. Высшие жирные кислоты
- •12.2. Классификация омыляемых липидов
- •12.2.1. Простые липиды
- •12.2.1.1.Химические свойства простых липидов
- •12.2.2 Сложные липиды
- •12.2.2.2. Гликолипиды
- •12.3. Неомыляемые липиды
- •12.3.1 Терпены (изопреноиды)
- •12.3.3. Стероиды
- •12.4. Вопросы и упражнения для самопроверки
- •13. Методы, используемые для изучения соединений в органической химии
- •Литература
Особым видом сопряжения является σ-π сопряжение (или гиперконъюгация, эффект Натана-Беккера). Такое сопряжение имеет место, когда метильная группа присоединена к углероду с двойной связью. Например, в уксусной кислоте:
H  O
O
H–C–C O–H H
O–H H
Электроны σ-связей вступают во взаимодействие с π-электронами двойной связи «С=O» группы. Благодаря наличию σ-π сопряжения в уксусной кислоте атомы водорода в метильной группе приобретают подвижность и могут легко замещаться на атомы галогена.
3.2.3 Ароматичность
Термин «ароматичность» был предложен исследователями, поскольку первые изученные представители этого класса обладали приятным запахом. В настоящее время «ароматичность» ассоциируется со стабильностью и характеризует совокупность структурных и энергетических свойств циклических молекул, содержащих систему сопряжённых связей. Исследования ученых показали, что ароматичность определяется тремя критериями: квантово-механическим, химическим и физическим.
Критерии ароматичности:
•Ароматическими называются циклические соединения, которые имеют делокализованное π - электронное кольцо
•Все атомы цикла sp2-гибридизованы
•Согласно теории (правилу) Хюккеля ароматическими являются циклические соединения, которые имеют (4n + 2) π-электронов, участвующих в сопряжении, гдеn= 0,1,2,3…
•Все органические соединения, отвечающие правилу Хюккеля, имеют плоское строение.
52
Совокупность общих химических свойств, на основании которых определяется принадлежность органических соединений к ароматическим, является химическим критерием ароматичности. Так, все ароматическиесоединенияструдомвступаютвреакцииприсоединения илегкодаютреакцииэлектрофильногозамещения.Кислотныесвойства фенола и его производных более выражены, чем у алифатических спиртов а основные свойства анилина и его производных выражены слабее, чем у алифатических аминов.
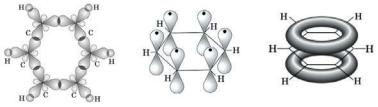
Ароматические соединения термодинамически более устойчивы, чем их гипотетические аналоги. Если считать, что каждая двойная связь в циклогексатриене (гипотетический аналог бензола) подобна двойной связивциклогексене,тотеплотагидрированияциклогексатриенадолжна быть в три раза больше теплоты гидрирования циклогексена и равна 358,5 кДж/моль.Однако экспериментально определённая теплота гидрирования бензола на 150,4кДж/моль меньше этого значения. Разница в энергиях гидрирования бензола и гипотетической молекулы циклогексатриена называется энергией резонанса бензола. Бензол проявляет высокую термодинамическую устойчивость благодаря наличию плоской циклической сопряженной системы (Рис. 3.5. а). Атомы углерода в молекуле бензола находятся вsp2 –гибридизованном состоянии. Остальные 6рz орбиталей, не принимающиеучастиявгибридизации, перекрываются с образованиемединогоπ-электронногооблака,котороеиобуславливает термодинамическую устойчивостьбензола (Рис.3.5. б, в).
а) |
б) |
в) |
Рис. 3.5 Схематическое изображение строения молекулы бензола
53
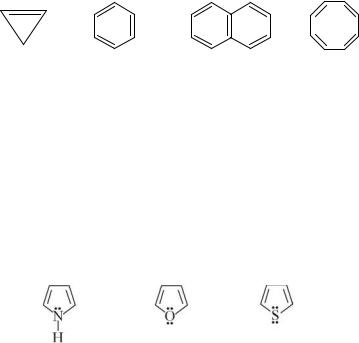
На основании правила Хюккеля, с учетом остальных критериев, ароматическими соединениями являются циклопропенил-катион (число π-электронов – 2, n = 0), бензол (число π-электронов – 6, n= 1), нафталин (число π-электронов – 10, n = 2) и т.д.
+
C
циклопропенил- |
бензол |
нафталин циклооктатетраен |
катион |
|
|
Циклооктатетраен(числоπ-электронов- 8)неявляетсяароматическим соединением, поскольку не отвечает правилу Хюккеля и не является плоской молекулой.
Гетероциклические ароматические соединения
Следует отметить, что ароматические свойства, в разной степени, проявляют и многие важные гетероциклические соединения (пиррол,
фуран, тиофен, пиридин):
пиррол |
фуран |
тиофен |
В приведенных гетероциклах в сопряжение включаются р-электроны гетероатомов (р-π сопряжение), при этом общее число электронов, образующих ароматическую систему превышает число атомов в цикле (соотношение равно 6:5). Поэтому пиррол, фуран и тиофен относятся к π-избыточным гетероциклам (Рис. 3.6).
54
