
5 курс / Госпитальная хирургия / Кузин_Учебник_Хирургические_болезни
.pdfинфильтрацию (иммунокомпетентные клетки реципиента) паренхимы, отек ткани. В связи с отеком почка увеличивается вплоть до надрыва капсулы и паренхимы с последующим кровотечением. В области пересаженной почки появляется локальная болезненность, повышается температура тела, разви вается слабость, стойкая гипертензия. Появляется олигурия, нарастает азо темия (повышается креатинин и мочевина крови). Эти симптомы редко вы являются у реципиентов, получающих циклоспорин. У реципиентов, полу чавших циклоспорин А, не наблюдается набухания пересаженной почки, не повышается температура и лишь олигурия или анурия свидетельствует о ре акции отторжения, которая может быть подтверждена изучением перфузии почки радиоизотопным методом. Для уточнения диагноза производят био псию почки. При ультразвуковом исследовании обнаруживается увеличение размеров пересаженной почки, толщины ее коркового слоя.
Гистологическое исследование в раннем периоде позволяет выявить при липание лимфоцитов к эндотелию перитубулярных капилляров и венул. Значительное скопление их приводит к разрыву этих сосудов, некрозу из витых канальцев и интерстициальным инфильтратам. Клеточные инфильт раты образованы мелкими лимфоцитами. Позднее в инфильтрате появля ются крупные лимфоциты и макрофаги. Если процесс отторжения прибли жается к необратимому, наблюдается набухание интимы и очаговый фибриноидный некроз медиа, заканчивающийся пролиферацией эндотелиальных клеток и облитерацией просвета мелких артерий фибрином, тромбоцитами, лимфоидными клетками. Для уточнения диагноза острого отторжения про изводят транскутанную биопсию почки. Как только установлен диагноз, не медленно приступают к лечению иммунодепрессантами (стероидные гормо ны, ОКТЗ, антилимфоцитарная сыворотка и др.).
В случае правильного лечения интерстициальный нефрит пересаженной почки полностью исчезает. Однако если лечение начато поздно или доза иммунодепрессантных препаратов неадекватна, то острая реакция отторже ния может привести к необратимым изменениям в трансплантированной почке, ее гибели и отторжению.
Х р о н и ч е с к а я р е а к ц и я о т т о р ж е н и я начинается спустя 3— 4 нед после операции трансплантации. Причиной ее является распростра ненное облитерирующее поражение сосудов почки. Вследствие резкого су жения просвета сосудов нарушается кровоснабжение пересаженной почки, уменьшается клубочковая фильтрация, нарастает азотемия. Хроническая сосудистая реакция отторжения трансплантата является наиболее частой причиной утраты функции пересаженной почки. Усиление иммунодепрессивной терапии обычно малоэффективно, постепенно почка погибает, воз никает необходимость в ее удалении, переводе больного на гемодиализ и в повторной пересадке почки. Некоторым больным пересадку почки прихо дится повторять несколько раз.
Осложнения иммунодепрессивного лечения. Основой успешного исхода пе ресадки почки, помимо соблюдения принципов гистосовместимости и хи рургической техники, является иммунодепрессивная терапия. Угнетая им мунную защитную реакцию организма против пересаженного органа, имму нодепрессивная терапия одновременно угнетает механизмы защиты против инфекции. Инфекционные осложнения (чаще в мочевых путях и в ране) на блюдаются почти у 90 % реципиентов. Они сравнительно легко поддаются лечению антибактериальными препаратами. Наиболее опасно нагноение в ложе трансплантированной почки вблизи крупных сосудов в связи с угро зой массивного кровотечения и развития сепсиса. Поэтому необходимо тщательное соблюдение правил асептики и антисептики не только во время
760
операции, но и на протяжении всего послеоперационного периода при ухо де за больным (смене повязок, катетеров, дренажей и т. п.). Профилактиче ское введение антибиотиков малообоснованно, их необходимо вводить при появлении ранних признаков инфекции.
Наряду с банальной хирургической инфекцией для больного опасны также вирусная, особенно цитомегаловирусная, инфекция и вирусы, вы зывающие герпес. Цитомегаловирусная инфекция может быть внесена в организм реципиента вместе с трансплантированной почкой. Течение это го вида инфекции обычно очень тяжелое, угрожающее жизни пациента. При появлении первых признаков заболевания необходимо уменьшить иммунодепрессивную терапию, ввести цитомегаловирусный гипериммун ный глобулин.
П о б о ч н о е д е й с т в и е с т е р о и д н о й т е р а п и и о б щ е и з в е с т - н о. Обычно оно проявляется синдромом Иценко—Кушинга, медикамен тозными угрями, эрозиями, язвой желудка и двенадцатиперстной кишки. В отдаленном периоде у 5—10 % реципиентов может развиться некроз голов ки бедренной кости, катаракта. При некрозе головки бедренной кости воз никает необходимость ее резекции с протезированием одного или обоих та зобедренных суставов. Побочное действие цитостатических препаратов (азатиоприн и др.) проявляется резким угнетением костномозгового кро ветворения (лейкопения, тромбоцитопения) и угнетением эритропоэза. Поэтому при проведении цитостатической терапии необходимо постоян но контролировать состояние кроветворной системы и регулировать в со ответствии с этим дозировку препаратов. При длительной терапии азатиоприном наблюдается развитие злокачественных опухолей, особенно лимфомы.
Вслучае передозировки циклоспорина может проявиться его нефротоксическое действие с соответствующим нарушением функции почек, гепатотоксическое действие, ведущее к повышению билирубина и трансаминаз крови. Другие побочные действия циклоспорина (тремор, гирсутизм, гипер плазия десен) сравнительно незначительны. Дискутируется вопрос о воз можном повышении риска развития опухолей у лиц, длительно принимав ших циклоспорин А.
Вотдаленном после операции трансплантации периоде у ряда больных развивается артериальная гипертензия. Она может быть связана с первич ным заболеванием почек пациента, существовавшим до пересадки. В этих случаях при неэффективности консервативной терапии приходится осу ществлять двустороннюю нефрэктомию. Артериальная гипертензия может развиться также вследствие стеноза почечной артерии (реноваскулярная гипертензия). При хронической сосудистой реакции отторжения транс плантата или при поражении клубочков почки эффективна терапия совре менными антигипертензивными препаратами. Известно, что артериаль ная гипертензия является главным фактором риска возникновения хрони ческой ишемической болезни сердца, которая в позднем послетрансплантационном периоде становится наиболее частым заболеванием и причи ной смерти.
Успех пересадки почек зависит от иммунологической гистосовместимости. Трансплантаты, взятые от живых доноров (близких родственников), хо рошо функционируют у 90—95 % пациентов в течение 1 года и у 85—90 % в течение 2 лет. Трансплантаты от трупов с мозговой смертью, пересажен ные в ведущих центрах трансплантации, хорошо функционируют у 70 % в течение первого года и у 60 % на протяжении более 4 лет. Известны сроки выживания больных с пересаженными почками более 20 лет.
761
28.6. Трансплантация поджелудочной железы
Первая попытка трансплантации поджелудочной железы при диабете I типа была предпринята в 1891 г., за 30 лет до открытия инсулина. Тогда английский хирург Williams ввел взвесь клеток поджелудочной железы в брюшную стенку больного с диабетической комой. Первую трансплантац ию поджелудочной железы в клинике произвели Kelly и Lillehei в 1966 г. Они пересадили сегмент поджелудочной железы в подвздошную ямку. Про ток железы был перевязан. Эта операция используется в некоторых учреж дениях до настоящего времени. Позднее было предложено несколько раз личных вариантов операции.
П о к а з а н и я к пересадке поджелудочной железы являются противоре чивыми. Не вызывает сомнения, что пересадка должна быть произведена до появления тяжелых или необратимых осложнений сахарного диабета, таких как тяжелая ретинопатия, угрожающая слепотой, нейропатия, нефропатия, тяжелое заболевание микрососудов и крупных стволов.
П р о т и в о п о к а з а н и я к трансплантации поджелудочной железы та кие же, как к трансплантации почки и других органов. Особенно тщательно должно быть исследовано сердце реципиента. В связи с нейропатией мно гие пациенты не ощущают стенокардию даже при значительном поражении коронарных сосудов. Для уточнения диагноза рекомендуется провести ра диоизотопное исследование сердца, ангиографию коронарных сосудов.
Выбор донора и изъятие поджелудочной железы имеют большое значе ние для успеха трансплантации. Поджелудочную железу берут обычно у мо лодого, здорового донора с мозговой смертью. Возраст донора может коле баться от 3 до 55 лет. У взрослых доноров необходимо исключить атеросклеротическое поражение чревного ствола. А б с о л ю т н ы м п р о т и в о п о к а з а н и е м для изъятия поджелудочной железы у донора является инфек ция в брюшной полости, травма железы, острый панкреатит и наличие диа бета у донора. Содержание глюкозы и амилазы в крови донора не отражает состояние и пригодность поджелудочной железы для трансплантации. Пан креас изымают вместе с печенью и двенадцатиперстной кишкой или отдель но. После изъятия органов печень отделяют от поджелудочной железы. По следнюю консервируют в специальном растворе (Виспан, ДюПонт) и сохра няют в контейнере при низкой температуре до момента пересадки. Макси мальный срок хранения консервированного органа 20—30 ч.
Для пересадки используется либо сегмент (хвост и тело), либо вся под желудочная железа вместе с сегментом двенадцатиперстной кишки. Суще ствуют различные мнения по поводу отведения экзокринного сока. Вывод ной проток панкреас может быть перевязан, блокирован специальным по лимером или оставлен открытым (тогда панкреатический сок выделяется в свободную брюшную полость), соединен соустьем с изолированной по Ру петлей тонкой кишки, мочевым пузырем или мочеточником.
При пересадке целой поджелудочной железы вместе с сегментом двена дцатиперстной кишки последний соединяют анастомозом бок в бок с тон кой кишкой или мочевым пузырем. При пересадке сегмента поджелудочной железы выводной проток ее чаще блокируют неопреном или другим быстро отвердевающим синтетическим материалом. Однако эта методика менее по пулярна по сравнению с отведением панкреатического сока в кишку или мочевой пузырь. При отведении панкреатического сока в мочевой пузырь уменьшается опасность инфекции, появляется возможность контролиро вать содержание амилазы в моче и судить о начинающейся реакции оттор жения и функциональном состоянии трансплантата, поэтому эту методику
762
часто используют в ряде центров. |
|
||||||||
Недостатком |
соединения |
протока |
|
||||||
железы с мочевым пузырем является |
|
||||||||
потеря большого количества бикар |
|
||||||||
бонатов с панкреатическим соком, |
|
||||||||
развитие |
ацидоза, |
гематурии, |
ин |
|
|||||
фекции |
мочевого |
пузыря, |
стрикту |
|
|||||
ры уретры. |
|
|
|
|
|
|
|
|
|
Поджелудочную |
железу, |
как |
и |
|
|||||
почку, пересаживают в подвздошную |
|
||||||||
ямку. При этом последовательно со |
|
||||||||
единяют |
вены, |
артерии, |
выводной |
|
|||||
проток железы. Принято три вариан |
|
||||||||
та пересадки поджелудочной железы: |
|
||||||||
пересадка только железы (у больных |
|
||||||||
в преуремическом |
состоянии), |
по |
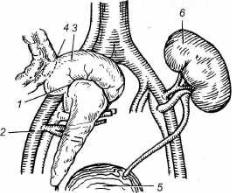
Рис. 28.1. Одномоментная пересадка почки и |
||||||
следовательная |
пересадка |
сначала |
поджелудочной железы. |
||||||
|
|||||||||
почки, а потом поджелудочной желе |
1 — поджелудочная железа вместе с сегментом две |
||||||||
зы и, наконец, симультанная (одно |
надцатиперстной кишки; 2 — подвздошные сосуды; |
||||||||
3 — сегмент двенадцатиперстной кишки; 4 — ана |
|||||||||
временная) пересадка почки и желе |
стомоз с тощей кишкой; 5 — мочевой пузырь; 6 — |
||||||||
зы. Кажущееся преимущество после |
почка. |
||||||||
|
|||||||||
довательной |
пересадки |
состоит |
в |
|
|||||
том, что панкреас пересаживают на фоне иммуносупрессивной терапии, проводимой по поводу пересаженной ра
нее почки. Однако результаты последовательной пересадки оказались хуже одновременной пересадки почки и поджелудочной железы. Поэтому в боль шинстве случаев теперь производят одновременную пересадку обоих органов. При этом пациент подвергается только одному оперативному вмешательству и получает одинаковую иммуносупрессивную терапию (рис. 28.1).
Реакция отторжения обычно начинается с лимфоцитарной инфильтра ции ацинусов, развития васкулита. Островковая ткань поджелудочной же лезы некоторое время не изменяется. Лимфоцитарная инфильтрация и по вреждение островковой ткани наблюдаются лишь в поздней стадии реакции отторжения. Следовательно, повышение концентрации глюкозы в крови не может служить ранним критерием отторжения, уровень ее повышается только в необратимой стадии реакции отторжения. Изолированное оттор жение панкреас без отторжения почки происходит крайне редко. Поэтому ранние признаки отторжения почки (олигурия, повышение креатинина и др.) являются одновременно ранними признаками отторжения поджелу дочной железы. При последовательной пересадке панкреас, а затем почки о начале реакции отторжения судят по уровню амилазы в моче, что подтвер ждает преимущество пересадки панкреас с анастомозом протока железы с мочевым пузырем.
Морфологически отторжение проявляется набуханием трансплантата, размытостью краев пересаженной панкреас, плохой визуализацией ее хво ста при УЗИ. Магнитно-резонансная томография и различные способы УЗИ не позволяют определить отторжение панкреас. Если при пересадке был наложен анастомоз между мочевым пузырем и сегментом двенадцати перстной кишки, окружающим головку поджелудочной железы, то пред ставляется возможность для проведения биопсии панкреас через цистоскоп.
Иммуносупрессивная терапия проводится по общим правилам с приме нением 2—3 препаратов с разным механизмом действия по разработанной схеме. Осложнения в послеоперационном периоде такие же, как после пе-
763
ресадки почек, — возможность кровотечения, скопление жидкости вокруг трансплантата (удаляется с помощью аспирации под контролем УЗИ), ин фекция.
После успешной пересадки поджелудочной железы углеводный обмен нормализуется, пациент избавляется от необходимости вводить инсулин, но зато должен принимать иммуносупрессивные препараты. Основная цель од новременной пересадки панкреас и почки заключается в том, чтобы оста новить прогрессирование нефропатии, ретинопатии, нейропатии. Как пра вило, это удается достичь, качество жизни пациентов становится намного лучше по сравнению с жизнью на фоне гемодиализа.
Теоретически можно добиться нормогликемии путем трансплантации клеток островков Лангерганса, практически — крайне трудно. Для этого не обходимо измельчить панкреас донора, подвергнуть смесь клеток воздейст вию коллагеназы и затем отцентрифугировать клетки островков Лангерган са на специальной центрифуге. Из одной панкреатической железы удается получить очень мало жизнеспособных клеток для введения их в портальную вену, в ткань селезенки или под капсулу почки. Эта методика находится в начальной стадии разработки. Делаются попытки пересадки поджелудочной железы от 16—20-недельного эмбриона. Его размер едва достигает 0,5 см, а масса поджелудочной железы 10—20 мг. Железа способна расти и выделять инсулин в течение непродолжительного времени. В мире сделано около 200 экспериментальных пересадок эмбриональной поджелудочной железы с очень ограниченным успехом.
28.7. Трансплантация сердца
Пересадка сердца производится сравнительно часто и занимает второе место после пересадки почек. Усовершенствование методов консервации органов, подавления реакции отторжения с помощью современных препа ратов, техники искусственного кровообращения и интенсивной терапии по зволило шире применять пересадку сердца в клинической практике (рис. 28.2).
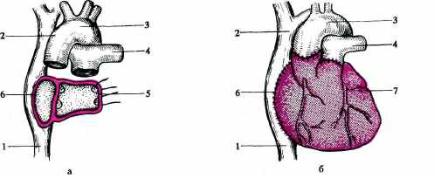
Рис. 28.2. Пересадка сердца.
а — общий вид после удаления сердца реципиента; б — вид после завершения операции трансплан тации. 1 — нижняя полая вена; 2 — верхняя полая вена; 3 — аорта; 4 — легочная артерия; 5 — задняя стенка левого предсердия; 6 — задняя стенка правого предсердия (реципиента); 6 — правое предсер дие донорского сердца; 7 — пересаженное донорское сердце.
764
П о к а з а н и я м и к трансплантации сердца являются хроническая ишемическая болезнь сердца в терминальной стадии развития болезни (около 45 % всех трансплантаций сердца), кардиомиопатия с явлениями выражен ной сердечной недостаточности (45 %), тяжелые комбинированные пороки сердца, значительно реже — другие виды заболеваний сердца.
Критериями отбора реципиентов для трансплантации сердца являются: 1) сердечная недостаточность IV степени по классификации Нью-Йорк ской ассоциации кардиологов или предполагаемая продолжительность жиз
ни пациента менее 6 мес;
2)возраст реципиента — от периода новорожденное™ до 60 лет (в неко торых центрах до 65 лет);
3)удовлетворительное состояние пациента до появления признаков ко нечной стадии развития сердечного заболевания; у реципиента должна быть нормальная функция или легко обратимая, временная дисфункция легких, печени, почек, ЦНС, а также эмоциональная стабильность и коммуника бельность;
4)резистентность легочных сосудов должна быть нормальной или под дающейся фармакологической коррекции;
5)у реципиента не должно быть активно развивающейся инфекции или онкологического процесса, недавно перенесенной тромбоэмболии легочной артерии, тяжелого сосудистого заболевания.
При выборе метода лечения врач должен быть уверен в том, что пересад ка сердца является единственным способом продлить жизнь больного, что все возможности других методов лечения тяжелого сердечного заболевания исчерпаны.
П р о т и в о п о к а з а н и я м и к трансплантации сердца являются: 1) сис темные заболевания (например, инсулинзависимый сахарный диабет, не поддающиеся коррекции хронические заболевания почек, ЦНС, психиче ские заболевания, активная инфекция в организме); 2) высокое давление в системе легочной артерии (легочная гипертензия); 3) выраженное ожире ние, алкоголизм или наркомания.
Критерии отбора доноров. В качестве донора для пересадки сердца дол жен быть подобран человек со здоровым сердцем, по возможности моложе 60 лет с клинически установленной смертью мозга. Сердечная деятельность донора должна поддерживается гипертензивными препаратами непродол жительный период времени. Донор и реципиент должны иметь одинаковую группу крови. В сыворотке крови реципиента не должно быть преформированных антител против лимфоцитов донора. Донор должен иметь нормаль ную ЭКГ и эхокардиограмму. Размеры донорского органа могут колебаться от 20 до 50 % от размеров сердца реципиента.
Пересадку сердца выполняют только в отделениях сердечной хирургии, располагающих опытом проведения искусственного кровообращения с холодовой кардиоплегией, где имеются соответствующее оснащение и квалифированный персонал.
Оперативный доступ — срединная стернотомия. После вскрытия пери карда вводят канюли в нижнюю и верхнюю полые вены для подключения аппарата искусственного кровообращения. Продолжительность искусствен ного кровообращения и холодовой кардиоплегии должна быть возможно короче.
Сердце донора и реципиента иссекают почти полностью, оставляя не большие участки задних стенок обоих предсердий (места впадения полых вен в правое предсердие и место впадения легочных артерий в левое пред сердие). После осмотра подготовленного соответствующим образом сердца
765
донора его соединяют швами с оставшейся задней стенкой левого предсер дия, перегородкой между ними, остатком правого предсердия, аортой и ле гочной артерией реципиента. После снятия зажима с аорты принимают ме ры для скорейшего восстановления сокращений сердца, если оно не восста навливается самостоятельно.
Иммуносупрессию проводят по общим правилам. В последние годы в схему иммуносупрессии включают моноклональные антитела (ОКТЗ и др.).
В течение первого года после операции выживает около 80 % пациентов, после 5 лет — около 64 % и после 10 лет и более — 45 %.
Реакция отторжения проявляется аритмией, гипотензией, повышением температуры, слабостью, нехваткой воздуха. ЭКГ недостаточно информа тивна. Для выявления ранних признаков реакции отторжения используют чрезвенозную эндокардиальную биопсию миокарда с последующим изуче нием его гистологической структуры. Рутинно используют также радиоизо топную вентрикулографию, которая позволяет следить за реакцией оттор жения и изменениями в процессе лечения иммуносупрессантами.
28.8. Пересадка сердце—легкие
Некоторые пациенты одновременно нуждаются в пересадке сердца и лег ких в связи с тяжелым заболеванием обоих органов. В последние годы сде ланы успешные операции одновременной пересадки сердца и легких.
Успешная трансплантация этих органов единым комплексом была раз работана Reitz и сотрудниками. Метод постепенно внедряется в клиники. Основное препятствие — недостаток подходящих доноров.
П о к а з а н и я к пересадке сердца и легких: 1) первичная легочная гипертензия, синдром Эйзенменгера, 2) кистозный фиброз легких, 3) дефицит а, -антитрипсина.
Выбор донора. Донор по размерам, по возможности, должен соответство вать реципиенту или быть немного меньше, иметь здоровые легкие (по дан ным рентгенологического исследования), нормальные показатели по газо обмену. Естественно, донор должен соответствовать реципиенту по группе крови и по гистосовместимости.
Выбор реципиента. Возраст — не старше 50 лет. В качестве реципиента выбирают пациентов с заболеванием сосудов легких или паренхимы в соче тании с конечной стадией декомпенсации сердца.
У реципиента не должно быть необратимых заболеваний или дисфунк ции других органов и ранее перенесенных торакотомии или стернотомии.
Операцию начинают так же, как при пересадке сердца. Легкие удаляют поодиночке с помощью сшивающего аппарата, накладываемого на корень легкого. Затем мобилизуют трахею с проксимальными культями бронхов и пересекают ее над кариной. После удаления легких и сердца реципиента подготовленный консервированный трансплантат помещают в грудную по лость реципиента и последовательно соединяют швами. Сначала наклады вается анастомоз на трахею (бронх при односторонней пересадке), после создания которого легкие начинают вентилировать. Затем накладывают анастомозы между аортой донора и правым предсердием.
Выживаемость после успешной трансплантации сердца и легких такая же, как при пересадке сердца. Иммуносупрессию проводят по тем же пра вилам. Возможные осложнения — реакция отторжения, кровотечение, обтурирующий бронхолитиаз, который сдерживает широкое распространение метода.
766
28.9. Трансплантация печени
Это одна из наиболее сложных и длительных операций, тем не менее она стала часто применяться в специальных центрах пересадки органов.
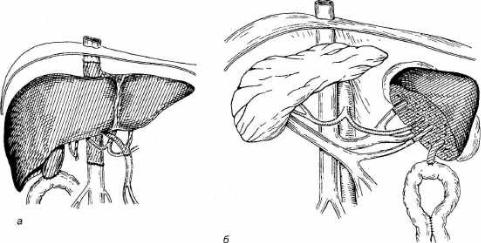
П о к а з а н и е м к пересадке печени является терминальная стадия раз вития цирроза печени, вызванного неумеренным употреблением алкоголя, гепатитом С или В, аутоиммунным гепатитом. Часто показанием к опера ции является первичная холестатическая болезнь печени, фульминантная печеночная недостаточность, атрезия желчных путей. Значительно реже трансплантацию печени производят при доброкачественных и злокачест венных опухолях, у детей — при атрезии желчных путей и некоторых мета болических заболеваниях (рис. 28.3).
Выбор реципиента. Успешность трансплантации печени зависит от кор ректного выбора реципиента. Главным является состояние его здоровья к моменту пересадки, способность перенести тяжелую операцию. Реципиент не должен иметь других тяжелых заболеваний в конечной фазе их развития. За 6 мес до операции больной не должен употреблять алкоголя и нарко тиков. Операция не показана при наличии внепеченочного онкологическо го заболевания и не поддающейся излечению инфекции.
Кандидат на пересадку печени должен быть тщательно обследован спе циалистами разных областей медицины, включая психиатра. До операции необходимо провести лечение имеющихся заболеваний, которые могут по влиять на успешность трансплантации.
Выбор донора. Пересаженная печень должна немедленно выполнять свою синтетическую функцию. В противном случае наступит смерть в ближай шие 72 ч, так как для поддержания ее функции нет никаких устройств, по добных искусственной почке. Нефункционирующую после трансплантации печень удаляют и производят повторную пересадку. Только здоровая печень
Рис. 28.3. Ортотопическая (а) пересадка печени и гетеротопическая (б) пересадка сегмента пе чени.
1 — нижняя полая вена; 2 — печеночная артерия; 3 — воротная вена; 4 — общий желчный проток (перевя зан); 5 — анастомоз желчного пузыря с петлей тонкой кишки; 6 — сегмент печени; 7 — анастомоз желчного протока с петлей тощей кишки; 8 — селезеночная артерия; 9 — селезеночная вена.
767
донора способна выполнять свою функцию сразу после пересадки. Печень необходимо брать у донора с мозговой смертью и нормально функциони рующим сердцем. Трансплантат должен по размерам соответствовать или быть немного меньше печени реципиента. При значительной величине пе чени донора предпочтение отдают пересадке левой доли (2, 3, иногда 4 сег мента) печени. Трансплантат считается малопригодным, если при биопсии выявляется, что 40 % и более паренхимы печени замещено жиром.
Пробы на совместимость органов донора и реципиента при трансплан тации печени отличаются от тех проб, которые обычно проводят при пере садке почек и сердца. Проба на совместимость по HLA-антигенам не имеет того значения, как при пересадке почки, сердца, поджелудочной железы. HLA-антигены имеют физиологическое свойство представлять вирусные пептиды Т-лимфоцитам для начала процесса деструкции клеток, заражен ных вирусом. Таким образом, HLA-совместимость будет потенцировать воспаление при наличии у реципиента вирусной инфекции или аутоиммун ного процесса, увеличивать шанс рецидива указанных заболеваний. Не про изводят и перекрестную цитолитическую пробу с лимфоцитами для прогно зирования возможности развития сверхострой реакции отторжения, так как корреляция между результатами перекрестной пробы и реакцией отторже ния печени минимальная. Вместе с тем сверхострая реакция отторжения из редка наблюдается даже при обнаружении у реципиента преформированных антител против HLA донорских тканей и отсутствии совместимости по АВО антигенам. Пробу на совместимость по АВО-антигенам проводят обычно при плановой трансплантации, В экстренных случаях иногда пересаживают даже несовместимую по АВО-антигенам печень.
Пятилетняя выживаемость пациентов после такой пересадки на 15 % ху же, чем при пересадке АВО совместимых органов. Отмечено также, что пе ресаженная печень от донора женского пола мужчине приживает хуже муж ской донорской печени.
О с т р о е о т т о р ж е н и е , так же как и при пересадке других органов, осуществляется с помощь сложной реакции деструкции печени при участии Т-лимфоцитов. Без иммуносупрессии избежать такой реакции невозможно. Для Т-лимфоцитов первичной мишенью для распознавания HLA-антигенов являются антигены, расположенные на поверхности клеток желчных прото ков и эндотелия сосудов. Острая реакция отторжения печени похожа на та ковую после пересадки почки и сердца. Она возникает через 6 мес, но часто развивается в течение 4 нед после пересадки. Симптомы отторжения неспе цифичны. Они проявляются слабостью, повышением температуры, ухудше нием функциональных печеночных тестов — повышением в крови билиру бина, щелочной фосфатазы, трансаминаз, клиническими симптомами пече ночной недостаточности. Диагноз подтверждается с помощью биопсии пе чени.
Х р о н и ч е с к о е о т т о р ж е н и е происходит в период от нескольких месяцев до нескольких лет. Иммуносупрессивную терапию проводят по об щим правилам, подбирая препараты различного механизма действия. Суще ствует несколько схем (протоколов) иммуносупрессии, что позволяет выби рать наиболее подходящую из них. Возникающие после трансплантации пе чени осложнения разделяют на 4 степени тяжести. Для лечения каждой из них предусмотрена соответствующая схема лечения.
Выживаемость после операции составляет 90 %. Выживаемость в течение одного года равна 73 %, в течение 5 лет приблизительно 60 %. Реципиенты нуждаются в постоянном наблюдении и контроле.
Применяют в основном ортотопическую, реже гетеротопическую транс-
768
плантации (см. рис. 28.3). При ортотопической трансплантации печень ре ципиента удаляют, а на ее место пересаживают аллогенную печень донора. При этом соединяют выделенные кровеносные сосуды печени донора с нижней полой веной, воротной веной и печеночной артерией реципиента.
Желчный проток донорской печени соединяют анастомозом с выклю ченной по Ру петлей тощей кишки реципиента. При гетеротопической трансплантации печень реципиента не удаляют.
Поскольку удаление нескольких сегментов левой доли печени стало безопасным, некоторые центры отдают предпочтение пересадке левой доли (2—3, иногда 4 сегмента) печени от живого родственного донора, соединяя сосуды трансплантируемой части печени с сосудами селезенки реципиента, а желчный проток — с выключенной по Ру петлей тощей кишки. Это вме шательство менее сложно, дает отличное приживление трансплантата и от личные функциональные результаты вследствие лучшей гистосовместимости и уменьшения времени ишемии пересаживаемого органа. Сложными являются этические проблемы. Ради жизни ребенка мать часто пойдет на риск для собственного здоровья. В связи с улучшением иммунодепрессивной терапии многие специалисты считают взятие левой доли печени у жи вого родственного донора неоправданным риском, поскольку левая доля печени донора с мозговой смертью может дать столь же хорошие конечные результаты.
28.10. Трансплантация легких
Необходимость в трансплантации легких возникает у четырех категорий больных с легочными заболеваниями:
1) с обструктивными заболеваниями (эмфизема легких — наиболее час тое показание к операции);
2)с кистозным фиброзом — врожденное заболевание, которое является наиболее частой причиной обструктивного заболевания (конечная стадия ее развития наступает в течение первых трех десятилетий жизни пациента);
3)с рестриктивными заболеваниями легких — идиопатический фиброз легких, который приводит к уменьшению жизненной емкости легких, ды хательных объемов и форсированного выдоха;
4)с легочной гипертензией, включающей первичную легочную гипертензию, — наиболее частым показанием к трансплантации легких, — и син дромом Эйзенменгера.
Выбор реципиента. Трансплантацию легких целесообразно производить реципиентам с тяжелыми заболеваниями легких, подтвержденными клини ческими, физиологическими и лабораторными данными, у которых меди каментозное и хирургическое лечение неэффективно, а предполагаемая продолжительность жизни не превышает 12—24 мес. Реципиент должен быть нормально упитан и не иметь противопоказаний к операции.
Основными противопоказаниями являются неустранимая инфекция, он кологическое заболевание, психические нарушения, наркомания и алкого лизм, тяжелое заболевание почек, печени, сердца, курение табака, возраст более 65 лет.
Выбор донора. Донор должен быть здоровым человеком в возрасте не бо лее 55 лет (для односторонней пересадки — 65 лет), мало курящим (менее 20 пачек в год), с нормальной рентгенограммой и отсутствием аспирационных масс в бронхах (по данным бронхоскопии). Легкое донора должно со ответствовать размерам легкого реципиента. Перед трансплантацией прово-
49 - 2375 |
769 |
