
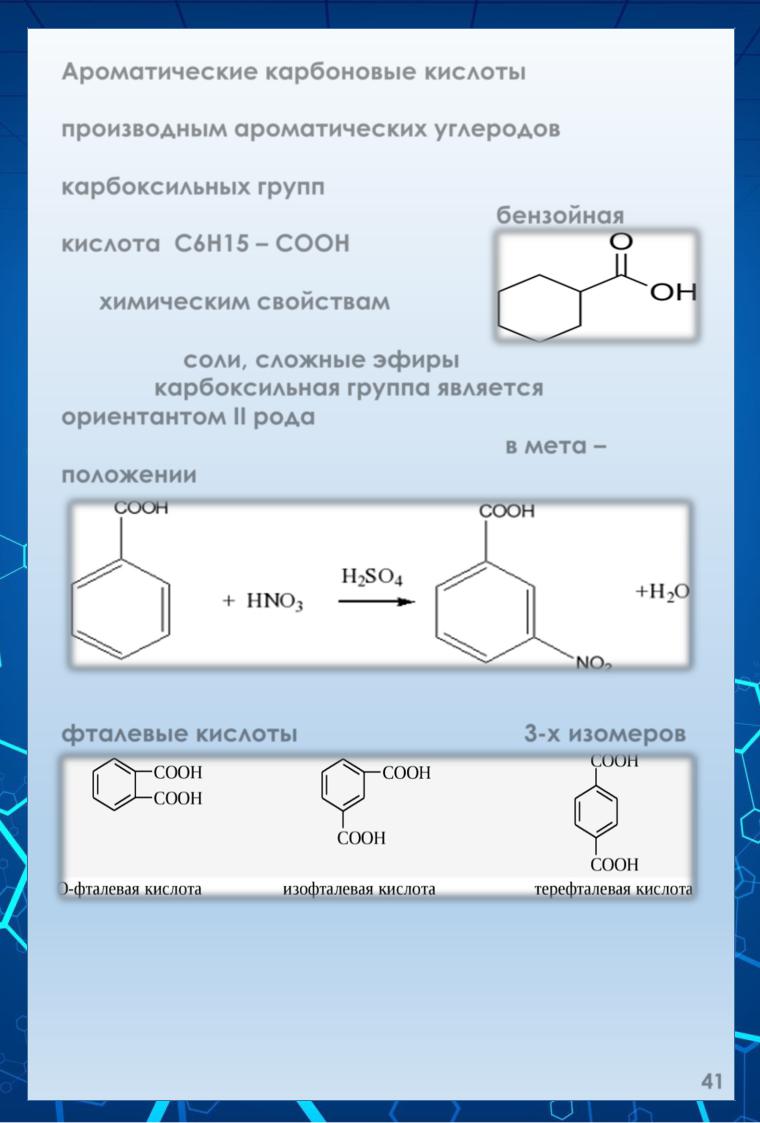
Ароматические карбоновые кислоты.
К ароматическим карбоновым кислотам относят производным ароматических углеродов, содержащие в боковых цепях одну или несколько карбоксильных групп. Простейшей одноосновной ароматической кислотой является бензойная кислота: С6Н15 – СООН.
По химическим свойствам она подобна кислотам жирного ряда образует соли, сложные эфиры.
Так как карбоксильная группа является ориентантом II рода, то группа электрофильного замещения затруднены и проходят в мета – положении:
Двухосновные ароматические кислоты – фталевые кислоты могут быть в виде 3-х изомеров:
41
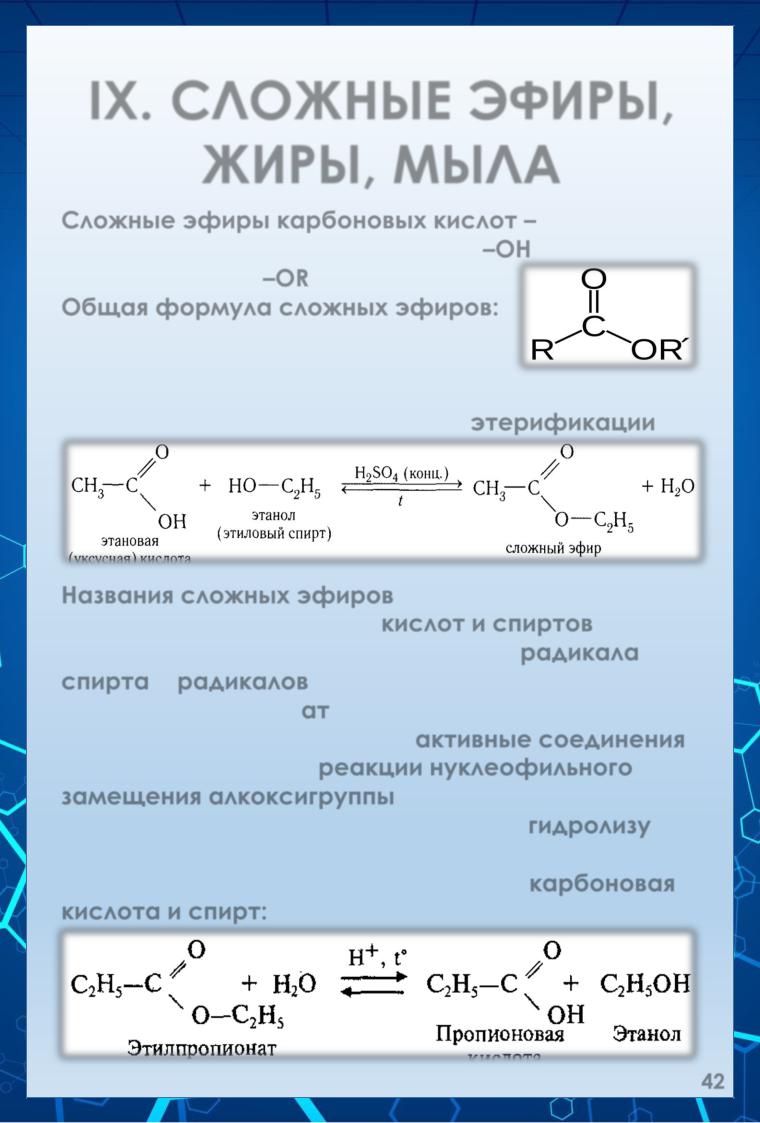
IX. СЛОЖНЫЕ ЭФИРЫ, ЖИРЫ, МЫЛА
Сложные эфиры карбоновых кислот – это продукты замещения гидроксила –ОН кислоты на остаток спирта –OR.
Общая формула сложных эфиров: Сложные эфиры получают при
Взаимодействии карбоновых кислот со спиртами в присутствии ионов водорода (р. этерификации):
Названия сложных эфиров обычно производят из названий образующих их кислот и спиртов, а по номенклатуре ИЮ ПАК – из названий радикала спирта и радикалов (ацила), заменяя в последнем окончании «ил» на «ат».
Сложный эфиры – довольно активные соединения. Для них характерны реакции нуклеофильного замещения алкоксигруппы.
Сложные эфиры могут подвергаться гидролизу как в кислой, так и в щелочной среде. В кислой среде эта реакция обратима и образуются карбоновая кислота и спирт:
42
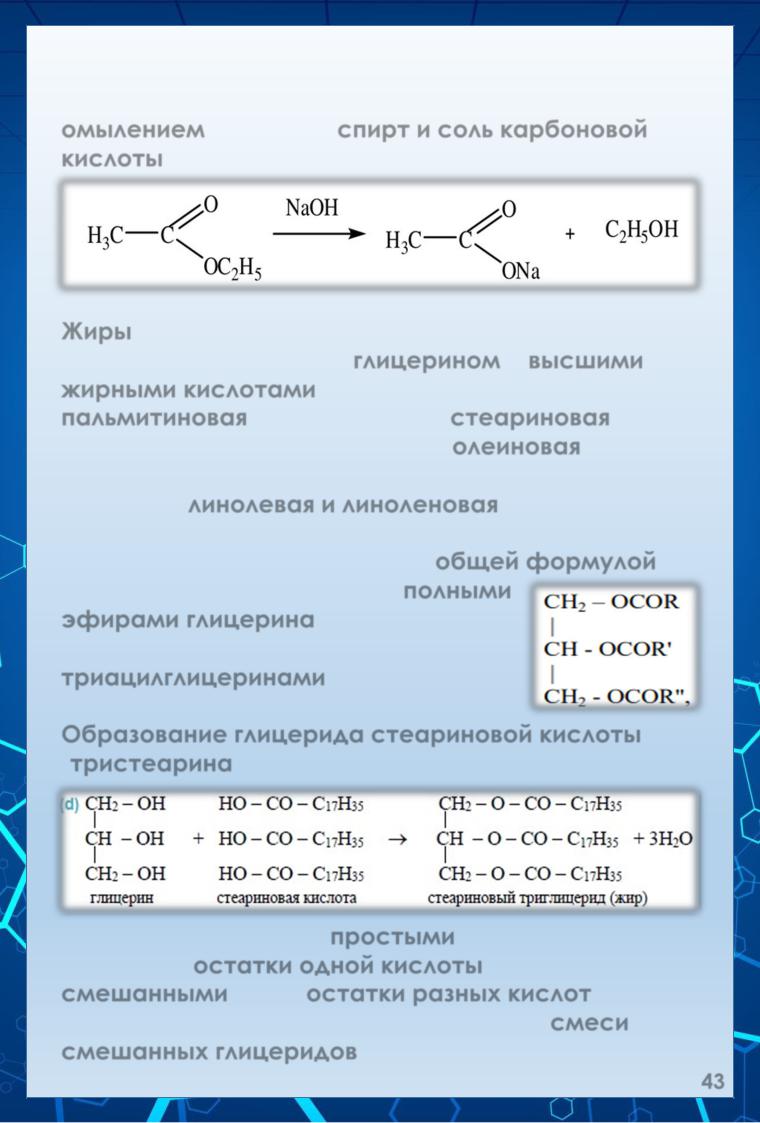
Гидролиз в щелочной среде необратим. Продуктом щелочного гидролиза, называемого омылением, являются спирт и соль карбоновой кислоты:
Жиры – это сложенные эфиры, образованные трёхатомным спиртом глицерином и высшими жирными кислотами. Главными являются пальмитиновая (С15Н31СООН), стеариновая (С17Н35СООН) и непредельная олеиновая (С17Н33СООН) кислоты. Другие непредельные кислоты – линолевая и линоленовая - присутствуют в жирах в значительно меньшем количестве. Строение жиров выражается общей формулой: Природные жиры являются полными эфирами глицерина, поэтому их называют глицеридами, или триацилглицеринами.
Образование глицерида стеариновой кислоты (тристеарина) можно изобразить уравнением:
Глицериды называют простыми, если они содержат остатки одной кислоты, или смешанными, если остатки разных кислот. Природные жиры представляют собой смеси смешанных глицеридов.
43

По агрегатному состоянию различают твёрдые жиры, обычно это животные жиры, и жидкие – растительные масла. Твёрдые жиры содержат в основном остатки предельных кислот, а жидкие жиры (масла) – остатки непредельных кислот. Жидкие жиры превращают в твёрдые путём реакции гидрогенизации – присоединения водорода в присутствии катализатора – никеля:
Жиры, как сложные эфиры, способны подвергаться гидролизу в кислой или щелочной среде. При этом образуются глицерин и высшие жирные кислоты или их соли – мыла. Щелочной гидролиз жиров называют омылением:
Калиевые и натриевые мыла в воде частично гидролизуются с образованием свободных жирных кислот и гидроксида щелочного металла, поэтому их растворы имеют щелочную реакцию:
При добавлении натриевого мыла к жёсткой воде ионы кальция и магния замещают ионы натрия, образуя нерастворимые и поэтому не обладающие моющим действием кальциевые и магниевые мыла:
44

X. ОКСИКИСЛОТЫ, АЛЬДЕГИДО- И КЕТОКИСЛОТЫ
Оксикислоты (гидроксикислоты) - это соединения, которые содержат в молекуле гидроксильную и карбоксильную группы.
Оксикислоты различаются по основности – числу карбоксильных групп, и атомности – числу гидроксильных групп, включая гидроксил карбоксильной группы.
Простейшая оксикислота НО-СН2-СООН является одноосновной и двухатомной.
Названия оксикислот производят, прибавляя приставку окси – (гидрокси-) к названию соответствующей кислоты.
Положение ОН-группы по отношению к карбоксильной обозначают буквой греческого алфавита (α-, β-, γ- и т.д.) или цифрой. Например:
В ряду оксикислот структурная изомерия связана с изомерией углеродной цепи и положением ОН – группы относительно карбоксильной (α-, β-, γ-).
45

В водных растворах оксикислоты диссоциируют:
По сравнению с незамещёнными карбоновыми кислотами оксикислоты имеют более высокую константу диссоциации, т.е. обладают более сильными кислотными свойствами (рКа молочной кислоты – 3,8).
Оксикислоты проявляют свойства карбоновых кислот и спиртов, а также некоторые специфические свойства, обусловленные взаимным влиянием СООН и ОН групп. Примеры реакций:
46
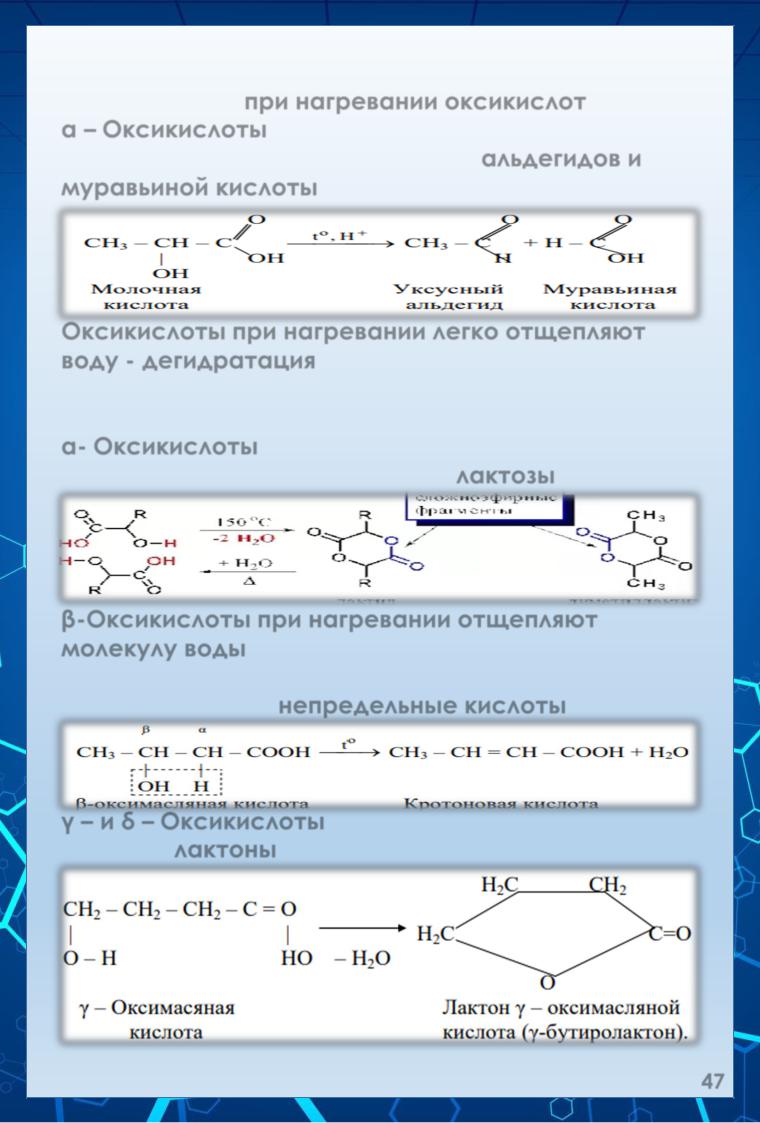
К специфическим свойствам относятся реакции, протекающие при нагревании оксикислот.
α – Оксикислоты при нагревании с разбавленной серной кислотой разлагаются до альдегидов и муравьиной кислоты:
Оксикислоты при нагревании легко отщепляют воду - дегидратация. В зависимости от положения гидроксильной группы (α-, β-, γ-, δ) образуются различные вещества.
α- Оксикислоты при нагревании образуют циклические сложные эфиры – лактозы:
β-Оксикислоты при нагревании отщепляют молекулу воды за счёт спиртового гидроксила и подвижного водорода у α-углеродного атома и превращаются в непредельные кислоты:
γ – и δ – Оксикислоты обр-ют внутренние сложные эфиры – лактоны:
47
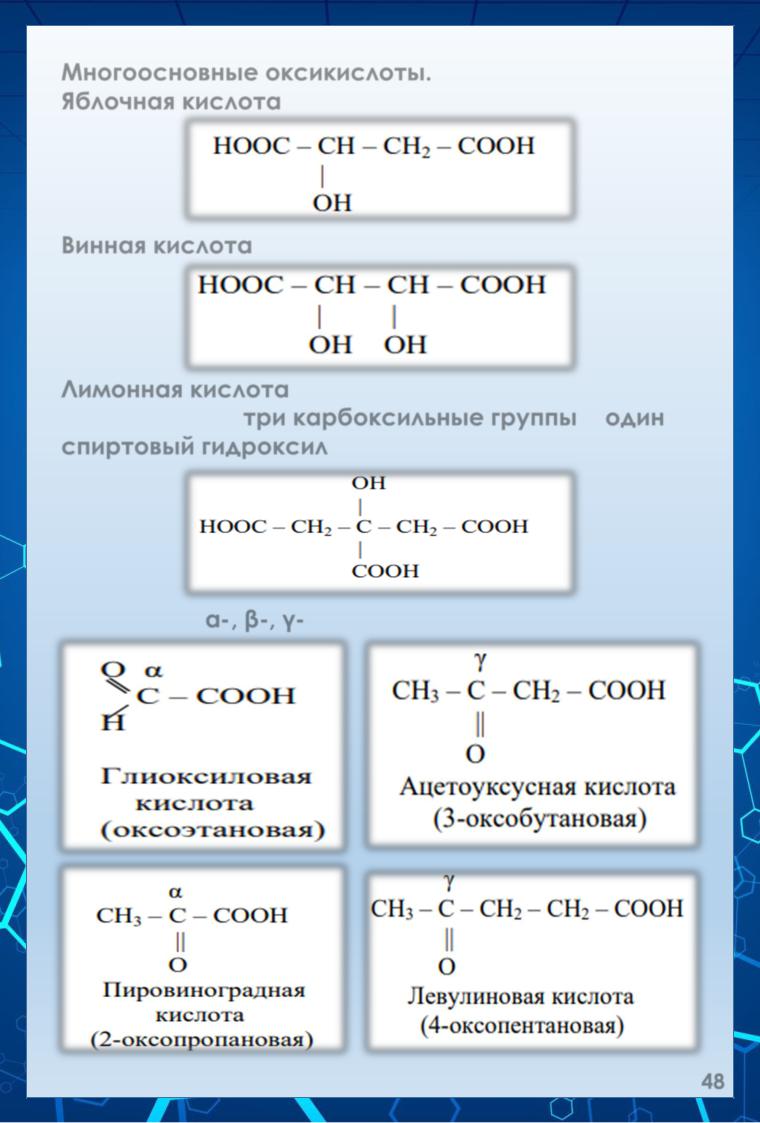
Многоосновные оксикислоты.
Яблочная кислота (α-оксиянтарная кислота).
Винная кислота (α, α' – диоксиянтарная кислота).
Лимонная кислота.
В её молекуле три карбоксильные группы и один спиртовый гидроксил:
Различают: α-, β-, γ- и другие оксокислоты:
48

Оксокислоты проявляют свойства карбоновых кислот и оксосоединений (альдегидов и кетонов). Пировиноградная кислота и β-оксокислоты при нагревании разлагаются с отщеплением оксида углерода (IV) – реакция декарбоксилирования:
Ацетоуксусный эфир – это смесь 2-х таутомеров (кетонной и енольной форм), переходящих друг в друга (этиловый эфир ацетоуксусной к-ты):
В химических реакциях ацетоуксусный эфир образует производные обеих форм, например:
49

Оптическая изомерия (оптическая активность). Оптическая активность – это способность веществ вращать плоскость поляризации света. Оптически активные вещества – это вещества, обладающие способностью вращать плоскость поляризации света.
Оптической активностью обладают ассиметричные молекулы, которые содержат атом углерода, связанный с четырьмя различными заместителями. Такой атом углерода называется ассиметрическим и обозначается знаком С*.
Молекула, содержащая асиметрический атом углерода, может существовать в виде стереоизомеров, различающихся расположением в пространстве заместителей вокруг ассиметрического атома углерода.
Эти изомеры относятся друг к другу как предмет к своему зеркальному отражению. Молекулы их в пространстве не могут быть совмещены. Такие изомеры называются оптическими изомерами или антиподами, но чаще всего энантиомерами. Один изомер вращает плоскость поляризации вправо и называется правовращающим (обозначается знаком «+»), другой – на такой же угол влево и называется левовращающим (обозначается знаком «–»).
Физ-е и хим-е св-ва опт-х изомеров одинаковы. Рацемат – это смесь равного числа молекул лево- и правовращающих изомеров, не обладающая оптической активностью.
Число оптических изомеров равно 2 n, где n – число асимметрических атомов углерода.
50
