

6. Реакция замещения.
Атомы водорода, соединённые с углеводородом при тройной связи, очень подвижны и способны замещаться на металл. При этом образуются металлические производные ацетилениды.
При действии металлического натрия на ацетил образуются моно- и диацетилениды натрия:
В этих реакциях проявляются кислотные свойства ацетилена, обусловленные большей электроотрицательностью (3,1) атома углерода в состоянии sp-гибридизации по сравнению с sp 2 – и sp 3 - гибридизацией (электроотрицательность соответственно 2,8 и 2,5), что вызывает сдвиг электронных плотностей в молекуле.
7. Реакция полимеризации.
При пропускании ацетилена над активированным углем три молекулы его соединяются и образуют циклический углеводород – бензол:
В присутствии солей меди (II) молекулы ацетилена соединяются друг с другом
попарно с обр-ем винилацетилена:
Одна молекула ацетилена
участвует в реакции с разрывом тройной связи,
другая – за счёт подвижного водорода. |
21 |
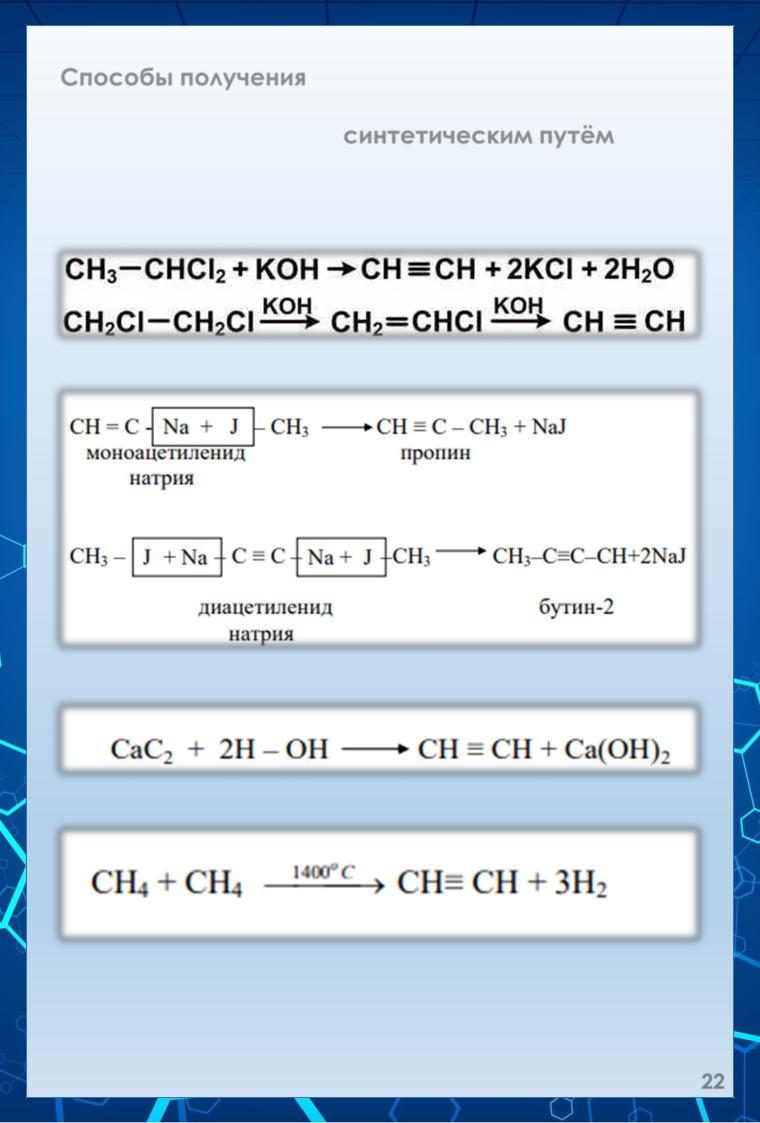
Способы получения.
Ацетиленовые углеводороды не встречаются в природе. Их получают синтетическим путём.
1. Действие спиртового раствора щелочи на дигалогенопроизводные углеводородов:
2. Действие алкилгалогенидов на ацетилениды:
3.Действие воды на карбид кальция:
4.Термический крекинг метана:
22

IV. АЛКАДИЕНЫ
Алкадиены (диеновые углеводороды) – это непредельные углеводороды, в молекулах которых имеются две двойные связи. Общая формула их гомологического ряда СnH2n-2.
Номенклатура. Классификация.
По М.Н. названия диеновых углеводородов строят из названий соответствующих предельных углеводородов путём замены окончания «ан» на «диен». Положение двойных связей указывают цифрами перед названием основы. Например:
По взаимному расположению двойных связей диены делятся на три группы:
1. Диены, у которых двойные связи находятся у одного атома углерода, называются диенами с кумулированными двойными связями. Простейший представитель – аллен.
2. Диены, у которых двойные связи разделены более чем одной простой
связью, называются диенами с изолированными двойными связями.
3. Диены, у которых двойные связи разделены одной простой связью, называются диенами с сопряженными двойными связями. Простейший представитель – дивинил:
23

Химические свойства.
1. Присоединение водорода.
Водород присоединяется преимущественно в положение 1,4:
2. Присоединение галогенов.
Галогены присоединяются в положения 1,4 и 1,2:
3.Присоединение галогеноводородов. Присоединение галогеноводородов идет в основном в положение 1,4, частично идет присоединение в положение 1,2:
4.Реакции полимеризации.
Диеновые углеводороды с сопряженными двойными связями легко полимеризуются. Разрываются двойные связи и мономерные звенья соединяются в положениях 1,4 или 1,2. Используются для получения синтетического каучука. Например, при полимеризации бутадиена-1,3 получается бутадиеновый каучук:
24
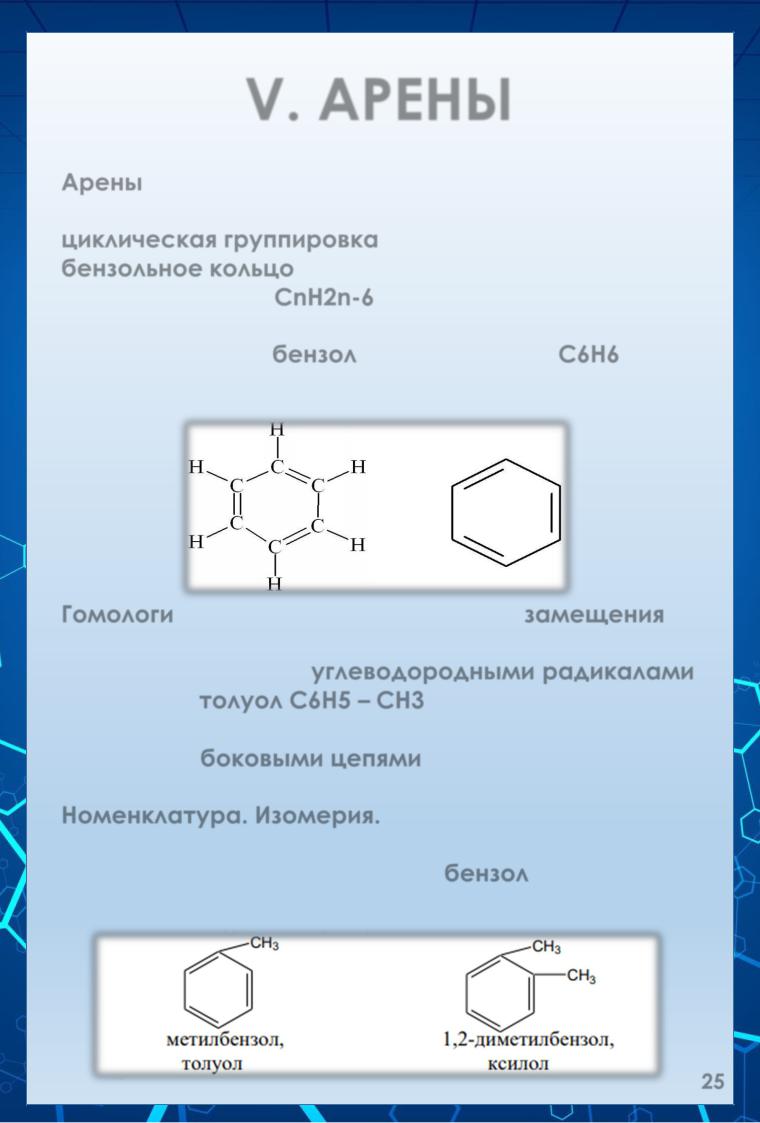
V. АРЕНЫ
Арены (ароматические углеводороды) – это углеводороды, в молекулах которых сод-ся особая циклическая группировка из 6 атомов углерода – бензольное кольцо (ароматическое ядро). Их общая формула СnH2n-6.
Простейший представитель ароматических углеводородов – бензол - имеет состав С6Н6 (строение принято изображать формулой Кекуле).
Гомологи бензола образуются в р-те замещения одного или нескольких атомов водорода бензольного кольца углеводородными радикалами, например, толуол С6Н5 – СН3. Углеводородные радикалы, соединенные с бензольными кольцами, называют «боковыми цепями».
Номенклатура. Изомерия.
Названия гомологов бензола составляют, добавляя к названиям радикалов слово «бензол». Положение радикалов обозначается цифрами. Например:
25
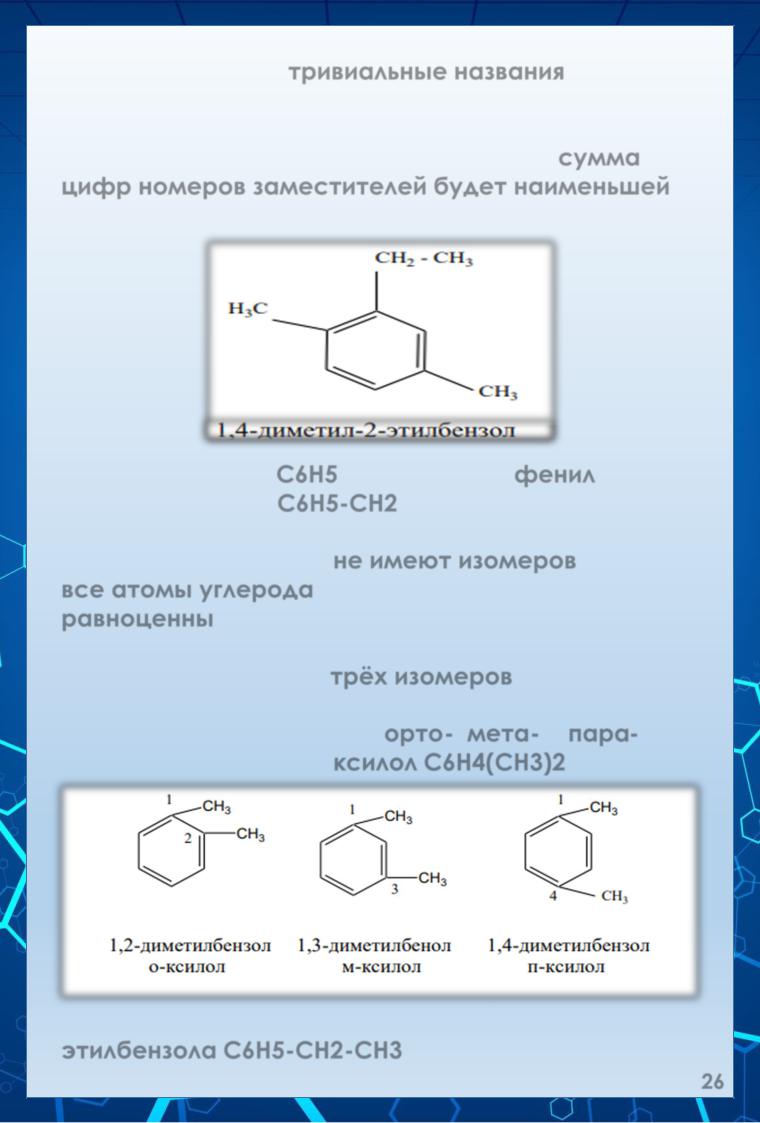
Часто применяют тривиальные названия: толуол, ксилол и так далее. При названии более сложных производных бензола из возможных порядков нумерации выбирают тот, при котором сумма цифр номеров заместителей будет наименьшей. Более короткие цепи называют в первую очередь:
Радикал бензола С6Н5 – называется фенил, радикал толуола С6Н5-СН2 – бензил. Однозамещенные производные бензола, например, С6Н5-СН3, не имеют изомеров, так как все атомы углерода бензольного кольца равноценны.
Двухзамещённые производные бензола могут существовать в виде трёх изомеров, отличающихся положением заместителей относительно друг друга: орто-, мета- и пара- изомеров. Например, ксилол С6Н4(СН3)2:
Ксилол может существовать в изомерной форме этилбензола С6Н5-СН2-СН3.
26
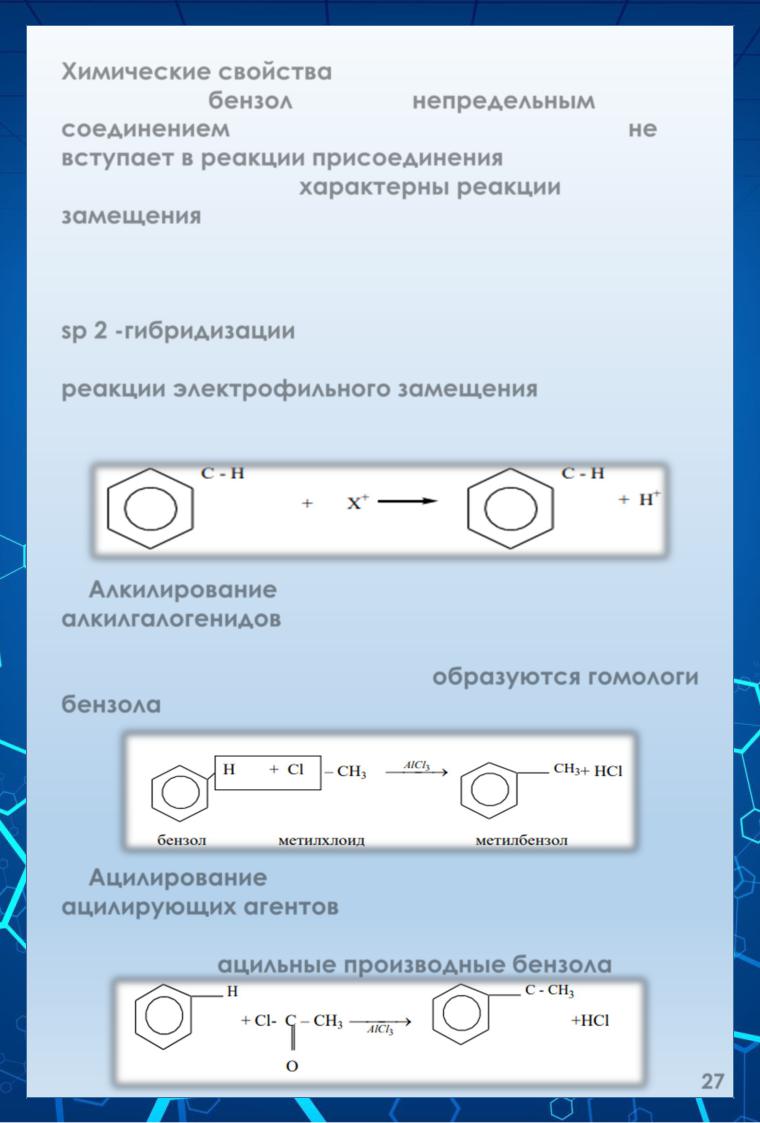
Химические свойства.
По составу бензол является непредельным соединением, однако в обычных условиях он не вступает в реакции присоединения.
Для него наиболее характерны реакции замещения атомов водорода бензольного кольца. Своеобразие химических свойств бензола объясняется его строением. Атомы углерода в молекуле бензола находятся в состоянии
sp 2 -гибридизации.
I. Для ароматических углеводородов характерны реакции электрофильного замещения – реакции, в которых углеродный атом бензольного кольца атакуется электрофильной частицей Х+ :
1.Алкилирование. При действии на бензол алкилгалогенидов в присутствии AlCl3 атом водорода бензольного кольца замещается на алкильный радикал; при этом образуются гомологи бензола (реакция Фриделя-Крафтса):
2.Ацилирование. При действии на бензол ацилирующих агентов (галогенангидриды и ангидриды кислот) в присутствии AlCl3 образуются ацильные производные бензола:
27
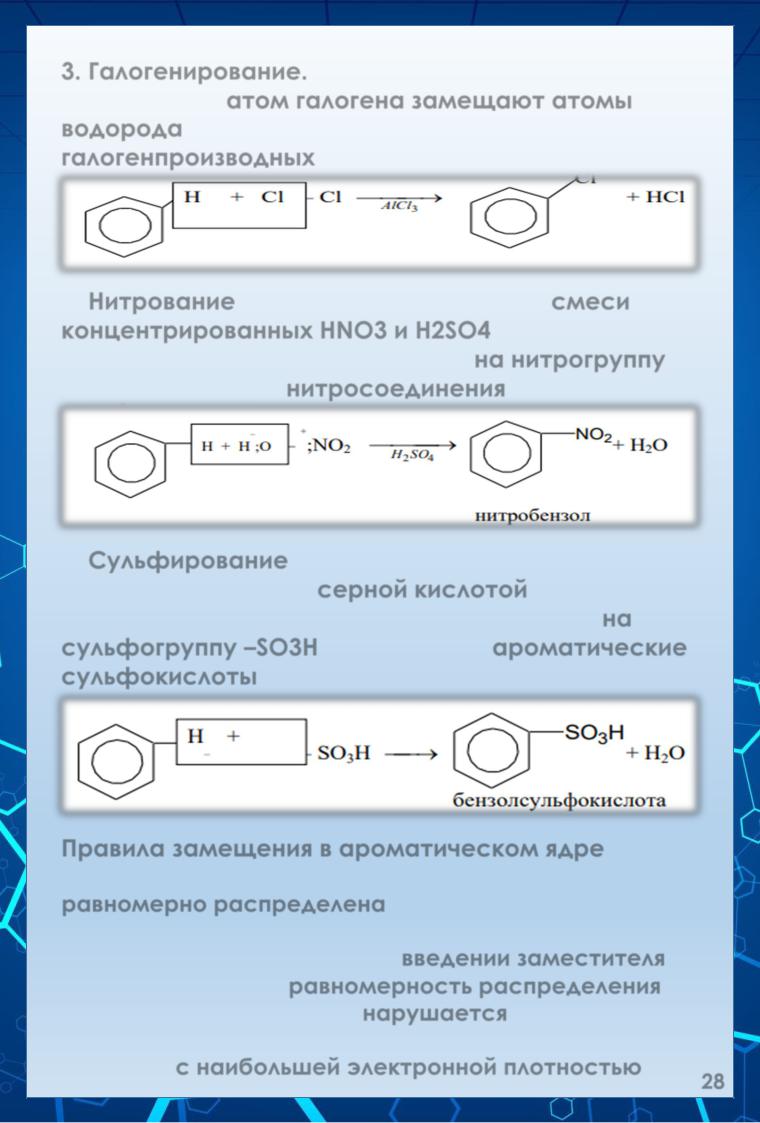
3.Галогенирование. В присутствии катализаторов (AlCl3, FeCl3) атом галогена замещают атомы водорода бензольного кольца с образованием галогенпроизводных:
4.Нитрование. При действии на бензол смеси концентрированных HNO3 и H2SO4 атом водорода бензольного кольца замещается на нитрогруппу NO2. Образуются нитросоединения:
5.Сульфирование. При нагревании бензола с концентрированной серной кислотой атом водорода бензольного кольца замещается на сульфогруппу –SO3H. Образуются ароматические сульфокислоты:
Правила замещения в ароматическом ядре.
В молекуле бензола π – электронная плотность равномерно распределена между атомами углерода, поэтому электрофильная частица может атаковать любой из них. При введении заместителя в бензольное кольцо равномерность распределения π
– электронной плотности нарушается и электрофильная частица будет атаковать атом
углерода с наибольшей электронной плотностью. |
28 |
|

II. Реакции окисления. Бензол устойчив к действию окислителей. Гомологи бензола окисляются легко. При этом боковые цепи, независимо от их длины, превращаются в карбоксильные группы СООН.
В результате образуются ароматические кислоты:
III. Реакции присоединения.
1.Присоединение водорода (гидрирование). В присутствии катализаторов (Pt, Pd, Ni) при нагревании бензол присоединяет 3 молекулы водорода с образованием циклогексана:
2.Присоединение галогенов. Под действием света или УФО к бензолу присоединяется 3 молекулы хлора с образованием гексахлорциклогексена (гексахлорана):
29
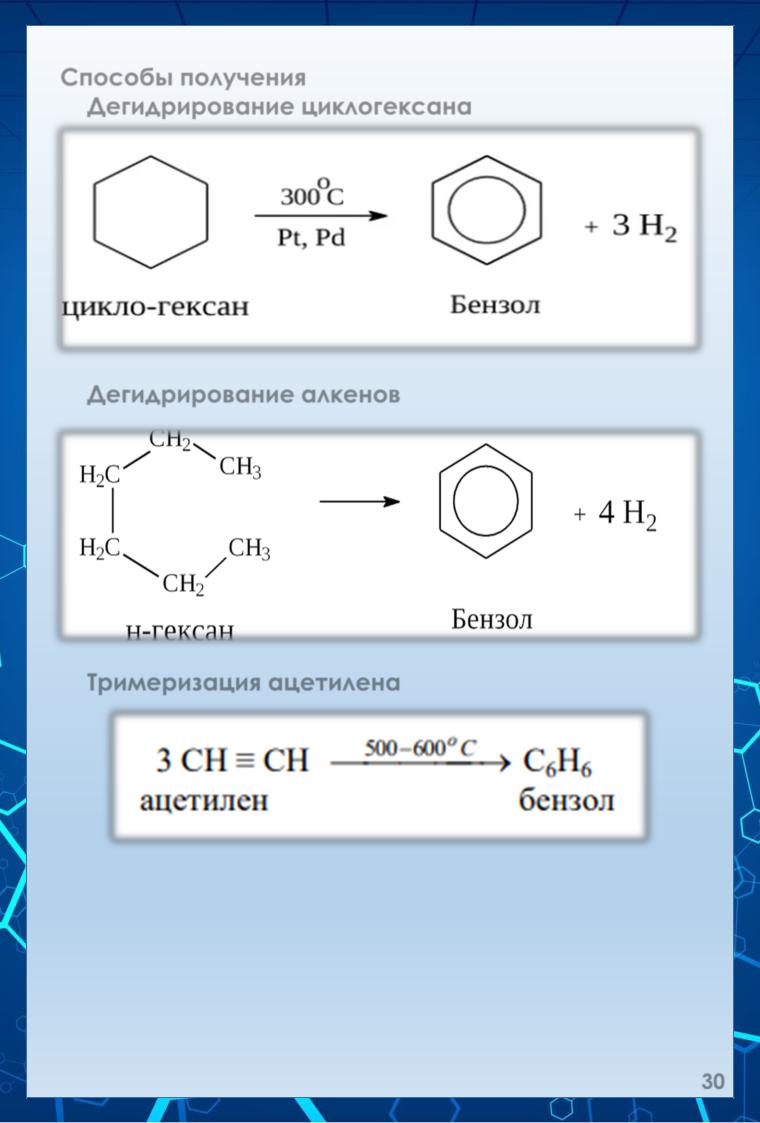
Способы получения.
1. Дегидрирование циклогексана и его гомологов:
2. Дегидрирование алкенов:
3. Тримеризация ацетилена:
30
