
- •ФГБОУ ВО УГМУ Минздрава России
- •План лекции
- •Эритроциты
- •ФУНКЦИИ ЭРИТРОЦИТОВ
- •Строение эритроцита
- •II. Плазмолемма
- •Часть белков плазмолеммы образуют цитоскелет
- •олигосахарид
- •Самые распространенные мембранные белки (более 60%) спектрин, гликофорин и белок
- •Гликофорин
- •Углеводы
- •ОСОБЕННОСТЬ ОБМЕНА ВЕЩЕСТВ
- •Особенности обмена нуклеотидов
- •Особенности обмена углеводов
- •АНТИОКИСЛИТЕЛЬНЫЕ ФЕРМЕНТЫ
- •Обмен метгемоглобина
- •Восстановление
- •ОБРАЗОВАНИЕ ТЕЛЕЦ ХА
- •Насосы – потребители АТФ
- •Особенности липидного обмена
- •Особенности белкового обмена
- •Структура трипептида глутатиона
- •Биосинтез глутатиона
- •Особенность метаболизма при старении эритроцитов
- •СТРОЕНИЕ ГЕМА
- •мявляется простетической группой многих белк
- •СИНТЕЗ ГЕМА
- •НАРУШЕНИЯ СИНТЕЗА ГЕМА. ПОРФИРИИ
- •Негативные последствия порфирий связаны с дефицитом гема и накоплением в организме промежуточных продуктов
- •В коже на солнце порфириногены превращаются в порфирины. О2 при взаимодействии с
- •Порфириногены бесцветны и не флуоресцируют, а порфирины имеют интенсивную красную флуоресценцию в ультрафиолетовых
- •Гемоглобин
- •Синтез гемоглобина
- •Виды гемоглобина
- •Схема образования видов гемоглобина
- •Талассемия
- •Патология биосинтеза
- •При талассемии:
- •-субъединицах НвS в шестом положении вместо ГЛУ находиться ВАЛ. Гидрофобные участок НвS, соединяются
- •Аллостерическая регуляция насыщения гемоглобина кислородом
- •Кривая диссоциации О2 для Hb
- •Сердце
- •Обмен веществ в лейкоцитах
- •Антимикробная система фагоцита
- •Образование NO
- •ФАГОЦИТОЗ
- •Этапы фагоцитоза
- •Спасибо за внимание!
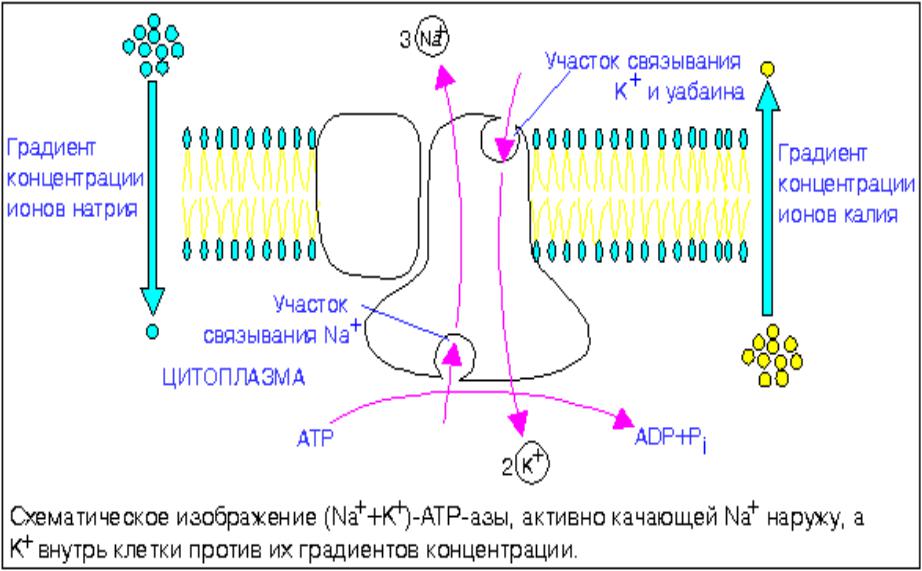
Насосы – потребители АТФ
Na+/K+-АТФ-аза - мембранный фермент поддерживает градиент концентраци Na+ и К+
Патология (сфероцитоз): ↓Na+/K+-АТФ-азы ↑ Na+ в клетке ↑осмотического давления
↑ воды в эритроците ↑ гемолиз |
(метод |
оценки ОРЭ) |
|
Са2+-АТФ-аза - мембранный фермент, выводит из эритроцитов кальций и поддерживает трансмембранный градиент [Са2+]
Особенности липидного обмена
• В зрелом эритроците липиды не
синтезируются, эритроцит может обмениваться липидами с липопротеинами крови.
•Катаболизм липидов неферментативный, повреждение и разрушение липидов происходит в реакциях ПОЛ.
Особенности белкового обмена
•В зрелом эритроците белки не синтезируются, т.к. у него нет рибосом, но в цитоплазме синтезируется глутатион
•Катаболизм белков неферментативный, происходит под действием неблагоприятных факторов: СРО, взаимодействия с тяжёлыми металлами и токсинами
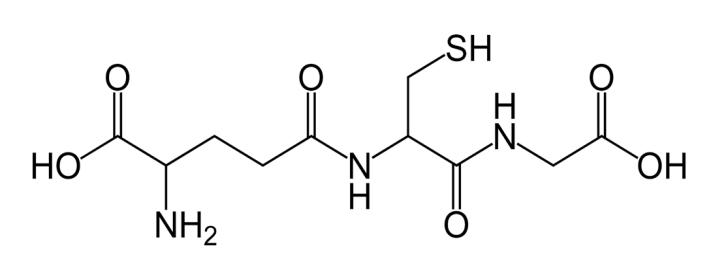
Структура трипептида глутатиона
(L-глутамил-L-цистеинилглицин, GSH)
Биосинтез глутатиона
•Глутатион синтезируется из аминокислот L- цистеина, L-глутаминовой кислоты и глицина.
•Синтез происходит в две АТР-зависимые стадии:
1.Из L-глутамата и цистеина синтезируется γ- глутамилцистеин, фермент - γ-глутамилцистеин синтетаза.
2.Глутатион синтетаза присоединяет глицин к С- концевой группе γ -глутамилцистеина.
Особенность метаболизма при старении эритроцитов
↓ образование АТФ
Нарушаются энергозависимые
процессы восстановления формы эритроцитов сфероцитоз, гемолиз
↓ антиокислительная защита (АОЗ) ↓ повреждение клеточных мембран
гемолиз
↓ 2,3 ДФГ и ↑ сродство Hb к О2↓ транспортная функция Hb
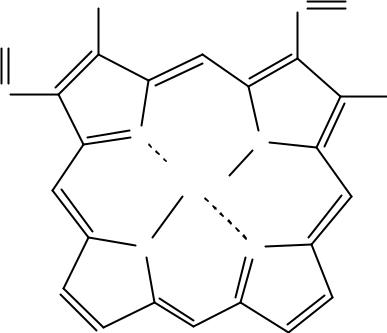
СТРОЕНИЕ ГЕМА
Гем - это порфирин, в центре которого находиться Fe2+.
Fe2+ включается в молекулу порфирина с помощью 2 ковалентных и 2 координационных связей.
CH3 |
HC |
CH2 |
CH2 |
|
|
HC |
|
CH3 |
N |
N |
|

 Fe2+
Fe2+
|
|
|
|
N |
N |
|||
|
H3C |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
||||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
Молекула гема имеет |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
плоское строение. При |
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
||
CH2 |
||||||||
окислении железа, гем |
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
превращается в гематин |
|
|
|
|
CH2 |
|||
|
|
|
|
|||||
|
|
|
|
|
COOH |
|||
(Fe ) |
|
|
|
|
|
|||
3+ |
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
||
|
|
|
|
|||||
мявляется простетической группой многих белк
•гемоглобина,
•миоглобина,
•цитохромов митохондриальной ЦПЭ, цитохрома
Р450,
•ферментов каталазы, пероксидазы, цитохромоксидазы, триптофанпироллазы.
Наибольшее количество гема содержат эритроциты (Hb), мышечные клетки (миоглобин) и клетки печени (цитохром Р450).
Гемы разных белков могут содержать разные типы порфиринов. В геме гемоглобина находится протопорфирин IX, в состав цитохромоксидазы входит формилпорфирин и т.д.
СИНТЕЗ ГЕМА
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гем необходим для синтеза гемоглобина, в гепатоцитах
— для образования цитохрома Р450.
В матриксе митохондрий COOH
COOH |
|
HSKoA CO2 |
CH2 |
|
|
NH |
|||
CH2 |
2 |
|
|
|
+ CH2 |
|
CH2 |
||
CH2 |
|
|||
|
5-Ам ин о левулин ат син т аза |
|||
C O |
COOH |
Â6 |
C O |
|
Глицин |
ãåì |
H2C |
||
|
||||
SKoA |
|
|||
|
железо |
NH2 |
||
Сукцин ил-Ко А |
5-Ам ин о левулин о вая кисло та |
|
|
|
5-ÀËÊ |

|
|
|
COOH |
В цитоплазме |
|
|
COOH |
|
|
COOH |
|
CH2 |
HOOC |
CH2 |
|||
|
|
2Í 2Î |
|
|||||
|
CH2 |
|
CH2 |
|
|
CH |
CH |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
2 |
2 |
H |
CH2 |
O |
C |
5-Ам ин о левулин ат - |
|
|
|
|
C |
+ |
CH2 |
дегидрат аза |
|
|
|
|
|
H N C2 |
|
|
|
|
||||
2 |
|
|
|
ãåì |
H2N |
C |
|
|
|
O |
H2N |
|
|
|
|||
|
|
|
H2 |
N |
|
|||
5-Ам ин о левулин о вая |
5-Ам ин о левулин о вая |
|
|
H |
|
|||
|
|
|
|
|||||
кисло та (5-АЛК) |
кисло та (5-АЛК) |
|
п о рф о билин о ген |
|||||
Порфобилиногендезаминаза
Гидроксиметилбилан
Уропорфириноген III косинтаза
Уропорфириноген III
ропорфириногендекарбоксилаза
Копропорфириноген III
Копропорфриноген III оксидаза
Протопорфириноген IX
Протопорфириногеноксидаза
Протопорфирин IX
Гем Феррохелатаза
