
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / учебник-1-часть-2017
.pdfВ результате набухания клеток, нарушений транспортных систем мембран, синтетических процессов, превалирования эффектов протеолитических ферментов жизнеспособность клеток нарушается, и они гибнут.
Именно эти явления определяют в послешоковом периоде формирование недостаточности органа, что проявляется в неспособности такого органа выполнять специфические функции.
Нарушение функции легких. В начале шока вследствие резкого рефлекторного возбуждения дыхания, усиливается выделение углекислоты, и поэтому рН крови может смещаться в сторону алкалоза. Возникает увеличение энергетических затрат на повышенную вентиляцию легких с последующим снижением работы дыхательного аппарата на фоне регуляторных и обменных расстройств. Вследствие снижения перфузии легких снижается газообменная функция легких. Следствием этих изменений является быстрое увеличение в крови парциального давления углекислого газа. Клинически это проявляется в виде одышки
ицианоза - характерных признаков дыхательной недостаточности. Кроме того, в легких обнаруживается отек и кровоизлияния. Х.П. Шустер и соавт. считают, что для коррекции дыхательной недостаточности у больного должен быть увеличен минутный объем дыхания и содержание кислорода во вдыхаемой смеси. При шоке уменьшается растяжимость и пластичность легких. Если у больного наблюдается «шоковое легкое», то после нормализации артериального давления и устранения шока, у больных продолжают регистрироваться явления дыхательной недостаточности.
Нарушение функции почек. Известно, что при снижении системного артериального давления до 60—70 мм рт.ст. фильтрационное давление в клубочковом аппарате почек становится ниже критического,
ипоэтому выделительная функция их нарушается. При шоке, для которого характерна различной степени гипотензия, количество выделяемой мочи уменьшается (олигурия) или полностью прекращается (анурия). Шок является самой частой причиной острой почечной недостаточности, при которой поражается канальцевый эпителий. Последнее и характеризует шоковую почку. Для острой шоковой почечной недостаточности характерны олиганурия, снижение клиренса креатинина и вы-
деления азотистых продуктов с мочой, нарушение концентрационной функции почек.
Нарушение функции печени при шоке. Практически при всех видах шока имеет место резкое полнокровие печени. В сосудах этого органа, брыжейки и кишечника депонируется значительное количество крови. Расстройства микроциркуляции и гипоксия являются основными причинами нарушений обмена веществ и дезинтоксикационной функции этого органа. При шоке отмечено нарушение образования плазменных факторов свертывания крови (I, И, VII), а в результате гипоксии и гибели клеточных элементов из печени в кровь поступает ряд ферментов (например, лактатдегидрогеназа).
221
Общие принципы лечения шока
Лечение шока должно быть комплексным, обладать преемственностью и этапностью и носить патогенетический характер.
Вэректильной фазе шока, когда у больного имеет место возбуждение нервной, симпато-адреналовой, гипоталамо-гипофизарно-надпо- чечниковой, сердечно-сосудистой систем и наблюдается повышение системного артериального давления, необходимы мероприятия, направленные на нормализацию всех систем, и, таким образом, предотвращение или уменьшение степени выраженности торпидной фазы шока.
Для этого необходима первичная обработка места травмы с соблюдением правил асептики и антисептики, остановка кровотечения, снижение болевой импульсации путем новокаиновой блокады, применения аналгетиков, транквилизаторов бензодиазепинового ряда (феназепам, седуксен), иммобилизация поврежденных частей тела. Указанными мероприятиями достигается уменьшение болевого и эмоционального компонентов стресса, уменьшение вовлечения кардиального и сосудодвигательного центров и нивелирование выраженности расстройств системной гемодинамики и микроциркуляции.
Вторпидной фазе шока лечебные мероприятия должны быть направлены на восстановление объема циркулирующей крови, системного артериального давления, микроциркуляции, эндокринно-обменных расстройств, нормализацию кислотно-основного равновесия, функции нервной системы, дыхания, сердца, почек. Это требует поэтапной и целенаправленной коррекции.
Учитывая снижение объема циркулирующей крови, производят переливание крови, плазмы или плазмозаменителей. При восполнении объема циркулирующей крови предпочтение отдается введению плазмы
иплазмозаменяющих (коллоидных) растворов, содержащих декстраны, желатин, крахмал. Переливание цельной крови может усиливать гемоконцентрацию, нарушать реологию крови и, таким образом, ухудшать микроциркуляцию. Переливание плазмо- и кровезаменителей обеспечивает увеличение венозного возврата крови к сердцу, повышение ударно-
го и минутного объема сердца и, как следствие, нормализацию системного артериального давления.
Исключительно важным является использование вазоактивных веществ, повышающих общее периферическое сопротивление и (или) улучшающих сократительную способность миокарда. К таким средствам необходимо отнести препараты типа адреномиметиков (адреналин, норадреналин). Они возбуждают а-адренорецепторы сосудов, особенно в области прекапиллярных сфинктеров. В сердце влияние осуществляется через β-адренорецепторы, следствием чего является учащение ритма сердца и увеличение силы его сокращения.
Применение вазопрессорных средств повышает общее периферическое сопротивление, увеличивает ударный и минутный объем кровообращения и нормализует системное артериальное давление.
222
По данным Х.П. Шустер и соавт., при шоке показано назначение стимуляторов -адренорецепторов, например, орципреналина. При этом расширяются сосуды кожи, мышц, внутренних органов, кроме почек. Резко учащается ритм сердца. Улучшается микроциркуляция, о чем свидетельствует потепление и порозовение кожи. Хотя общее периферическое сопротивление несколько снижается, однако, в связи с β- стимулирующим действием на сердце системное артериальное давление повышается.
Только в условиях кардиогенного шока назначение орципреналина не рекомендуют, так как он учащает возникновение экстрасистолии и, обладая положительным инотропным эффектом, усугубляет уже имеющуюся гипоксию в миокарде. В этих случаях более целесообразно использование дофамина, так как он обладает «селективным сосудистым воздействием», т.е. вызывает расширение сосудов почек, поджелудочной железы, кишечника, не влияя, практически, на частоту сердечных сокращений. Дофамин дает очень кратковременный эффект и поэтому его рекомендуют вводить с помощью специальных регулирующих инфузионных аппаратов.
Учитывая развитие при шоке метаболического ацидоза и расстройств электролитного баланса, производится их коррекция путем введения бикарбоната натрия и соответствующих электролитов. Наличие резко выраженной гипоксии требует назначения антигипоксантов.
Для лечения шока широко используются гормоны. Глюкагон, например, обладает положительным инотропным эффектом и вызывает увеличение минутного объема сердца и системного артериального давления. Глюкокортикоиды компенсируют надпочечниковую недостаточность, стабилизируют мембраны клеток, в том числе лизосом, предотвращая поступление ферментов в кровь, устраняют агрегацию тромбоцитов и нормализуют микроциркуляцию, снижают уровень вазоактивных веществ. В современных условиях рекомендуют назначение очень больших доз глюкокортикоидов.
Хороший терапевтический эффект дает введение ингибиторов протеолитических ферментов (В.Б. Лемус). Их благотворный эффект обусловлен торможением активности калликреин-кининовой системы и уменьшением образования вазоактивных веществ.
Показано, что чем длительнее торпидная фаза шока, расстройства
системной гемодинамики, микроциркуляции, обмена веществ, |
тем |
хуже эффективность лечения. |
|
Даже после восстановления системного артериального давления в организме могут возникать расстройства, которые и составляют основу травматической, ожоговой болезни. Именно в период травматической, ожоговой болезни после выхода больного из состояния шока отмечаются значительные расстройства иммунитета и склонность больных к инфекционным заболеваниям, неустойчивость системного артериального давления с превалированием гипотензии, формированием анемии, геморрагического синдрома, нарушения функции почек и других органов.
223
ГЛАВА 15. ВОСПАЛЕНИЕ
Воспаление (Inflammation) – типовой патологический процесс, выработанный в ходе эволюции, в основе которого лежит местная реакция целостного организма на действие повреждающего (флогогенного) раздражителя,проявляющаяся на месте повреждения ткани или органа деструкцией клеток, изменениями кровообращения, повышением сосудистой проницаемости, экссудацией, эмиграцией лейкоцитов и пролиферацией клеток.
Возникновение и развитие воспаления определяется двумя факторами — местным повреждением ткани или органа (альтерация) и реактивностью организма. Именно реакция организма на местное повреждение и формирует признаки воспаления. Все факторы, способные вызвать местное повреждение и развитие воспаления, получили название флогогенных (греч. phlogos — воспаление).
Этиология воспаления
Флогогенные факторы подразделяются на две основные группы: экзо- и эндогенные. К экзогенным факторам относятся механические, физические, химические, биологические, иммунологический конфликт, возникающий при действии аллергена на сенсибилизированный организм. К эндогенным: флогогенам относят отложение солей, тромбоз, эмболию и др. Деление флогогенов на экзо- и эндогенные условное, ибо все так называемые эндогенные флогогены возникают в результате экзогенных влияний. Имеются несколько принципов классификации воспаления.
В зависимости от причины, вызывающей воспаление, последнее подразделяется на инфекционное и неинфекционное (асептическое), в том числе и аллергическое. В зависимости от превалирования тех или иных процессов в очаге воспаления оно подразделяется на альтеративное, экссудативное и пролиферативное. В первом случае превалируют элементы повреждения, во втором — сосудистые реакции, особенно повышение проницаемости, а в третьем — превалирование размножения клеточных элементов (пролиферация).
По течению выделяют острое и хроническое воспаление. Острое воспаление обычно протекает в течение не более 4-6 недель. Течение хронического воспаления растягивается на многие месяцы и годы.
Признаки воспаления
При анализе развития воспаления можно выделить морфологические, физико-химические и клинические признаки (таблица 15.1).
|
|
|
|
Таблица 15.1 |
|
|
|
Признаки воспаления |
|||
Морфологиче- |
|
Физико-химические |
|
Клинические |
|
ские |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
1. Альтерация |
1. |
Гиперкалиемия |
1. |
Покраснение (rubor) |
|
|
|
|
|
|
|
2. Экссудация |
2. |
Н-гипериония |
2. |
Припухлость (tumor) |
|
и эмиграция |
|
|
|
|
|
лейкоцитов |
|
|
|
|
|
3. Пролифера- |
3. |
Осмотическая |
3. |
Жар (calor) |
|
ция |
гипертония |
|
|
|
|
|
|
|
|
|
|
|
4. |
Гиперонкия |
4. |
Боль (dolor) |
|
|
5. |
Увеличение медиа- |
5. |
Нарушение функции |
|
|
торов воспаления |
(functio laesae) |
|
||
|
6. |
Повышение темпера- |
|
|
|
|
туры очага воспаления |
|
|
|
|
|
|
224 |
|
|
|
Первые четыре клинических признака воспаления были описаны Цельсом (45 г. до н.э. — 45 г. н.э.). Пятый клинический признак добавлен Галеном (130—210 г. н.э.). Важный вклад в изучение физикохимических признаков воспаления внес Шаде; расстройства кровообращения, в том числе микроциркуляции и реологических свойств исследованы в работах Ю. Конгейма и отечественных ученых В.А. Воронина, A.M. Чернуха, Д.Е. Альперна и их учеников.
Патогенез воспаления
Альтерация и ее патофизиологические механизмы. Для по-
нимания патогенеза воспаления важно знать, какие структуры органа или ткани повреждаются при действии флогогенных факторов. Четкому представлению об этом способствует концепция A.M. Чернуха о функциональном элементе органа. Согласно этой концепции, функциональный элемент представляет «пространственно ориентированный струк- турно-функциональный комплекс», в состав которого входят специализированные (например, печеночные, нервные, мышечные) соединительнотканные клеточные элементы типа фибробластов, гистиоцитов, тучных клеток, Т- и В-лимфоцитов, кровеносное и лимфатическое микроциркуляторное русло, рецепторы, афферентные и эфферентные нервные проводники. Функциональный элемент регулируется нервной, эндокринной системами и гуморальными медиаторами. По современным представлениям, регуляция его осуществляется преимущественно гуморальным путем.
По мнению A.M. Чернуха, деятельность функционального элемента обусловлена наличием локальных и циркулирующих медиаторов. Локальные медиаторы образуются тучными клетками и тромбоцитами (гистамин, серотонин). Особое место занимают тромбоксаны и простагландины. Последние содержатся в неактивном состоянии в любой клетке (за исключением эритроцитов) и активируются при ее повреждении. Норадреналин и ацетилхолин, образующиеся в адрен- и холиноргических нервных окончаниях, также относятся к локальным медиаторам. В процессе жизнедеятельности выделяются также биологически активные вещества полиморфноядерными лейкоцитами, лимфоцитами, макрофагами (цитокины).
Циркулирующие медиаторы представлены кининами, фибринолитической системой и системой комплемента.
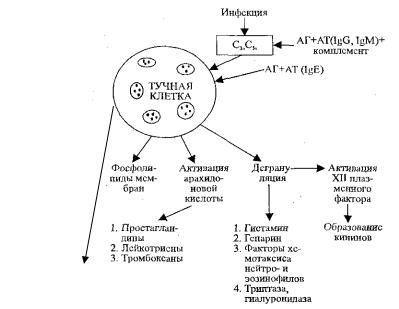
При действии различных флогогенов на функциональный элемент органа возникают метаболические и структурные нарушения различной степени выраженности — от небольших и обратимых до обширных, приводящих к гибели клеток. Инициальные механизмы острого воспаления показаны на рис. 15.1. Как видно из схемы, острое воспаление начинается с первичного повреждения мембраны, особенно тучных клеток. Это обусловлено влиянием таких компонентов комплемента как С3а, С5а, которые образуются в результате активации его альтернативным (при действии эндотоксинов микробов) или классическим путем (комплексом антиген + антитело), т.е. в результате иммунологического конфликта с участием Ig Е, но без участия комплемента с образованием анафилотоксина или же IgМ, IgG и с участием комплемента.
225

В любом случае, следствием этого являются дегрануляция тучных клеток и превращение арахидоновой кислоты с образованием большого количества медиаторов воспаления, основные общие биологические эффекты которых представлены в таблице 15.2. и на рис. 15.1
Таблица 15.2
Общие биологические эффекты медиаторов воспаления
1.Изменение диаметра сосудов (спазм с последующей дилатацией)
2.Повышение проницаемости
3.Хемотаксис, стимуляция фагоцитоза и иммунитета
4.Боль
5.Спазм гладкой мускулатуры
6.Усиление гидролитических процессов
7.Повреждение клеток (вторичная альтерация)
8.Активация свертывания крови
9.Стимуляция пролиферации клеток
10.Ангиогенез
11.Лихорадка
12.Образование острофазных белков
13.Стимуляция иммунитета
Инициальные механизмы острого воспаления при замедленном типе аллергических реакций связаны с образованием лимфокинов, образуемых Т-лимфоцитами-киллерами при взаимодействии их с аллергеном (рис. 15.1).
226
A2
Интерлейкины Il-4, TNF-α
Рис. 15.1. Начальные механизмы острого воспаления
Таким образом, при асептическом и инфекционном воспалении начальные механизмы острого воспаления практически одинаковы.
Выделяют два патогенетических механизма острого летального повреждения клетки (A.M.Чернух) — нарушение транспортных систем
ибиоэнергетики клетки. Полагают, что даже длительное и значительное нарушение синтеза белка, нуклеиновых кислот без повреждения мембран не ведет к гибели клеток.
Таким образом, при действии флогогенного фактора в первую очередь повышается проницаемость клеточных мембран и ее органелл (митохондрий, лизосом, эндоплазматического ретикулума). Калий выходит из клетки, а натрий и вода поступают в клетку и ее органеллы, следствием чего является их набухание. Набухание митохондрий сопровождается разобщением дыхания и окислительного фосфорилирования
иснижением образования макроэргов, которые особенно необходимы для поддержания натриево-калиевого баланса в клетке. Последние изменения усугубляют нарушения электролитного обмена, отечность клеток и ее органелл нарастает. Это ведет к разрыву мембран клеток, митохондрий, лизосом и поступлению из последних около 40 гидролитических ферментов, способных вызвать расщепление белков, жиров и углеводов. Лизируются мембраны органелл, ядра, что и ведет к фрагментации клетки (аутолиз).
Большинство исследователей подчеркивают, что под влиянием воспалительного фактора (особенно в период формирования артериальной гиперемии) в пораженном участке повышается потребление кис-
227
лорода, наблюдается увеличение обмена веществ и последующее его снижение по мере усугубления расстройств кровообращения. С указанных первичных альтеративных изменений и начинается острое воспаление.
Физико-химические нарушения в очаге воспаления. Явления альтерации прогрессируют по мере формирования физико-химических нарушений в очаге воспаления. В настоящее время показано важное значение в развитии воспаления нейтрофилов и макрофагов. Из них лизосомальные ферменты освобождаются не только при разрушении клеток, но и при действии на них С3а и C5а компонентов комплемента. При этом клетка не погибает. Медиаторы воспаления, иммунные комплексы в присутствии комплемента также, как и комплемент, стимулируют процесс дeгрaнуляции лизосом. В то же время цАМФ, колхицин, простагландин Н угнетают освобождение лизосомальных ферментов, тормозя, таким образом, дальнейшее развитие воспаления (А. Хорст).
Хорошо известно, что в клетке содержится в 30 раз больше калия, чем в межклеточном пространстве и поэтому при разрушении клеток в очаге воспаления нарастает количество калия и формируется такой фи- зико-химический признак воспаления, как гиперкалиемия. Степень выраженности гиперкалиемии зависит от интенсивности повреждения клеток. Описано увеличение калия в очаге воспаления в 10-20 раз (Шаде).
Врезультате повышения активности гидролитических ферментов,
атакже возникающей позже вследствие нарушения микроциркуляции гипоксии и преобладания гликолиза накапливаются кислоты — молочная, пировиноградная, аминокислоты, жирные кислоты и др. рН в очаге воспаления постепенно уменьшается и развивается Н-гипериония. Гидролиз белков, жиров и углеводов и рост количества молекул в очаге воспаления обеспечивают увеличение осмотического давления.
Распад клеточных элементов и возникающее позже повышение проницаемости и выход в очаг из кровеносного русла белков крови, несмотря на преобладание протеолиза за счет ферментов лизосом клеток,
вызывают повышение онкотического давления в очаге воспаления.
Сразу же после действия флогогенных факторов наряду с вышеописанными физико-химическими изменениями происходит накопление биологически активных веществ, оказывающих влияние на сосуды микроциркуляторного русла, клеточные реакции очага воспаления. Все медиаторы воспаления оказывают влияние на диаметр и проницаемость сосудов микроциркуляторного русла, на хемотаксис и фагоцитоз. (табл.15.2)
Первыми медиаторами, образующимися при дегрануляции тучных клеток, базофилов и разрушении пластинок являются гистамин и
серотонин. Важным биологическим эффектом их является расширение сосудов, повышение проницаемости капилляров и венул. Гистамин выделяется только в начале воспаления (в течение часа), а затем исчезает.
При повреждении флогогенными факторами эндотелия сосудов происходит активация XII плазменного фактора свертывания крови (фактора Хагемана) и ряда протеолитических ферментов (особенно плазмина), следствием чего является образование из α2-глобулина крови низкомолекулярных соединений, называемых кининами. Их представи-
228
телями являются каллидин и брадикинин. Это типичные медиаторы воспаления, ибо, действуя на микроциркуляторное русло функционального элемента, расширяют сосуды, повышают их проницаемость и принимают участие В формировании болевого ощущения. Показано, что в сравнении с гистамином брадикинин в три раза сильнее повышает проницаемость и является самым мощным болевым агентом. Из арахидоновой кислоты тучных клеток образуются лейкотриены, простагландины и тромбоксаны.
Активация ферментов крови при воспалении носит цепной и даже каскадный характер, при этом каждый последующий этап идет быстрее предыдущего, и реакция протекает по аутокаталитическому варианту. В этой связи приобретают важное значение ингибиторы. Дефицит ингибиторов воспаления может облегчать возникновение и утяжелять течение воспаления. Например, дефицит ингибитора C1 комплемента или С1 экстеразы ведет к чрезмерной активации системы комплемента с высвобождением анафилотоксина, С3а, C5a, гистамина и других медиаторов, повышающих проницаемость кровеносных сосудов.
Хорошо известно, что в любой клетке (кроме эритроцитов) и особенно в тучной содержатся в неактивном состоянии простагландины. При повреждении клеток происходит их активация. Медиаторную функцию при воспалении выполняют простагландины E1 и Е2. Они образуются из арахидоновой и линолевой кислот под действием фермента простагландинсинтетазы. Простагландины очень нестойкие вещества и при прохождении через легкие теряют 98 % своей активности.
В плазме крови человека обнаружен естественный ингибитор простагландинов. Под влиянием глюкокортикоидов он активируется и, ингибируя синтез простагландинов, тормозит воспаление.
Анализируя образование медиаторов воспаления, исследователи считают, что на самых ранних этапах воспалительной реакции выделяются гистамин и серотонин, несколько позже за счет активации калликреинкининовой системы образуются каллидин и брадикинин. Выделение простагландинов происходит на более поздних этапах воспаления. Позже всего выделяются лейкоцитарные медиаторы, т.к. требуется достаточно много времени для их образования и накопления в очаге воспаления.
Лейкоциты очага воспаления образуют ряд дополнительных медиаторов (цитокинов), обеспечивающих такие эффекты как хемотаксис, активацию клеток и фагоцитоза, рост, стимулирование и ингибирование ангиогенеза. В таблицах 15.3, 15.4 и 15.5 представлены важнейшие цитокины и их биологические эффекты.
Кроме медиаторов, влияющих на процессы микроциркуляции, проницаемость сосудов и формирование боли, в очаге воспаления образуются медиаторы, стимулирующие хемотаксис и фагоцитоз. В последнее время показана исключительно важная роль ПМЯ-лейкоцитов и макрофагов в патогенезе воспаления, особенно в повышении проницаемости, некроза и кровоизлияний, что подтверждается торможением указанных эффектов в условиях лейкопении. Механизм патогенных эффектов связан с образованием в результате их дегрануляции катионных белков или полипептидов, протеаз, кининов, лейкотриенов.
229
Катионные белки вызывают повреждение мембран микробов. При фагоцитозе ПМЯ-лейкоциты выделяют фактор проницаемости. Кислые протеазы или катепсины лизосом ПМЯ-лейкоцитов и коллагеназа гидролизуют белки и преципитаты антиген-антитело с образованием активных полипептидов. При воспалении, вызванном аллергическими реакциями замедленного типа образующиеся медиаторы, обладая цитотоксическим действием, инициируют воспаление.
В результате физико-химических изменений и особенно образования медиаторов воспаления происходят расстройства микроциркуляции и реологических свойств крови в очаге воспаления.
Нарушения микроциркуляции и гемореологии в очаге воспаления
Выделяют три стадии расстройств кровообращения:
I стадия - кратковременный спазм и последующее формирование артериальной гиперемии;
II стадия - венозная гиперемия; III стадия - стаз крови.
Флогогенные факторы вызывают раздражение рецепторов функционального элемента и рефлекторное сокращение артериол и прекапиллярных сфинктеров, обеспечивая кратковременную ишемию (в течение от 5—10 секунд до 5 минут). Развитие ее обусловлено также действием катехоламинов и, вероятно, серотонина, выделяющегося из агрегированных в микрососудах тромбоцитов. Однако, образующиеся очень быстро гистамин, кинины, простагландины и другие медиаторы воспаления расширяют артерии и артериолы и обеспечивают формирование артериальной гиперемии. Важная роль в развитии артериальной гиперемии и ее поддержании принадлежит изменению чувствительности а-адренорецепторов сосудов. По данным А.Н. Гордиенко, Zweifach, прекапиллярные сфинктеры сокращаются на аппликацию адреналина 1:250000. При воспалении же в связи с ацидозом, дизионией сосудосуживающий эффект сфинктеров снижается. Такое снижение реакции на адреналин и на симпатические влияния способствует расширению артериол и прекапиллярных сфинктеров и формированию артериальной гиперемии воспалительного происхождения.
Артериальная гиперемия характеризуется увеличением линейной и объемной скорости кровотока, количества функционирующих капилляров. Возрастает гидростатическое давление. Так, по данным Цвайфаха, кровяное давление увеличивается в мелких артериях на 35, артериолах — на 25, капиллярах — на 7, венулах — на 9 см водного столба. Увеличение притока крови, богатой кислородом, способствует усилению окислительно-восстановительных процессов и теплообразования. Поэтому в стадии артериальной гиперемии субъективно и объективно регистрируется повышение температуры в очаге воспаления.
Медиаторы воспаления повышают проницаемость сосудов и выход в очаг воспаления воды и белков различного молекулярного веса в следующей последовательности: альбумины, глобулины, фибриноген.
230
