
Задачи и упражнения / Авдеенко А.П. Сборник задач по неорганической химии
.pdf
6. При сжигании 6,2 г кремневодорода получено 12 г диоксида SiO2. Плотность кремневодорода по воздуху равна 2,14. Вывести молекулярную формулу кремневодорода.
2.3. Расчеты по газовым законам (нормальные условия)
2.3.1. Типовые задачи с решениями
Для осуществления любого расчета по газовым законам для нормальных условий используются следующие формулы:
M ρVM |
Dвоздух |
29 DH 2 2; |
||||
n M |
m |
|
V |
|
nмолекул |
, |
M |
|
VM |
N A |
|||
|
|
|
||||
где М – молярная масса, г/моль; ρ – плотность газа, г/л;
Dвоздух, DH 2 – относительные плотности по воздуху и по водороду;
nM – число молей газа; m – масса газа, г;
V – объем газа, л;
VM – молярный объем, VM = 22,414 л/моль;
nмолекул – число молекул газа;
NA – число Авогадро, NA = 6,022·1023 моль-1.
Используя эти две формулы, можно рассчитать, например:
-число молекул, содержащихся в определенном объеме газа;
-число молей, содержащихся в определенном объеме газа;
-объем, занимаемый определенной массой газа;
-массу определенного объема газа;
-плотность и относительную плотность газа по молярной массе газа;
-молярную массу неизвестного газа на основе плотности или относительной плотности.
Пример 1. Найти число молекул СО2, содержащихся в 11,2 л углекислого газа (н.у.).
Решение.
V nмолекул ;
VM NA
61

nмолекул |
V NA |
11,2 л 6,02 1023 моль |
1 |
3,01 10 |
23 |
молекул. |
|
VM |
|
22,4 л/моль |
|
|
|||
|
|
|
|
|
|
||
Пример 2. Определить число молей SO2, содержащихся в 3 л сернистого газа (н.у.).
Решение. |
|
|
|
|
nM |
|
|
|
V |
|
|
|
1,2 л |
|
|
0,134 моль. |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
VM |
|
|
22,4 л / моль |
|
||||||||||||
Пример 3. Найти объем, занимаемый 32 г СН4 (н.у.). |
|
||||||||||||||||||||||||||
Решение. |
|
m |
|
|
|
V |
; |
|
|
V |
|
m VM |
|
|
32 г 22,4 л / моль |
|
44,8 л. |
||||||||||
|
M |
|
|
VM |
|
|
|
|
M |
|
|
|
16 л / моль |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Пример 4. Определить массу одного литра кислорода (н.у.). |
|
||||||||||||||||||||||||||
Решение. |
m |
|
|
V |
|
|
|
или М = ρVM, так как масса одного литра, по опре- |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
M |
|
VM |
|
|
|||||||||||||||||||||||
делению, – это плотность, |
|
|
|
|
|
m |
, |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
ρ |
|
|
M |
|
|
|
|
32 г/моль |
|
1,43 г/л, |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
VM |
|
|
|
|
22,4 г/моль |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
т.е. масса одного литра газа m = 1,43 г. |
|
|
|
|
|
|
|||||||||||||||||||||
Пример 5. Найти относительную плотность хлора по воздуху. |
|
||||||||||||||||||||||||||
|
|
|
Cl2 |
|
|
|
MCl2 |
71 |
|
|
|
|
|
|
|||||||||||||
Решение. |
|
Dвоздух |
|
|
|
|
|
|
|
|
|
|
|
|
|
2,45, где Мвоздух = 29 г/моль. |
|||||||||||
|
|
|
29 |
|
29 |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Пример 6. Найти молярную массу неизвестного газа, если относительная |
|||||||||||||||||||||||||||
плотность его по водороду равна 22. |
|
|
|
|
|
|
|||||||||||||||||||||
Решение. |
MX |
|
|
DHX |
|
|
|
2 22 2 44 г / моль. |
|
||||||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Пример 7. Определить объем, занимаемый 2 моль углекислого газа (н.у.). |
|||||||||||||||||||||||||||
Решение. |
nM |
|
|
V |
|
|
|
|
V |
|
VM nM |
|
22,4 2 44,8 л. |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
VM |
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Пример 8. Определить объем, занимаемый 5,4·1022 молекулами кислоро-
да (н.у.).
Решение.
V |
|
nмолекул |
V |
VMnмолекул |
|
22,4 5,4 1022 |
2 л. |
VM |
|
NA |
NA |
6,02 1023 |
|||
|
|
|
|||||
|
|
|
|
62 |
|
|
|
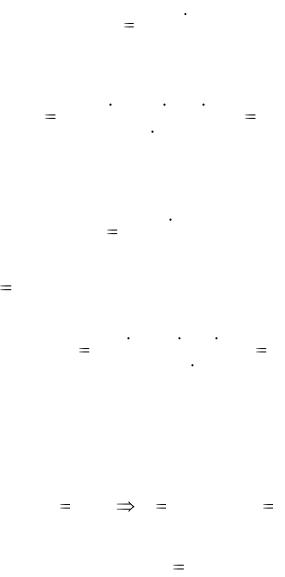
2.4.Расчеты по уравнению состояния идеальных газов
2.4.1.Типовые задачи с решениями
Во всех расчетах используется уравнение Клапейрона-Менделеева:
pV=1000 nRT
или
рV=1000 m/M RT,
если объем измеряется в литрах, давление – в паскалях, масса – в граммах, молярная масса – в граммах на моль, температура – в кельвинах и R =
8,314 Дж/(моль·К).
Пример 1. Масса 227 мл газа, взятого при температуре 37оС и при давлении 730 мм рт.ст., равна 0,313 г. Определить молярную массу этого газа.
Решение. |
M |
mRT 1000 |
, |
|
|
|
|
|
|||||
|
|
pV |
|
|
|
|
где р = 97325 Па; |
V = 0,227 л; Т = 310 К. |
|
||||
M |
0,313 8,314 103 |
310 |
36,5 г / моль. |
|||
97325 0,227 |
|
|
|
|||
|
|
|
|
|
||
Пример 2. Определить объем, занимаемый 140 г азота при температуре 32оС и при давлении 2,8 атм.
Решение. |
|
V |
|
mRT 1000 |
, |
|
||
|
|
|
||||||
|
|
|
|
|
|
pM |
||
где MN |
2 |
28 г / моль; |
Т = 305 К; р = 283710 Па. |
|||||
|
|
|
|
|
|
|
|
|
|
|
V |
140 8,314 305 103 |
44,7 л. |
||||
|
|
|
|
283710 28 |
||||
|
|
|
|
|
|
|||
Пример 3. Определенное количество газа занимает объем 152 мл при давлении 745 мм рт.ст. и температуре 25оС. Найти объем того же количества газа при нормальных условиях (Т1=273 К; р1=101 325 Па).
Решение. |
pV nRT n |
pV |
или n |
p1 V1 |
; |
|
|
||||
|
|
RT |
|
RT1 |
|
pV |
|
p1 V1 |
, |
|
|
||
RT |
|
R T1 |
|
|
63 |
|
|
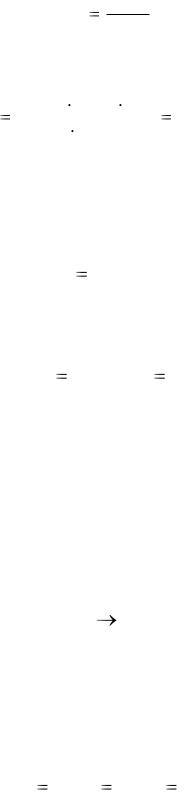
где р, V, T – начальные условия; р1, V1, T1 – конечные условия;
pVT1 V1 TP1 ,
где р = 99 325 Па; Т = 298 К; V = 0,152 л;
V1 |
99325 0,152 |
273 |
0,1365 л. |
|
|
|
|
||
298 101325 |
|
|||
|
|
|
||
Пример 4. В закрытом металлическом сосуде находится газ при температуре 20оС. До какой температуры необходимо нагреть этот газ, чтобы увеличить его давление в 3 раза?
Решение. |
|
|
pV |
|
|
P1V1 |
, |
|
|
|
||
|
|
|
T |
T1 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||
где р1 = 3 р; Т = 293 К; V1 = V. |
|
|
|
|
||||||||
|
|
pV |
|
3 pV |
; |
1 |
|
3 |
; |
|||
|
|
|
|
|
|
|
|
|
||||
|
|
T |
|
T1 |
T |
T1 |
||||||
|
Т1 = 3Т = 3·293 = 879 К, |
или t1 = 606оС. |
||||||||||
2.5.Расчеты по уравнениям химических реакций
2.5.1.Типовые задачи с решениями
Задача № 1. Пусть общая схема химической реакции –
aA + bB |
cC + dD, |
где А и В – исходные вещества; С и D – продукты реакции; а,b,c,d – коэффициенты.
Тогда можно записать уравнение
nM,A |
|
nM,B |
|
nM,C |
|
nM,D |
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
||
a |
|
b |
|
c |
|
d |
|
где nM – число молей каждого вещества, участвующего в реакции.
64
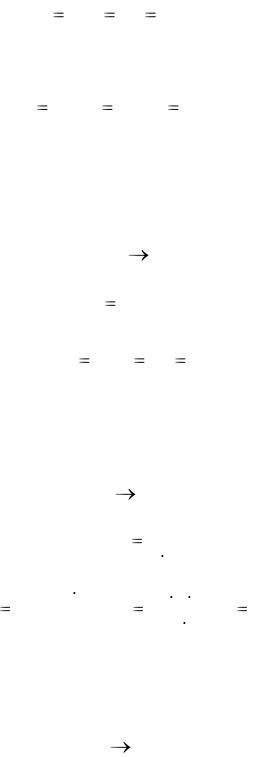
Предположим, что количество данных веществ выражено следующим образом:
а) для А – в молях; б) для В – в объеме (то есть В – газообразное вещество); в) для С – в граммах;
г) для D – количеством молекул. Так как известно, что
nM |
V |
|
m |
|
nмолекул |
, |
VM |
|
M |
|
NA |
||
|
|
|
|
получаем формулу для расчетов по уравнению химической реакции:
nM, A |
|
V |
|
m |
C |
|
nмолекул,D |
|
|
|
B |
|
|
|
|
. |
|
a |
|
VM b |
|
MC c |
|
NA d |
||
|
|
|
|
|||||
Пример 1. Определить число молей углекислого газа СО2, полученного в результате сгорания 24 г углерода.
Решение. Уравнение реакции горения углерода –
С + О2 |
|
|
СО2. |
||||||||
|
|
m |
C |
|
nM,CO |
2 |
; |
||||
|
|
|
|
|
|
|
|||||
|
|
MC |
|
1 |
|
|
|||||
|
|
|
|
|
|
||||||
n M,CO |
|
|
|
mC |
|
24 |
|
|
2 моль. |
||
2 |
|
MC |
12 |
|
|
||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||
Пример 2. Определить объем кислорода, необходимый для сгорания 17 г аммиака.
Решение. Уравнение реакции горения аммиака –
|
4NH3 + 3O2 |
2N2 + 6H2O. |
|
||||||
|
|
|
m NH 3 |
|
VO2 |
; |
|
|
|
|
|
|
4 M NH 3 |
|
3 VM |
|
|
||
|
|
|
|
|
|
|
|||
VO2 |
|
mNH 3 3 VM |
17 3 22,4 |
|
16,8 л. |
||||
|
4 M NH |
3 |
|
4 17 |
|
||||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
Пример 3. Определить число молекул воды, образующееся при сгорании 10 л метана, н.у.
Решение. Уравнение реакции горения метана –
СH4 + 2O2 |
СО2 + 2H2O. |
65

|
|
|
VCH4 |
|
nмолекул,H2O |
, |
; |
|
|
|
||
|
|
|
1VM |
|
2 NA |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||
nмолекул,H |
O |
VCH4 2 NA |
10 2 6,02 1023 |
5,4 10 |
23 |
молекул. |
||||||
|
|
|
|
|
|
|
|
|||||
2 |
|
VM |
22,4 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||||
Задача № 2. Расчеты по уравнению химической реакции с реактивом, содержащим примеси.
Перед обычным расчетом по уравнению химической реакции определяется количество чистого реактива.
Пример. Какую массу оксида кальция и какой объем углекислого газа (н.у.) можно получить при термическом разложении 20 г известняка, содержащего 80 % карбоната кальция?
Решение.
|
mв ва с примесью % содержания чистого в |
ва |
|
а) mчистого в ва |
|
|
; |
100% |
|
||
|
|
|
|
mCaCO 3 |
|
|
mизвестняка % CaCO3 |
|
20 80 |
16 г. |
||||||||||||||||||
|
100% |
|
|
|
|
|
|
|
|
|
100 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
б) CaCO3 |
t |
CaO CO2 |
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
mCaCO3 |
|
|
mCaO |
|
|
|
VCO2 |
|
; |
|
|||||||||||
|
|
1MCaCO3 |
|
|
1MCaO |
|
|
|
1VM |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
mCaO |
|
|
mCaCO |
3 |
MCaO |
16 56 |
8,96 г; |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
MCaCO |
3 |
|
|
|
100 |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VCO2 |
|
|
|
mCaCO3 VM 16 22,4 |
|
|
3,58 л. |
||||||||||||||||
|
|
|
|
MCaCO |
3 |
|
|
|
|
100 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задача № 3. Расчеты по уравнению химической реакции с избытком одного из реактивов.
Предположим, что реактив В взят в избытке, тогда формула для расчетов по уравнению химических реакций примет вид
nM,A |
|
VB |
|
mC |
|
nмолекул,D |
. |
a |
|
b VM |
|
c MC |
|
d NA |
|
|
|
|
|
||||
|
|
|
66 |
|
|
|
|

Член уравнения, содержащий реактив в избытке, исключается из расчетов. Расчеты ведут по реактиву, взятому в недостатке. Возможен также расчет избытка реактива:
mизбытка реактива = mвзятая для реакции – mпрореагировавшая.
Пример. Определить массу нитрата натрия, образующегося в результате взаимодействия 130 г азотной кислоты с двумя моль гидроксида натрия. Какой реактив взят в избытке и какова масса избытка этого реактива?
Решение. Определяем вещество в избытке:
NaOH + HNO3 |
NaNO3 + H2O; |
|||||||
nM,NaOH |
2 моль; |
mHNO3 |
130 |
2,06 моль. |
||||
1 |
1M HNO |
3 |
|
63 |
|
|||
|
|
|
|
|
|
|
|
|
Таким образом, азотная кислота взята в избытке:
nM,NaOH |
|
mHNO |
|
|
|
3 |
. |
|
|
||
1 |
1MHNO |
||
|
3 |
|
|
Расчет производится по реактиву, взятому в недостатке, т.е. по гидроокиси натрия:
|
|
n M,NaOH |
|
|
mNaNO |
|
||
|
|
|
|
|
|
|
3 |
; |
|
|
1 |
|
|
1M NaNO |
|||
|
|
|
|
|
||||
|
|
|
|
|
|
|
3 |
|
mNaNO |
3 |
n M,NaNO |
3 |
M NaNO |
3 |
2 85 170 г. |
||
|
|
|
|
|
|
|||
Расчет массы кислоты, необходимой для реакции с двумя моль гидроокиси натрия:
|
n M,NaOH |
|
mHNO |
|
|
|
|
|
|
3 |
|
; |
|
1 |
1 M HNO |
3 |
||||
|
||||||
|
|
|
|
|
||
mHNO3 n M,NaOH M HNO3 |
2 63 126 г. |
|||||
Расчет массы избытка азотной кислоты:
mизбытка mвзятая для реакции mвступившая в реакцию =
= 30 – 126 = 4 г.
67
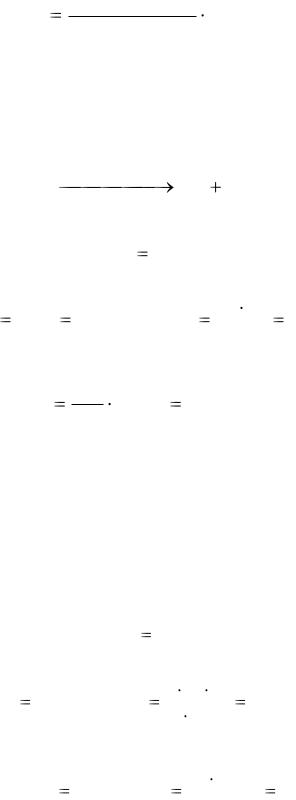
Задача № 4. Расчеты с практическим выходом реакции.
Практический выход реакции Rпр – это отношение реального количества полученного вещества к его теоретически возможному количеству согласно уравнению реакции:
mреальная
R пр mтеоретическая 100 %.
Пример 1. Получено 620 г кислорода электролизом 40 моль воды. Определить практический выход реакции.
Решение. а) Вначале рассчитываем теоретическую массу кислорода по уравнению реакции
|
2H2O |
|
электролиз |
O2 |
|
2H2 ; |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
nM,H |
O |
|
mO |
2 |
|
|
|
|
||
|
|
|
2 |
|
|
|
|
; |
|
|
|||
|
|
|
1 |
|
|
1MO |
|
||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
nM,H |
O MO |
2 |
|
40 32 |
|
|
|||
mтеор |
mO |
|
|
|
2 |
|
|
|
|
|
|
640 г. |
|
2 |
|
|
2 |
|
|
|
2 |
|
|||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||
б) Определяем практический выход реакции
R пр 620640 100% 96,88 %.
Пример 2. Практический выход реакции синтеза аммиака равен 30%. Какова масса аммиака, полученного из 90 л водорода, взятого для реакции синтеза
(н.у.)?
Решение. а) Находим теоретическую массу аммиака:
|
|
3H2 + N2 |
|
2NH3; |
|
||||||
|
|
|
m NH 3 |
|
|
|
VH 2 |
; |
|
|
|
|
|
|
2 M NH 3 |
|
|
|
3VM |
|
|
||
|
|
|
|
|
|
|
|
|
|||
mNH |
|
2 M NH 3 VH |
2 |
|
|
2 17 90 |
45,54 г. |
||||
3 |
|
3VM |
|
|
|
|
3 22,4 |
|
|||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||||
б) Находим по практическому выходу реакции реальную массу аммиака:
mреальная NH |
|
R пр mтеор |
|
30 45,54 |
13,66 г. |
|
3 |
100 % |
|
100 |
|
||
|
|
|
||||
|
|
|
|
|||
|
|
68 |
|
|
|
|

2.5.2Задачи для самостоятельного решения
1.Определить молярную массу газа, если 0,29 л его при температуре 29оС
идавлении 1,064·105 Па (800 мм рт.ст.) имеют массу 0,32 г.
2.Сколько нужно взять карбоната кальция, чтобы полученным при его разложении диоксидом углерода наполнить баллон емкостью 40 л при темпера-
туре 15оС и давлении 1,013·106 Па?
3. Какой объем кислорода, взятого при 300оС и давлении 5,06·105 Па, израсходовался на сгорание 10 кг каменного угля до образования СО2, если в угле содержалось 94% С?
4. В электрической печи из 20 кг оксида кальция было получено 16 кг карбида кальция. Реакция протекает по уравнению СаО + 3С = СаС2 + СО. Определить выход карбида кальция и объем оксида углерода при температуре 546оС и давлении 1,013·105 Па.
5.При пропускании над катализатором смеси, состоящей из 10 моль SO2
и15 моль O2, образовалось 8 моль SO3. Сколько моль CO2 и O2 не вступило в реакцию?
3. ЭКВИВАЛЕНТ, ЭКВИВАЛЕНТНАЯ МАССА. ЗАКОН ЭКВИВАЛЕНТОВ
3.1. Типовые задачи с решениями
Задача № 1. Определить эквивалентные массы металлов в следующих соединениях: Na2SO4; K2MnO4; MnO2; Mn2O7; PbO2; Cr2(SO4)3; AlCl3.
Пример. Определить эквивалентную массу марганца в Mn2O7.
Решение. По химической формуле определяем валентность марганца: BMn = 7. Затем по формуле для определения эквивалентных масс химических элементов находим эквивалентную массу марганца:
ЭMn |
MMn |
|
55 |
7,9 г / моль. |
|
BMn |
|
7 |
|
||
|
|
|
|||
Задача № 2. Определить эквивалентные массы следующих химических соединений: PbO2; Mn2O7; Ni(OH)2; Fe(OH)3; HNO2; H3PO4; CaCl2; Al2(SO4)3.
69

Пример. Определить эквивалентную массу H3PO4.
Решение. Для кислот эквивалентная масса определяется по формуле
Экислоты |
Mкислоты |
. |
|
nH |
|||
|
|
Так как число атомов водорода кислоты nH, участвующих в реакции, не указывается, в расчетной формуле принимается максимальное число атомов водорода в кислоте, способных участвовать в реакции: nH=3.
ЭH |
|
PO |
|
M H 3PO4 |
|
98 |
32,7 г/моль. |
|
3 |
4 |
3 |
|
3 |
|
|||
|
|
|
|
|||||
|
|
|
|
|
|
|||
Задача № 3. Вычислить эквивалентную массу металла, зная, что его хлорид содержит 65,57 % хлора. Эквивалентная масса хлора равна
35,45 г/моль.
Решение. Так как |
mCl |
|
% Cl |
|
, запишем |
|
|
% Cl |
|
ЭCl |
; |
||
mMe |
% Me |
|
|
% Me |
|
ЭMe |
|||||||
|
|
|
|
|
|
|
|||||||
% Me = 100 % – % Cl = 100 – 65,57 = 34,43 %; |
|||||||||||||
ЭMe |
% Me ЭCl |
34,43 35,45 |
18,62 г/моль. |
||||||||||
|
% Cl |
|
|
65,57 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||
Задача № 4. 5,2 г металла взаимодействуют с 3,5 г азота, образуя нитрид. Какой это металл, если его валентность равна 1, а валентность азота – 3?
Решение. Согласно закону эквивалентов
mMe |
|
ЭMe |
; Э |
|
4,67 г / моль; |
|
|
N |
|||
mN |
|
ЭN |
|
||
|
|
|
|||
|
ЭMe |
mMe ЭN |
|
5,2 4,67 |
6,9 г/моль; |
||||
|
mN |
|
|
3,5 |
|
||||
|
|
|
|
|
|
||||
ЭMe |
MMe |
|
MMe |
ЭMe B; MMe 6,9 1 6,9 г/моль. |
|||||
B |
|||||||||
|
|
|
|
|
|
|
|||
Неизвестный металл – литий, с молярной массой, равной 6,9 г/моль.
Задача № 5. 5 г алюминия, взаимодействуя с кислородом, образуют 9,44 г оксида алюминия. Найти эквивалентную массу алюминия и его валентность. Определить химическую формулу оксида алюминия.
Решение. |
m Al |
|
Э Al |
|
, |
mO |
|
ЭО |
|
||
|
|
|
|
||
где ЭО = 8 г/моль; |
|
|
|
|
|
|
|
|
|
70 |
|
