
Задачи и упражнения / Авдеенко А.П. Сборник задач по неорганической химии
.pdf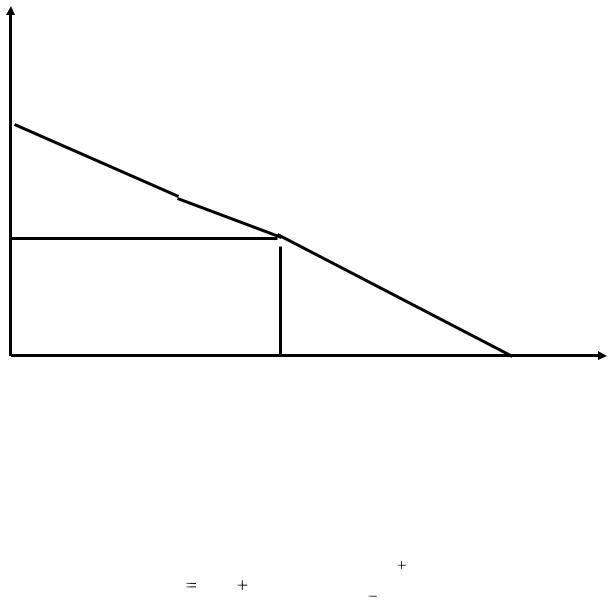
При рН > 4,5 равновесие 1 не существует, так как хлор не может существовать в растворе, он подвергается диспропорционированию:
Cl2 + H2O HClO + Cl¯ + H+ .
Е, B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HClO |
|
|
|
|
|
|
|
|
|
|
|
||||
1,63 |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1,36 |
|
Cl2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1,27 |
|
|
|
|
Cl¯ |
|
|
|
|
|
|
ClO¯ |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
0,89 |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
4,5 |
|
7,5 |
14 |
рН |
||||||||||||
Рис.19. Диаграмма EOx/Red-pH для хлора в воде
Третье равновесие дает прямой переход от НСlO к Cl¯:
3. HClO + H+ + 2e Cl¯ + 2H2O; |
Eo = 1,49 B; |
|||
E3 1,49 |
0,06 |
lg |
[HClO] [H ] |
; |
2 |
|
|||
|
|
[Cl ] |
||
Е3 = 1,49 – 0,03 рН.
Прямая, выражающая третье равновесие, лимитирована отрезком, так как
HClO существует лишь до рН = 7,5 (при рН = 7,5 концентрации HClO и ClO¯ становятся равными).
4. HClO ClO¯ + H+.
Это равновесие диссоциации кислоты нe зависит от редокспотенциала, поэтому оно представлено отрезком прямой, параллельным оси ординат: рН = 7,5.
251
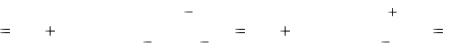
Пересечение прямых 4 и 3 дает точку, потенциал которой Е = 1,49 – 0,03∙7,5 = 1,265 В.
При рН > 7,5 существует равновесие 5:
5. ClO¯ + H2O + 2e Cl¯ + 2OH¯;
E5 = 0,89 B при рН = 14.
E5 |
Eo |
0,06 |
lg |
[ClO ] |
Eo |
0,06 |
lg |
[H ]2 |
|
[Cl ] [OH ]2 |
|
(10 14 )2 |
|||||
|
2 |
|
2 |
|
||||
= Ео – 0,06 рН + 0,84; Ео + 0,84 = Е'o. Е5 = Е'o – 0,06 рН.
Е10 определяем, зная, что E5 = 0,89 В при рН = 14:
Е10 = Е5 + 0,06∙14 = 0,89 + 0,84 = 1,73;
Е5 = 1,73 – 0,06 рН.
Все эти прямые, выражающие соответствующие равновесия, лимитированы отрезками, так как при определенных значениях рН один из составных компонентов равновесия не может существовать.
252
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1.Глинка Н.Л. Общая химия. – Л.: Химия, 1983. – 719 с.
2.Курс общей химии / Под ред. Н.В.Коровина. – М.: Высш. шк., 1981. –
431 с.
3.Авдеенко А.П. Химия и неорганическая химия: Справоч. пособие к лекционному курсу. – Ч.I. – Киев: ИСИО, 1993. – 235 с.
4.Поляков О.Є. Посібник-довідник до лекційних курсів “Хімія” і “Неорганічна хімія”. – Ч.2. – Київ: ІСДО, 1994. – 172 с.
253
СОДЕРЖАНИЕ
Стр.
Термины, условные обозначения . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3 Числовые значения некоторых констант . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 Перевод единиц разных систем в единицы СИ . . . . . . . . . . . . . . . . . . . . . . . . . 9 Преобразование некоторых кратных и дольных единиц . . . . . . . . . . . . . . . . . 10
Греческий алфавит . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10
Таблица растворимости некоторых солей и оснований. . . . . . . . . . . . . . . . . . 10 1. Основные классы неорганических соединений . . . . . . . . . . . . . . . . . . . . . . . 12 2. Основные понятия и законы химии. Расчеты по химической
формуле, уравнению химической реакции и по газовым законам . . . . . . . 54 3. Эквивалент. Эквивалентная масса. Закон эквивалентов . . . . . . . . . . . . . . . 69 4. Строение атома. Периодический закон . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73 5. Химическая связь . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78 6. Термохимические и термодинамические расчеты . . . . . . . . . . . . . . . . . . . . 83 7. Химическая кинетика и химическое равновесие . . . . . . . . . . . . . . . . . . . . . 92 8. Концентрация растворов. Растворы неэлектролитов.
Растворимость . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 101 9. Электролитическая диссоциация . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 115
10.Водородный показатель. Произведение растворимости.
Гидролиз солей . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 123
11. Окислительно-восстановительные (ОВ) реакции . . . . . . . . . . . . . . . . . . . 138 12. Химические источники постоянного тока.
Электрохимические расчеты . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 142
13. Электролиз растворов и расплавов электролитов.
Законы электролиза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 152 14. Коррозия металлов. Методы защиты металлов
от коррозии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 162
15. Химические свойства металлов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 172 16. Обзор химических свойств d-металлов . . . . . . . . . . . . . . . . . . . . . . . . . . . . 179 17. Обзор свойств р-элементов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 187 18. Закономерности изменения свойств бинарных соединений . . . . . . . . . . . 195 19. Комплексные соединения . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 200
254
Стр.
20. Элементы аналитической химии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 208 21. Элементы органической химии. Полимерные материалы . . . . . . . . . . . . . 215
22. Задачи повышенной трудности . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 228 22.1. Электролитическая диссоциация. Буферные растворы.
Гидролиз . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 228 22.2. Произведение растворимости . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .240 22.3. Окислительно-восстановительные процессы. Коррозия . . . . . . . . . . 244
Список рекомендуемой литературы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 253
255
Учебное издание
АВДЕЕНКО АНАТОЛИЙ ПЕТРОВИЧ ЕВГРАФОВА НАТАЛЬЯ ИВАНОВНА
СБОРНИК ЗАДАЧ
ПО НЕОРГАНИЧЕСКОЙ ХИМИИ
ДЛЯ СТУДЕНТОВ
МЕТАЛЛУРГИЧЕСКИХ СПЕЦИАЛЬНОСТЕЙ
Редактор ХАХИНА НЕЛЛИ АЛЕКСАНДРОВНА
Подп. к печати |
Формат 60х90/16 |
Ризограф. печать. |
Усл. печ. л. 16,0 Уч.-изд. л. 11,63 |
Тираж 100 экз. |
Зак. № |
__________________________________________________________
ДГМА. 84313, Краматорск, ул.Шкадинова, 72
256
