
- •Глава 4.6. Количественные характеристики токсикокинетики
- •2. Объем распределения.
- •3. Клиаренс
- •4. Биодоступность
- •5. Соотношение между значениями клиаренса, объема распределения и времени полувыведения вещества
- •6. Компартменты
- •6.1. Однокомпартментная модель
- •6.1.1. Моделирование поведения ксенобиотика при однократном внутривенном введении
- •6.1.2. Моделирование поведения ксенобиотика с параллельными путями выведения
- •6.1.3. Моделирование поведения ксенобиотика полностью резорбирующегося из места введения
- •6.2. Многокомпартментные модели
- •6.3. Нелинейные токсикокинетические процессы
- •7. Физиологические токсикокинетические модели
7. Физиологические токсикокинетические модели
Для конкретизации токсикокинетических исследований и оценки состояния организма после контакта с токсикантом порой важно представлять реальные характеристики движения веществ в органах и тканях. Но эти характеристики зависят от параметров резорбции, распределения, метаболизма, выведения веществ через эти органы и тканы. Если их определять с помощью методов компартментного моделирования, то получаемые значения будут условны, т.к. зависят от особенностей выбранной модели. Кроме того при математическом моделировании невозможно, например, представить почему при введении в организм противоопухолевого средства адриамицина развивается именно кардиотоксический эффект.
Эти трудности удается отчасти преодолеть, используя физиологические модели, разрабатываемые с учетом анатомо-физиологических особенностей органов и тканей у различных биологических видов (на которых изучается токсикокинетика), таких как объем, масса органа, кровоток через органы, связывание с белками, проницаемость гистогематических и клеточных барьеров, интенсивность и характер метаболизма в органах и т.д. (таблица 3).
Таблица 3. Сравнительная характеристика некоторых биометрических параметров организма человека и крысы (самцы)
|
Параметр
|
Крыса |
Человек |
Человек/крыса |
|
Масса тела, г Масса (% от массы тела): -печени -почек -сердца -легких -надпочечников Площадь поверхности, м2 Продолжительность жизни, дни Основной метаболизм: -ккал/кг сут -ккал/м2 сут Потребление пищи, г/кг сут Время вынашивания плода, сут Общий белок крови, г/дл Альбумины/глобулины крови |
300
5,22 0,42 0,32 0,43 0,0084 0,048 103
109 908 50 22 8,01 0,95 |
70000
2,28 0,43 0,41 1,50 0,02 1,88 26 103
25,6 953 10 280 6,71 1,66 |
233
0,44 1,0 1,28 3,49 2,38 39 26
0,23 1,05 0,20 12,72 0,84 1,75 |
(По Oser B.L., 1981)
С помощью такого подхода можно достаточно хорошо представить токсикокинетику веществ, осмыслить влияние биометрических параметров на особенности токсикокинетических характеристик. Поскольку биометрические параметры органов видоспецифичны, видоспицефичны и токсикокинетические параметры ксенобиотиков, а поскольку между биометрическими параметрами и параметрами кинетики существует количественная связь, данные полученные на животных можно с достаточной точностью переносить на человека, подставляя в полученные на лабораторных животных эмпирические уравнения, соответствующие биометрические параметры органов и тканей человека.
При разработке физиологических моделей распределения веществ между органами и тканями обычно исходят из схемы кровоснабжения организма, которая для всех млекопитающих по сути одинакова.
Обычно выбирают для исследования интересующий орган (например сердце при изучении кинетики гликозидов, или мозг при изучении психодислептиков), а для нерастворимых в жирах веществ из рассмотрения вообще убирают жировую ткань. Для каждого органа может быть построена либо упрощенная, либо полная, основанная на учете всех особенностей его кровоснабжения, метаболизма, функций, модель (рисунок 9).
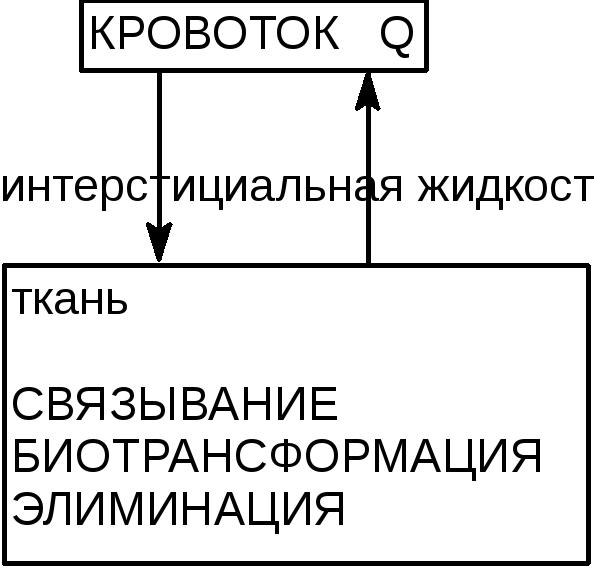
Рисунок 9. Схематическое представление органа в физиологической токсикокинетической модели
В упрощенном виде обычно рассматривают две возможности:
а) преимущественное влияние на характер распределения вещества особенностей кровоснабжения органа;
б) преимущественное влияние на распределение вещества свойств гистогематического барьера.
Если переход веществ из одного компартмента в другой (например из крови в ткань) осуществляется значительно быстрее, чем прохождение крови через исследуемый орган, говорят о преимущественной зависимости распределения вещества от особенностей гемодинамики, если значительно медленнее - о преимущественной зависимости от свойств барьера.
Следующий этап исследования состоит в составлении уравнения баланса масс распределения для каждого органа или ткани. Например, такое уравнение для органа «i» с лимитирующим фактором распределения «особенности кровоснабжения» можно представить следующим образом:
Vi dCi/dt = Qi [Ca - (Ci/Ri)] , где
Vi - объем органа;
Qi - скорость кровотока через орган;
Ca - концентрация токсиканта в артериальной крови;
Ri - коэффициент распределения вещества в системе кровь/орган;
dCi/dt - скорость изменения концентрации токсиканта в органе.
Таким образом скорость накопления вещества в органе (Vi dCi/dt) зависит от:
- концентрации вещества в крови;
- скорости кровотока в органе;
- скорости диффузии вещества из других органов в кровь и наоборот;
- скорости биотрансформации веществ.
Практическое значение подобного подхода зависит от физической возможности исследователя получить большое количество экспериментальных данных, необходимых для насыщения физиологической модели конкретной информацией. Поскольку большая часть информации может быть получена только в ходе экспериментальных исследований на лабораторных животных, необходим следующий этап работы, а именно: получение данных о влиянии биометрических характеристик органов и систем на параметры токсикокинетики ксенобиотиков.
Установлению этого влияния были посвящены многочисленные исследования. При этом для математического описания связей между сравниваемыми величинами использовали аллометрические уравнения вида:
y = bxa, где
y - исследуемая токсикокинетическая характеристика (например клиаренс);
х - биометрическая характеристика (например масса органа элиминации);
a,b - коэффициенты корреляции, требующие экспериментальной оценки.
Поскольку токсикокинетические характеристики изучаются в организмах существенно отличающихся друг от друга биометрическими показателями (массой, размерами, интенсивностью метаболизма, частотой сердечных сокращений и т.д.) сравнительная оценка получаемых величин для разных видов живых существ порой в значительной степени затруднена.
Иногда удается преодолеть возникающие трудности путем использования для анализа экспериментального материала некоего единого масштаба, учитывающего особенности физиологии организмов. Так, установлено, что период полуэлиминации цефалоспорина у 5 различных видов живых существ значительно различается (у мыши - 10 мин, у собаки - 60 мин, у человека - 90 мин). Однако при переводе полученных данных к «единой шкале измерений» установлено, что у всех видов период полуэлиминации равен 7253 сокращениям сердечной мышцы (J. Mordenti, 1986).
