1348728224_archive / Rabota
.doc
![]()
Каждая молекула сталкивается с другими. Число соударений в секунду столь огромно, что, если бы столкновения были эффективны, все реакции заканчивались бы мгновенно, т.е. протекали бы в виде взрыва. Но этого не происходит. Сильное понижение температуры реагирующей системы молекул приводит к уменьшению их кинетической энергии, и их столкновения становятся неэффективными, а скорость реакции близка к нулю.Это связано с тем, что в ходе реакции молекулы должны сгруппироваться в активированный комплекс. Образовать его могут только активные молекулы, обладающие достаточной для этого кинетической энергией. Разность энергий активированного комплекса и исходных молекул называют энергией активации Ea (рис. 1.).
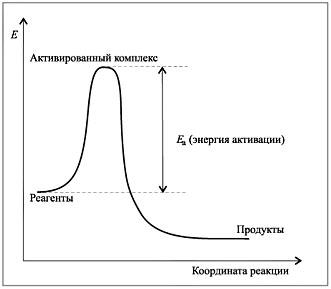
Рис. 1. Зависимость энергии реагирующих молекул от координаты химической реакции
При сближении молекул их кинетическая энергия переходит в потенциальную. Максимум потенциальной энергии соответствует энергии активированного комплекса. Энергетический барьер возникает вследствие взаимного отталкивания химически еще не связанных атомов. Не получив нужной энергии, нельзя преодолеть энергетический барьер.При малом числе активных молекул (обладающих энергией активации) число эффективных столкновений незначительно и реакция протекает медленно. Если представить себе в качестве промежуточной стадии не образование активированного комплекса, а полную диссоциацию молекул на атомы, то энергия активации окажется меньше энергии разрыва химических связей в молекулах исходных веществ (рис. 2.).

Рис. 3. Качественное сопоставление энергий активации и диссоциации химических связей реагирующих молекул
Следовательно, процесс образования активированного комплекса более выгоден энергетически, чем распад вступающих в реакцию молекул на атомы. Реакция осуществляется именно через активированный комплекс.
Столкновения могут оказаться неэффективными вследствие неблагоприятной взаимной ориентации молекул. Этот стерический (пространственный) фактор препятствует взаимодействию молекул даже при температурах, обеспечивающих, казалось бы, достаточный запас активационной энергии.
Повышение температуры является одним из способов активации молекул. Согласно правилу Вант-Гоффа повышение температуры на 10 градусов для большинства химических реакций приводит к увеличению их скорости в 2–4 раза. Математическое выражение правила Вант-Гоффа имеет вид:
![]()
где ![]() 1 –
скорость при температуре Т1,
1 –
скорость при температуре Т1, ![]() 2 –
скорость при температуре Т2,
2 –
скорость при температуре Т2, ![]() –
температурный коэффициент, лежащий
обычно в области от 2 до 4. При этом
температурный интервал, к которому
относится
–
температурный коэффициент, лежащий
обычно в области от 2 до 4. При этом
температурный интервал, к которому
относится ![]() ,
в классическом варианте правила
Вант-Гоффа равен 10.
,
в классическом варианте правила
Вант-Гоффа равен 10.
К
сожалению, в правиле Вант-Гоффа не
отражена зависимость самого температурного
коэффициента![]() от
температуры. К тому же имеются реакции,
для которых значение
от
температуры. К тому же имеются реакции,
для которых значение ![]() выходит
за пределы обозначенной области. В связи
с этим правило Вант-Гоффа имеет
ограниченное применение и предназначено
для приблизительной оценки влияния
температуры на скорость реакции.
выходит
за пределы обозначенной области. В связи
с этим правило Вант-Гоффа имеет
ограниченное применение и предназначено
для приблизительной оценки влияния
температуры на скорость реакции.
Уравнение Аррениуса более точно отражает температурную зависимость скорости химической реакции. Согласно Аррениусу, константа скорости реакции зависит от температуры следующим образом:
![]()
где А – некоторый коэффициент пропорциональности (предэкспоненциальный множитель), е – основание натуральных логарифмов (е = 2,7182818284590), R – универсальная газовая постоянная, Т – абсолютная температура, Ea – энергия активации. Константа скорости химической реакции зависит от температуры так, что для одной и той же реакции она изменяется в большее число раз при повышении температуры от 0 °С до 10 °С, чем от 10 °С до 20 °С.
При изучении химических процессов была обнаружена большая группа реакций, в которых реагенты не удается полностью превратить в продукты. Теоретическая химия объясняет этот факт существованием обратимых реакций, когда при данных условиях возможно одновременное протекание как прямого, так и обратного процессов. К числу обратимых относятся многие реакции, изучаемые в школьном курсе химии, например реакция синтеза аммиака:
3Н2 +
N2 ![]() 2NН3.
2NН3.
В какой-то момент времени концентрация аммиака перестает увеличиваться. Тогда говорят, что наступило состояние динамического равновесия, т.е. речь идет о точке равновесия. В состоянии динамического равновесия скорости прямой и обратной реакции равны. Если для скорости прямой реакции справедливо выражение
![]() 1 = k1[H2]3[N2],
1 = k1[H2]3[N2],
а для обратной –
![]() 2 = k2[NH3]2,
2 = k2[NH3]2,
то
в состоянии равновесия ![]() 1 =
1 = ![]() 2,
или
2,
или
k1[H2]3[N2] = k2[NH3]2.
Константа равновесия реакции равна отношению константы скорости прямой реакции к константе скорости обратной реакции:
K = k1/k2 = [NH3]2/[H2]3[N2].
Необходимо помнить, что приведенные здесь выражения годятся только для учебных целей. Реальные же выражения для скоростей процессов несколько сложнее.
![]()













![]()

![]()
1. Изменение степени превращения при изотермическом режиме .
Для определения степени превращения по длине реактора необходимо определить зависимость изменения степени превращения (Х) по длине реактора. Для этого рассмотрим стационарный режим в РИВ. Скорость химического превращения для реакции первого порядка определяется следующим выражением:
|
W = K*C = K*C0 (1-X) |
(1) |
где К - константа скорости реакции, зависящая от температуры
![]()
C0 , C - начальное и текущее значение концентрации;
Х = (С0 - С)/С0 - степень превращения;
В изотермическом режиме Т=const и, следовательно, К=const.
В стационарном режиме уравнение материального баланса имеет вид (т.к. dC/dt =0):
|
|
(2.) |
В (2) выразим значение концентрации через степень превращения и вместо W подставим его значение из (1). Получим:
|
|
(3) |
Т.к. L/U
= ![]() ,
то dZ/U
= dt.
Тогда
вместо (3) можно
записать:
,
то dZ/U
= dt.
Тогда
вместо (3) можно
записать:
|
dX/d |
(4) |
Для того, чтобы определить изменение степени превращения по длине реактора, надо проинтегрировать (4).
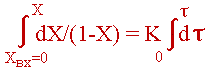
Получим:
|
-Ln(1-X)=K |
(5) |
Преобразовав (5), получим:
|
|
(6) |
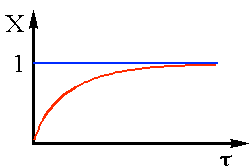
Полученное выражение позволяет определить Х по длине реактора (рис.1).
|
|
Из анализа (6) следует,что практическиневозможно получить степень превращения равную 1. |
Рис.1
Аналогичная зависимость - изменение концентрации по длине реактора имеет вид:
|
|
(7) |
2. Экзотермический процесс в РИВ с отводом тепла.
Если
отвод тепла осуществляется равномерно
по длине реактора (например, в трубчатом
реакторе), то характер изменения
температуры по длине будет иметь
с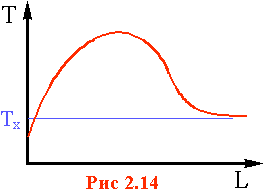 ледующий
вид (рис.3).
ледующий
вид (рис.3).
На начальных участках слоя за счет интенсивного тепловыделения, превышающего теплоотвод, температура будет повышаться. По мере того, как исходное вещество реагирует и его концентрация уменьшается по длине реактора, приход тепла за счет химической реакции сначала сравняется с теплоотводом (точка максимума или "горячая точка"), а
Рис. 2.
затем теплоотвод будет превышать тепловыделение. За счет этого температура к концу слоя начинает понижаться. При достаточно большой длине реактора температура на выходе достигнет значения температуры хладоагента Тx.
Задача 3. Определить константу скорости реакции в случае 0, 1, 2-го порядков, если через время τ после ее начала достигнута степень превращения исходного вещества xA, а начальная его концентрация – CA0.
-
Вариант
xA
CA0, кмоль/м3
τ, мин
5
0,65
0,25
15
9
0,69
0,29
19
0-го
порядка ![]()
![]() (вариант 5)
(вариант 5)
![]() (вариант 9)
(вариант 9)
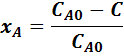
![]()
![]() (вариант 5)
(вариант 5)
![]() (вариант 9)
(вариант 9)
1-го
порядка ![]()
![]() (вариант 5)
(вариант 5)
![]() (вариант 9)
(вариант 9)
2-го
порядка ![]()
![]() (вариант 5)
(вариант 5)
![]() (вариант 9)
(вариант 9)
Задача 4. Определить константу скорости реакции первого порядка при температуре t3, если при температуре t1 за время τ1 достигнута степень превращения XA1, а при температуре t2 за время τ2 достигнута степень превращения XA2.
|
Вариант |
XA1 |
XA2 |
t1, °C |
t2, °C |
t3, °C |
τ1, мин |
τ2, мин |
|
5 |
0,65 |
0.75 |
28 |
48 |
88 |
14 |
7 |
|
9 |
0,69 |
0,79 |
36 |
56 |
96 |
22 |
11 |
Для реакции
первого порядка
![]()
Поскольку
![]() ,
,
то
![]()
![]()
Вариант 5
При температуре t1 = 28 °C
![]()
При температуре t2 = 48 °C
![]()
Согласно Аррениусу, константа скорости реакции зависит от температуры:
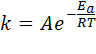 ,
,
Составив систему уравнений с неизвестными A, Ea, найдем
Ea = 38988,24
A = 440952,56
При температуре t3 = 88 °C
![]()
Вариант 9
При температуре t1 = 36 °C
![]() 24
24
При температуре t1 = 56 °C
![]()
Составив систему уравнений с неизвестными A, Ea, найдем
Ea = 41405,22
A = 535961,7
При температуре t3 = 96 °C
![]()
Задача 5. Сравнить объемы Рив и Рис Н для достижения одной и той же степени превращения X’A, равной 0,1; 0,5; 0,9 при проведении реакции А→Р, если за время τ в Рис П была достигнута степень превращения XA.
|
Вариант |
τ,с |
XA |
|
5 |
90 |
0.55 |
|
9 |
130 |
0,59 |
Для Рис П степень превращения равна:
![]()
![]()
Для Рив:
![]()
![]()
![]()
Для Рис Н:
![]()
![]()
![]()
![]()
Так как мы рассматриваем реактор вытеснения и реактор смешение непрерывного действия с одинаковым объемным расходом реагентов, то соотношение объемов реакторов равно соотношению времени пребывания в каждом из реакторов.
Вариант 5
![]()
Рив:
![]()
![]()
![]()
Рис:
![]()
![]()
![]()
![]()
![]()
![]()
Вариант 9
![]()
Рив:
![]()
![]()
![]()
Рис:
![]()
![]()
![]()
![]()
![]()
![]()
Как видим во всех случаях необходим гораздо меньший объем реактора вытеснения, а значит его эффективность выше.
Задача 6. В какой последовательности установить реакторы Рив и Рис Н для проведения реакции второго порядка, если известны значения kτ и CA0.
|
Вариант |
Kτ |
CA0, кмоль/м3 |
|
5 |
1,5 |
1,5 |
|
9 |
1,9 |
1,9 |
![]()
![]()
![]()
Вариант 5
![]()
![]()
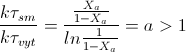
a = 1,9089
Вариант 9
![]()
![]()
a = 2,3623
Чем выше порядок реакции, тем менее эффективен реактор
идеального смешения. Для реакций второго порядка, чем больше значение a, тем больше неравенство τсм > τвыт, следовательно тем ниже интенсивность Рис-Н.
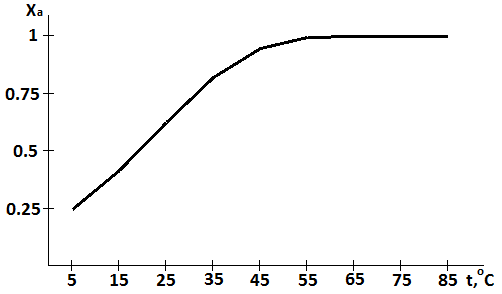
Задача 7. Построить графическую зависимость XA = f(T) в Рис и Рив для необратимой реакции первого порядка за время τ, если в Рис П за время τ’=600 с при температуре t1, равной 25 °С, достигнута степень превращения XA1, а при температуре t2, равной 35 °С, достигнута степень превращения XA2. Для построения зависимости XA= f(T) задаваться температурой в диапазоне от 5 до 85 °С с интервалом в 10 °С.
|
Вариант |
τ, с |
XA1 |
XA2 |
|
5 |
580 |
0,55 |
0,75 |
|
9 |
660 |
0,59 |
0,79 |
Вариант 5
Для реакции первого порядка
![]()
Согласно Аррениусу, константа скорости реакции зависит от температуры:
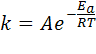 ,
,
Посчитав k для t1 и t2 и составив систему уравнений с неизвестными A, Ea, найдем
Ea = 42075,34
A = 31847,8
Выразим Xa через k:
![]()
![]()
![]()
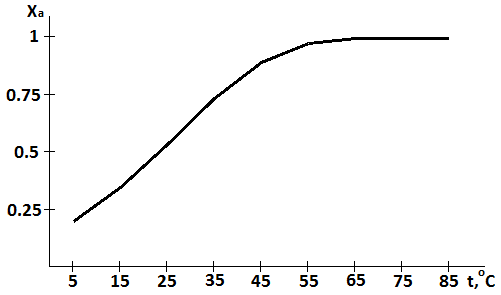
Подставляя значение температуры и времени найдем значения Xa:
|
t, °C |
5 |
15 |
25 |
35 |
45 |
55 |
65 |
75 |
85 |
|
Xa |
0,2034 |
0,3481 |
0,5379 |
0,7382 |
0,8943 |
0,974 |
0,9969 |
0,9999 |
0,9999 |
Вариант 9
Посчитав k для t1 и t2 и составив систему уравнений с неизвестными A, Ea, найдем
Ea = 42700,46
A = 45771,89
Подставляя значение температуры и времени найдем значения Xa:
|
t, °C |
5 |
15 |
25 |
35 |
45 |
55 |
65 |
75 |
85 |
|
Xa |
0,247 |
0,4166 |
0,625 |
0,8203 |
0,945 |
0,9913 |
0,9995 |
0,9999 |
0,9999 |