
1-6
.docx-
Предмет и методы термодинамики. Основные понятия и определения термодинамики.
Термодинамика — раздел, изучающий соотношения и превращения теплоты и других форм энергии. Термодинамика — это феноменологическая наука, опирающаяся на обобщения опытных фактов. Она изучает макроскопические системы, состоящие из огромного числа частиц —термодинамические системы. Процессы, происходящие в таких системах, описываются макроскопическими величинами, такими как давление или температура, которые не применимы к отдельным молекулам и атомам.
Термодинамические системы
В термодинамике изучаются физические системы, состоящие из большого числа частиц и находящиеся в состоянии термодинамического равновесия или близком к нему. Такие системы называются термодинамическими системами.
Термодинамическое равновесие
Утверждается, что любая замкнутая термодинамическая система, для которой внешние условия остаются неизменными, с течением времени переходит в равновесное состояние, в котором прекращаются все макроскопические процессы.
Термодинамические параметры
Термодинамика не рассматривает особенности строения тел на молекулярном уровне. Равновесные состояния термодинамических систем могут быть описаны с помощью небольшого числа макроскопических параметров, таких как температура, давление, плотность, концентрации компонентов и т. д., которые могут быть измерены макроскопическими приборами. Описанное таким образом состояние называется макроскопическим состоянием, и законы термодинамики позволяют установить связь между макроскопическими параметрами.
Термодинамические процессы
При изменении внешних параметров или при передаче энергии в систему в ней могут возникать сложные процессы на макроскопическом и молекулярном уровне, в результате которых система переходит в другое состояние.
Нулевое начало термодинамики
названо так потому, что оно было сформулировано уже после того, как первое и второе начало вошли в число устоявшихся научных понятий. Оно утверждает, что изолированная термодинамическая система с течением времени самопроизвольно переходит в состояние термодинамического равновесия и остаётся в нём сколь угодно долго, если внешние условия сохраняются неизменными.
Первое начало термодинамики
Выражает универсальный закон сохранения энергии применительно к задачам термодинамики и исключает возможность создания вечного двигателя первого рода, то есть устройства, способного совершать работу без соответствующих затрат энергии.
Внутреннюю энергию U термодинамической системы можно изменить двумя способами, совершая над ней работу или посредством теплообмена с окружающей средой. Первое начало термодинамики утверждает, что теплота, полученная системой, идёт на увеличение внутренней энергии системы и на совершение этой системой работы, что можно записать как δQ = δA + dU. Здесь dU — полный дифференциал внутренней энергии системы, δQ — элементарное количество теплоты, переданное системе, аδA — бесконечно малая или элементарная работа, совершённая системой.
Второе начало термодинамики
Второе начало термодинамики задаёт ограничения на направление процессов, которые могут происходить в изолированной системе, и исключает возможность создания вечного двигателя второго рода.
Постулат Кельвина: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара». Такой круговой процесс называется процессом Томсона-Планка, и постулируется, что такой процесс невозможен.
Постулат Клаузиуса: «Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому»
функция термодинамического состояния S=S(T,x,N), называется энтропией
-
Параметры и состояние системы.
Все макроскопические признаки, характеризующие систему и ее
отношение к окружающей среде, называются макроскопическими
параметрами или параметрами системы. Термодинамические параметры
– физические величины, характеризующие состояние термодинамической
системы (температура, объем, плотность, давление, масса, намагниченность,
электрическая поляризация, теплоемкость при постоянном объеме и другие),
т.е. любые признаки, имеющие количественную меру и относящиеся к
системе в целом или к ее макроскопическим частям (кроме характеристик
потоков энергии и массы, в размерность которых входит время). Свойства,
заимствованные термодинамикой у физики, химии, техники
рассматриваются в зависимости от типичной термодинамической
характеристики – температуры.
Величины, количественно выражающие термодинамические
параметры (свойства), называют также термодинамическими переменными.
Поскольку все они взаимосвязаны, их разделяют на независимые переменные
и функции, что эквивалентно делению математических величин на аргументы
и функции. Параметры, поддающиеся прямому измерению, считаются
основными (температура, давление, плотность, объем, концентрация).
Внутренняя энергия, энтропия, энтальпия и другие аналогичные параметры
считаются функциями основных параметров. Так как параметры
взаимосвязаны, то для характеристики состояния системы достаточно
задать только определенное число переменных. Эти переменные называют
независимыми, остальные рассматриваются как функции независимых
переменных. Таким образом, одна и та же характеристика в зависимости
от контекста может называться термодинамической величиной,
переменной, параметром, функцией или просто свойством.
Параметры разделяют на внешние и внутренние.
Внешние параметры – это величины, определяемые положением не входящих в систему тел - (объем, магнитная индукция, напряженность электрического поля)
Внешние параметры являются функциями координат внешних тел.
Внутренние параметры – это величины, определяемые совокупным
движением и распределением в пространстве входящих в систему частиц
(температура, давление, внутренняя энергия, плотность, поляризованность,
намагниченность)
Равновесные и неравновесные состояния:
Термодинамически равновесное состояние тела или системы это такое состояние теплового и механического равновесия элементов тела или системы, которое без внешнего воздействия может сохраняться сколь угодно долго.
Равновесная система это система тел, находящихся в термодинамическом равновесии, в противном случае она будет называться неравновесной системой. Так, без учета гравитационных сил, равновесное состояние тела или системы есть такое их состояние, при котором по всему их объему давления и температуры имеют одинаковые значения. Равенство только давления во всех точках обусловливает механическое равновесие, равенство температур - термическое равновесие.
-
Тепловой процесс и его свойства
Тепловой процесс (термодинамический процесс) — изменение макроскопического состояния термодинамической системы.
Система, в которой идёт тепловой процесс, называется рабочим телом.
Тепловые процессы можно разделить на равновесные и неравновесные.
Прямой и обратимый процессы:
Обратимый – процесс, при котором система проходит все те же состояния что и в прямом направлении, но в обратном порядке, при этом остаточных изменений в окружающей среде не наблюдается.
Круговые процессы- при которых система из начального состояния проходит ряд последовательных состояний и в него же возвращается.
-
Внутренняя энергия термодинамической системы.
Внутренняя энергия термодинамической системы (обозначается как E или U) — это сумма энергий теплового движения молекул и межмолекулярных взаимодействий.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы.
-
Теплота и работа термодинамического процесса. Физическая сущность, выражение теплоты и работы через параметры состояния системы. Графическое определение теплоты и работы по диаграммам в координатах P-V и T-S.
Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется количеством теплоты или просто теплотой.
Термодинамическая работа — способ передачи энергии, связанный с изменением внешних параметров системы. Определяется, как:
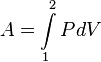
Теплота и работа определяются для разных видов процессов по первому закону термодинамики
Q = Δu + l
Для изохорного:
Q=Cv ΔT
Cv - изохорная теплоемкость
L=0
Δu=Cv ΔТ
Для изобарного:
Q=Cp ΔТ = Δi
i - Энтальпия
L=p ΔV
Δu=qV
Для изотермического:
Δu=Cv ΔТ
Q=L
L=RTln(p1/p2)
Для адиабатного
Q=0
L=- Δu
Δu=Cv ΔТ
6. Идеальный газ- газ, молекулы которого представляют собой материальную точку ,а силы взаимодействия между молекулами отсутствуют.
Основные законы идеального газа
1)Бойль-Мариотта
Т=const p1v1=p2v2 pv=const
2)Гей-Люсака
P=const T1/v1=T2/v2 T/v=const
3)Шарль
V=const p1/T1=p2/T2 p/T=const
4)Клапейрон
P1v1/T1=p2v2/T2 pv/T=const
Pv/T=R
R-газовая постоянная
Ro-универсальная газовая постоянная =8,314 Дж/моль К
PV=RT – уравнение состояния идеального газа,уравнение Клапейрона
PV=(m/(мю)) Ro T – основное уравнение состояния идеального газа , уравнение Менделеева- Клапейрона
