
- •Академия
- •Глава 1. Идеальный газ Тема
- •1.1. Тепловые явления. Характеристики тепловых явлений
- •1.2. Свойства газа, полученные на опыте
- •1.3. Уравнение состояния идеального газа
- •1.4. Изопроцессы
- •1.4.1. Изотермический процесс
- •1.4.2. Изобарный процесс
- •1.4.3. Изохорный процесс
- •1.5. Массы, размеры, энергии в мире молекул. Основные положения молекулярно-кинетической теории
- •1.5.1. Доказательства существования молекул
- •1.5.2. Движение молекул
- •1.5.3. Взаимодействие молекул
- •1.5.4. Твердые, жидкие и газообразные тела
- •1.6. Молекулярные основы теории идеального газа
- •1.7. Основное уравнение молекулярно-кинетической теории
- •1.8. Температура — мера средней кинетической энергии молекул
- •1.9. Растворенное вещество как идеальный газ
- •1.10. Реальные газы
- •Главное в главе 1
- •Глава 2. Термодинамика Тема
- •2.1. Первое начало термодинамики
- •2.1.1. Изохорный процесс
- •2.1.2. Изобарный процесс
- •2.1.3. Изотермический процесс
- •2.2. Адиабатный процесс
- •2.3. Энтропия
- •2.4. Второе начало термодинамики
- •Главное в главе 2
- •Глава 3. Статистика молекул Тема
- •3.1. Скорости молекул. Опыт Штерна
- •3.2. Распределение молекул по скоростям
- •3.3. Вероятность
- •3.4. Распределение Больцмана
- •3.4.1. Распределения молекул под действием силы тяжести
- •3.4.2. Распределение молекул по проекциям скоростей их движения
- •3.5. Распределение Максвелла
- •3.6. Наиболее вероятная скорость. Метод анализа размерностей
- •3.7. Барометрическая формула
- •3.8. Термоэлектричество. Термопара
- •3.8.1. Электроны у поверхности металла
- •3.8.2. Контактная разность потенциалов
- •Главное в главе 3
- •Глава 4. Явления переноса Тема
- •4.1. Длина свободного пробега молекулы
- •4.2. Диффузия. Закон Фика
- •4.3. Диффузия как случайное блуждание
- •4.4. Теплопроводность
- •4.5. Трение. Вязкость — внутреннее трение
- •Главное в главе 4
- •Глава 5. Молекулярная физика жидкой и твердой фаз, явлений на границе фаз и фазовых превращений Тема
- •5.1. Поверхностное натяжение
- •5.1.1. Методы исследования поверхностного натяжения жидкости
- •5.1.2. Адсорбция
- •5.1.3. Поверхностно-активные вещества. Применение поверхностно-активных веществ в фармации
- •5.2. Давление под изогнутой поверхностью жидкости. Формула Лапласа
- •5.3. Процессы испарения и конденсации
- •5.4. Капиллярные явления
- •5.4.1. Смачивание
- •5.4.2. Зависимость давления насыщенного пара от кривизны поверхности жидкости
- •5.4.3. Капиллярная конденсация. Гигроскопические материалы
- •5.5. Твердые тела. Аморфные и кристаллические твердые тела
- •5.6. Фазы. Равновесие фаз. Фазовые переходы
- •5.6.1. Сублимация (испарение)
- •5.6.2. Плавление и кристаллизация
- •5.6.3. Размягчение и стеклование
- •5.7. Жидкокристаллическое состояние вещества
- •5.8. Кристаллические модификации
- •5.8.1. Полиморфные превращения, их роль в изменении свойств фармацевтических препаратов
- •5.9. Теплоемкость твердых тел
- •5.9.1. Закон Дюлонга и Пти
- •5.9.2. Понятие о квантовой теории твердых тел
- •5.10. Механические свойства твердых тел
- •5.10.1. Упругость и пластичность
- •5.10.2. Особенности строения и свойства эластомеров
- •Главное в главе 5
5.6.1. Сублимация (испарение)
Наиболее радикальное, полное, изменение симметрии наблюдается при переходе из твердого состояния в газообразное. Действительно, твердое тело характеризуется наибольшей степенью симметрии, а газу соответствует полное отсутствие симметрии, выраженное в хаотическом расположении молекул.
Переход вещества из кристаллического состояния непосредственно (без плавления) в газообразное называется сублимацией. Сублимация очень похожа на испарение. И при сублимации, и при испарении объем, приходящийся на одну молекулу в газообразной фазе (паре)V2, гораздо больше объема на молекулу в другой (твердой или жидкой)V1<<V2. Поэтому вформуле Клапейрона–Клаузиуса объемомV1можно пренебречь. Тогда эта формула запишется какdр/dT =q/TV2.
Рассматривая пар как идеальный газ, выразим его объем V =V2Nчерез давление и температуру:V2=kT/р(k — постоянная Больцмана). Формула Клапейрона–Клаузиуса для испарения (сублимации) имеет вид:
![]() (5.26)
(5.26)
Интегрируя, найдем, что dр/рпревратится вlnр, аdT/T2в (–Т–1). Отсюда следует, что если теплоту фазового переходаqможно считать независящей от температуры, то давление насыщенного пара при сублимации (испарении) меняется с температурой по экспоненциальному закону:
![]() (5.27)
(5.27)
где lnC — постоянная интегрирования. Эта формула является частным случаем распределения Больцмана.
Теплота q, конечно, может быть выражена черезмолярнуюqNAилиудельнуюL =qNA/Mтеплоту сублимации (испарения). Теплоты сублимации, как удельная, так и молярная, являются характеристиками вещества и собраны в справочные таблицы.
5.6.2. Плавление и кристаллизация
Плавление— это явление перехода кристаллических твердых тел в жидкость (жидкое состояние). Обратный процесс называетсякристаллизацией.
Плавление и кристаллизация твердых тел происходят при постоянной температуре. Для того чтобы происходило плавление, необходим постоянный приток тепла Q =λm, гдеm — масса тела, а величинаλназываетсяудельной теплотой плавления. Очевидно, что размерность [λ]=Дж/кг.
Теплоты плавления, как удельная, так и молярная, являются характеристиками веществ и собраны в справочные таблицы.
При кристаллизации (отвердевании) соответствующая теплота Qвыделяется.
5.6.3. Размягчение и стеклование
У аморфных тел нет никакой определенной температуры плавления. При притоке тепла (повышении температуры) аморфные тела постепенно размягчаются, и их свойства все больше начинают напоминать свойства жидкостей. Вязкость аморфных тел уменьшается, перескоки атомов из одного положения в другое учащаются.
При понижении температуры аморфные тела по своим свойствам все больше и больше напоминают твердые тела. Этот процесс называется стеклованием.
5.7. Жидкокристаллическое состояние вещества
Радикальное изменение симметрии в теле соответствует фазовому переходу между агрегатными состояниями вещества. Это, как известно, кристаллическое твердое тело, жидкость и газ (пар), которым соответствует симметрия в первом случае дальнего порядка, во втором — ближнего и в третьем — полное отсутствие симметрии. Однако фазовые состояния могут различаться по симметрии не столь радикально.
Вещества, обладающие свойствами и жидкости, и твердого тела, называются жидкими кристаллами. Основные типы жидкокристаллических состояний представлены нарис. 5.8.
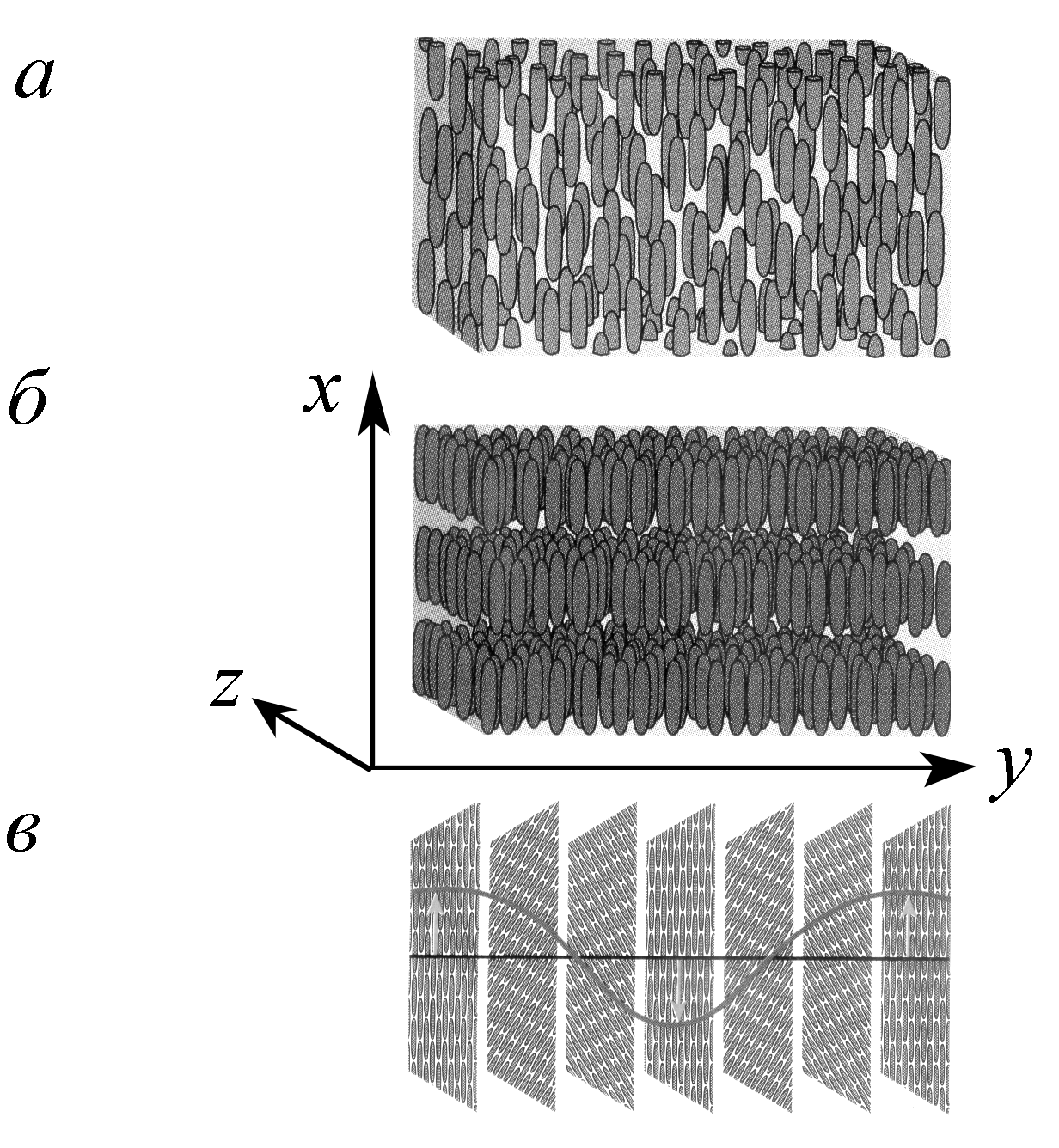
Рис. 5.8. Типы жидкокристаллических структур:а— нематические;б— смектические;в— холестерические
Ориентация
молекул характеризуется направленным
вдоль ее максимального размера единичным
вектором
![]() ,
называемымдиректором.
,
называемымдиректором.
По
рис. 5.8, авидно,
что длянематических жидких кристалловдиректор![]() имеет только одну компонентуnх.
Длясмектических жидких кристалловдиректор имеет только одну компонентуnх, причем
отличную от нуля только при 0 <x<L,
гдеL — толщина
слоя. Дляхолестерических жидких
кристалловдиректор имеет две
компонентыnх=sin(z/h);nу =cos(z/h),
гдеh— шаг спирали,
по которой повернуты молекулы.
имеет только одну компонентуnх.
Длясмектических жидких кристалловдиректор имеет только одну компонентуnх, причем
отличную от нуля только при 0 <x<L,
гдеL — толщина
слоя. Дляхолестерических жидких
кристалловдиректор имеет две
компонентыnх=sin(z/h);nу =cos(z/h),
гдеh— шаг спирали,
по которой повернуты молекулы.
Жидкокристаллические вещества очень широко распространены в биологических мембранах. Так, по рис. 5.8видно, что, имея сравнительно свободное перемещение по осиy(свойства жидкости), мембрана, устроенная из смектических кристаллов, будет непроницаема вдоль осих(свойства твердого тела).
Оказалось, что среди жидкокристаллических веществ многие состоят из полярных молекул (диполей). Наложением электрического поля перпендикулярно директору можно управлять ориентацией молекул. Так можно существенно менять оптические свойства жидкого кристалла, например, отражение. На этом основаны многие технические приложения. Укажем, например, на использование жидких кристаллов в устройствах индикации (дисплеи).
Уместно сказать, что до сих пор подчеркивалась связь изменения упорядоченности (симметрии) с температурой. Соответствующие жидкие кристаллы называются термотропными. В биологических объектах (мембранах) присутствуют, как правило, вещества, свойства упорядоченности которых существенно меняются при изменении концентраций как их самих, так и окружающих их молекул. Такие вещества (жидкие кристаллы) называютсялиотропными.
