
- •§ 1. Кинематика
- •§ 2. Динамика
- •V жылдамдықпен қозғалатын, массасы т дененің кинетикалық энергиясы мынаған тең: .
- •§ 3. Қатты денелердің айналмалы қозғалысы
- •§ 4. Газдар мен сұйықтардың механикасы
- •Механикалық бірліктер
- •II тарау молекулалық физика және термодинамика жылу бірліктері
- •§ 5. Молекула-кинетикалық теорияның және термодинамиканың физикалық негіздері
- •§ 6. Нақты газдар
- •§ 7. Қаныққан булар және сұйықтар
- •§ 8. Қатты денелер
- •Есептер шығаруда қажетті қосымшалар
- •III тарау электр және магнетизм электрлік және магниттік бірліктер
- •§ 9. Электростатика
- •§ 10. Электр тогы
- •§ 11. Электромагнетизм
- •IV тарау тербелістер және толқындар
- •§ 12. Гармониялық тербелмелі қозғалыс және толқындар
- •§ 13. Акустика
- •§ 14. Электромагниттік тербелістер және толқындар
- •Акустикалық бірліктер
- •V тарау оптика
- •§ 15. Геометриялық оптика және фотометрия
- •§ 16 Толқындық оптика
- •§ 17. Салыстырмалылық теорияның элементтері
- •§ 18. Жылулық сәуле шығару
- •Жарық бірліктері
- •VI тарау atom және atom ядросының физикасы радиоактивтік және иондаушы сәуле шығарудың бірліктері
- •§ 19. Жарықтың кванттық жаратылысы және бөлшектердің толқындық қасиеттері
- •§ 20. Бор атомы. Рентген сәулелері
- •§ 21. Радиоактивтік
- •§ 22. Ядролық реакциялар
- •§ 23. Элементар бөлшектер. Бөлшектерді үдетушілер
II тарау молекулалық физика және термодинамика жылу бірліктері
§ 5. Молекула-кинетикалық теорияның және термодинамиканың физикалық негіздері
Идеал
газдар Менделеев — Клапейрон күйінің
теңдеуіне бағынады:
![]()
мұндағы
![]() -газдың
кысымы,V
-
оның
көлемі, Т
- абсолют
температура, М
—
газдың
массасы,
-газдың
кысымы,V
-
оның
көлемі, Т
- абсолют
температура, М
—
газдың
массасы,
![]() —
бір
киломоль
газдың
массасы, R
—
газ тұрақтысы;
—
бір
киломоль
газдың
массасы, R
—
газ тұрақтысы;
![]() қатынасы
киломольдің
санын береді.
қатынасы
киломольдің
санын береді.
ХЖ бірлігінде газ тұрақтысының сан мәні R = 8,31 • 103 дж/кмоль • град-қа тең болады.
Далтонның заңы бойынша газдар қоспасының қысымы оның парциал қысымының қосындысына тең болады, осы берілген температурада барлық көлемді жеке өзі толтыратындай әрбір жеке газдарда болатын қысым.
Газдардың
кинетикалық теориясының негізгі
теңдеуінің түрі төмендегідей:
![]() ,
,
мұндағы
п
—
бірлік
көлемдегі молекуланың саны,
W0
—
бір
молекуланың ілгерілемелі қозғалысының
кинетикалық энергиясы, т
—
молекуланың
массасы
және
![]() —
молекуланың
орташа квадраттық жылдамдығы.
—
молекуланың
орташа квадраттық жылдамдығы.
Бұл шамалар мынадай формулалармен анықталынады.
Бірлік
көлемдегі молекуланың саны
![]() ,
,
мұндағы
![]() - тұрақтысы,N0
—
Авогадро
саны.
R=
8,31
•
І03
дж/кмоль
•
град
және
- тұрақтысы,N0
—
Авогадро
саны.
R=
8,31
•
І03
дж/кмоль
•
град
және
![]() 0
= 6,02•
1026
кмоль-1
болғандықтан,
k
= 1
,38 • 10-23
дж/град=
1,38 • 10-16
эрг/град
болады.
0
= 6,02•
1026
кмоль-1
болғандықтан,
k
= 1
,38 • 10-23
дж/град=
1,38 • 10-16
эрг/град
болады.
Молекуланың
ілгерілемелі қозғалысының орташа
кинетикалық энергиясы
![]()
Молекуланың
орташа квадраттық жылдамдығы
![]()
сонымен
бірге
![]()
Молекулалардың
жылулық қозғалысының энергиясы
(газдың ішкі энергиясы)
![]() ,
,
мұндағы і — молекуланың еркіндік дәрежесінің саны.
Молекулалық
жылу сыйымдылығы С-пен меншікті жылу
сыйымдылығы с-нің арасындағы
байланыс олардың
анықтамасынан шығады
![]()
Көлем
тұрақты болғанда газдың молекулалық
жылу сыйымдылығы
![]()
қысым
тұрақты болғанда
![]()
Осыдан молекулалық жылу сыйымдылығы түгелдей газ молекуласының еркіндік дәрежесінің санымен анықталады. Бір атомды газ үшін і=3, және
Cv = 12,5 • 103 дж/кмоль • град =З кал/моль • град,
Ср = 20,8 • 103 дж/кмоль • град = 5 кал/моль • град.
Екі атомды газ үшін i = 5 және
Cv =20,8 • 103 дж/кмоль • град =5 кал/моль • град,
Cp=29,l • 103 дж/кмоль • град = 7 кал/моль • град.
Көп атомды газ үшін i = 6 және
Сv =24,9 • 103 дж/кмоль • град = 6 кал/моль • град.
Ср = 33,2 · 103 дж/кмоль • град=8 кал/моль • град.
Молекулалардың
жылдамдықтарына қарай бөліну заңы
(Максвелл
заңы), салыстырмалы
жылдамдықтары и
мен
и![]() интервалында
жатқан
интервалында
жатқан![]() молекулалардыңсанып
табуға мүмкіндік береді:
молекулалардыңсанып
табуға мүмкіндік береді:
![]()
мұндағы
![]() салыстырмалы
жылдамдық,
υ
—
берілген
жылдамдық және
салыстырмалы
жылдамдық,
υ
—
берілген
жылдамдық және
![]()
молекулалардың анағұрлым ықтимал болатын жылдамдығы,
10- кесте
|
и |
|
и |
|
и |
|
|
0 |
0 |
0,9 |
0,81 |
1,8 |
0,29 |
|
0,1 |
0,02 |
1,0 |
0,83 |
1,9 |
0,22 |
|
0 2 |
0 09 |
1,1 |
0,82 |
2,0 |
0,16 |
|
0,3 |
0,18 |
1,2 |
0,78 |
2,1 |
0,12 |
|
0 4 |
0,31 |
1,3 |
0,71 |
2,2 |
0,09 |
|
0,5 |
0,44 |
1,4 |
0,63 |
2,3 |
0,06 |
|
0 6 |
0,57 |
1,5 |
0,54 |
2,4 |
0,04 |
|
0,7 |
0,68 |
1,6 |
0,46 |
2,5 |
0,03 |
|
0,8 |
0,76 |
1,7 |
0,36 |
|
|
![]() — жылдамдық
u-ға
қарағанда салыстырмалы
жылдамдық
интервалының кіші шамасы.
— жылдамдық
u-ға
қарағанда салыстырмалы
жылдамдық
интервалының кіші шамасы.
Молекулалардың
жылдамдықтарына қарай бөліну заңына
есеп шығарғанда әр түрлі
![]() -ға
-ға![]() -мәндері берілген 10-таблицаны пайдаланған
ыңғайлы.
-мәндері берілген 10-таблицаны пайдаланған
ыңғайлы.
Молекулалардың
орташа арифметикалық жылдамдығы
![]() .
.
Көптеген
жағдайларда и
жылдамдықтың
берілген мәнінен жылдамдыктары асып
түсетін Nx
молекулалардың
санын
білу
өте қажет болады. 11- кестеде
![]() ,
мұндағыN
—
молекулалардың
жалпы
саны.
,
мұндағыN
—
молекулалардың
жалпы
саны.
11-кесте
-
u
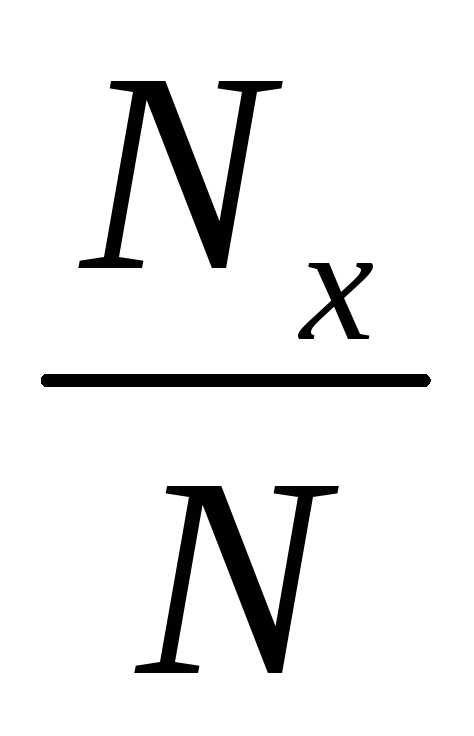
u
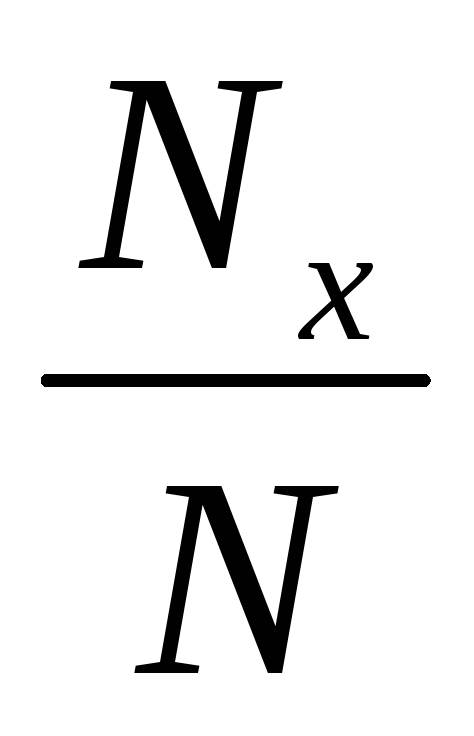
0
1.000
0,8
0,734
0,2
0,994
1,0
0,572
0.4
0,957
1,25
0,374
0,5
0,918
1,5
0,213
0,6
0,868
2.0
0,046
0,7
0,806
2,5
0,0057
Барометрлік формула, ауырлық күшінің өрісіндегі газ қысымының кемуінің заңын береді
![]()
мұндағы
![]() ,
—
,
—
![]() биіктіктегі
газдың қысымы, р0
—
биіктіктегі
газдың қысымы, р0
—![]() =0
биіктіктегі
қысым, g—
ауырлық
күшінің үдеуі. Бүл формула
жуықталынған
формула,
себебі
биіктіктердің айырымының үлкен мәніне
Т
температураны
бірдей
деп есептеуге болмайды.
=0
биіктіктегі
қысым, g—
ауырлық
күшінің үдеуі. Бүл формула
жуықталынған
формула,
себебі
биіктіктердің айырымының үлкен мәніне
Т
температураны
бірдей
деп есептеуге болмайды.
Газ молекуласының еркін жолының орташа ұзындығы
![]() ,
,
мұндағы
![]() —
арифметикалық
орташа жылдамдық,
—
арифметикалық
орташа жылдамдық,
![]() — әрбір
молекуланың бірлік уақыт ішіндегі басқа
молекулалармен соғылуының орташа
саны,
— әрбір
молекуланың бірлік уақыт ішіндегі басқа
молекулалармен соғылуының орташа
саны,
![]() —молекуланың
эффектілік диаметрі және п
—
бірлік
көлемдегі молекулалардың саны.
Бірлік
көлемдегі барлық молекула-лардың бірлік
уақыт ішіндегі соғылу саны
—молекуланың
эффектілік диаметрі және п
—
бірлік
көлемдегі молекулалардың саны.
Бірлік
көлемдегі барлық молекула-лардың бірлік
уақыт ішіндегі соғылу саны
![]() ,
,
Диффузия
кезінде
![]() уақыт
ішінде көшірілген М
масса
төмендегі
теңдеумен анықталады:
уақыт
ішінде көшірілген М
масса
төмендегі
теңдеумен анықталады:
![]() ,
,
мұндағы
![]() -
ауданға
перпендикуляр
бағыттағы
тығыздық градиенті, ал
-
ауданға
перпендикуляр
бағыттағы
тығыздық градиенті, ал
![]() - диффузия коэффиценті.
Ол
мынаған тең:
- диффузия коэффиценті.
Ол
мынаған тең:
![]()
мұндағы
![]() —
орташа
жылдамдық,
—
орташа
жылдамдық,
![]() — молекуланың
еркін журісінің орташа
ұзындығы.
— молекуланың
еркін журісінің орташа
ұзындығы.
![]() уақыт
ішінде газ
арқылы
көшірілген қозғалыс мөлшері газдағы
F
ішкі
үйкеліс күшін анықтайды
уақыт
ішінде газ
арқылы
көшірілген қозғалыс мөлшері газдағы
F
ішкі
үйкеліс күшін анықтайды
![]() ,
мұндағы
,
мұндағы![]() -
-![]() ауданға перпендикуляр
бағыттағы
газ ағынының жылдамдық градиенті, ал
ауданға перпендикуляр
бағыттағы
газ ағынының жылдамдық градиенті, ал
![]() -
ішкі үйкеліс коэффиценті (динамикалық
тұтқырлық)
-
ішкі үйкеліс коэффиценті (динамикалық
тұтқырлық)
![]() .
.
![]() уақыт
ішінде жылу өткізгіштік нәтмжесіндекөшірілген
жылу мөлшері мынаған тең:
уақыт
ішінде жылу өткізгіштік нәтмжесіндекөшірілген
жылу мөлшері мынаған тең:
![]() ,
,
мұндағы
![]() -
-![]() ауданға перпендикуляр
бағыттағы
температураның градиенті, К- жылу
өткізгіштік коэффиценті
ауданға перпендикуляр
бағыттағы
температураның градиенті, К- жылу
өткізгіштік коэффиценті
![]()
Термодинамиканың
бірінші бастамасын төмендегі түрде
жазуга болады,
![]()
мұндағы dQ — газдың алған жылу мөлшері; dW — газдың ішкі энергиясының өзгерісі және dA = pdV – көлемін өзгерткен ксздс газдың істейтін жұмысы. Газдың ішкі энергиясының өзгерісі
![]() ,
,
мұндағы dT — температураның өзгерісі. Газдың, көлемі өзгермегендегі, толық жұмысы
![]() .
.
Газ
көлемінің изотермалық өзгерісі
кезіндегі істелінетін жұмыс
![]() .
.
Адиабаталық
процесс
кезінде
газдың қысымы мен оның көлемі арасындагы
байланыс Пуассон
теңдеуі
арқылы көрсетіледі
р![]() =
const,
=
const,
яғни
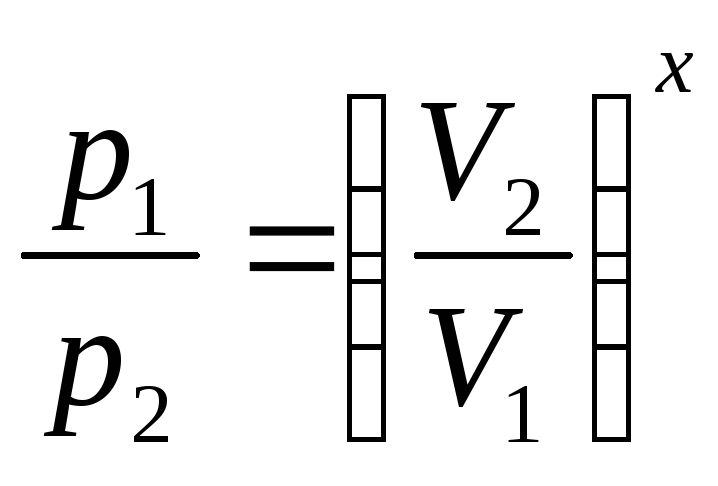 ,мұндағы
,мұндағы
![]() .
.
Пуассонның
теңдеуін мынандай түрде де жазуға бо
лады:
![]() ,
,
яғни
![]() ,
немесе
,
немесе![]() ,
яғни
,
яғни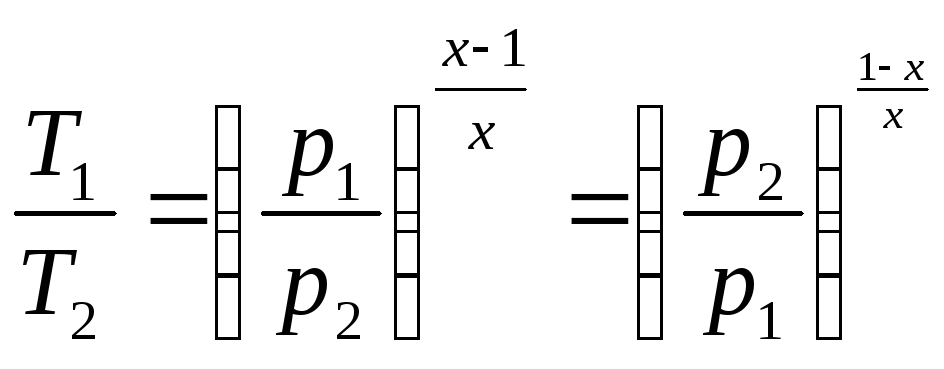 .
.
Газдың көлемі адиабаталы өзгергенде істелетін жұмысты төмендегі формуламен табуға болады:
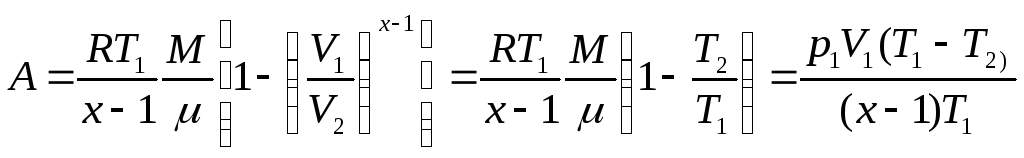
Политропиялық
процесс
теңдеуінің
түрі төмендегідей болады:
![]() ,
,
немесе
![]() мұндағы
п
—
политропа көрссткіші
(1<
мұндағы
п
—
политропа көрссткіші
(1<![]() <х).
<х).
Жылу
машинасыпың пайдалы эсер
коэффициенті
![]() ,
,
мұндағы
Q1
— жұмысшы
денеге берілген жылу, ал
Q2—'суытқышқа
берілген жылу. Карноның
идеал
циклі
үшін
![]()
мұндағы Т1— қыздырғыштың температурасы, Т2 — суытқыштың температурасы.
В
мен
А
екі
күйдің энтропияларының айырымы
sв
—
sа
төмендегі
формуламен анықталады:
![]() .
.
