- •Масс- спектрометрия
- ••Масс-спектрометрия - это физический метод измерения отношения массы заряженных частиц материи (ионов) к
- ••Существенное отличие масс- спектрометрии от других аналитических физико-химических методов состоит в том, что
- ••Масс-спектрометры устанавливают что это за молекулы (то есть, какие атомы их составляют, какова
- ••Macс-спектральные приборы.
- ••Начало развитию масс-спектрометрии. положено опытами Дж. Томсона (1910), исследовавшего пучки заряженных частиц, разделение
- ••Первый серийный масс-спектрометр создан А. Ниром в 1940; его работы положили начало изотопной
- ••Приборы, которые используются в этом методе, называются масс-спектрометры или масс-спектрометрические детекторы. Эти приборы
- •Магнитный масс-спектрометр
- ••Первое, что надо сделать для того, чтобы получить масс-спектр, превратить нейтральные молекулы и
- •Методы ионизации
- ••ИонизацияНаиболее старый и наиболее широко применяемый в современной масс-спектрометрии метод ионизации молекул органических
- ••Другой способ ионизации - это ионизация в ионно-молекулярных реакциях, называемая химической ионизацией (ХИ,
- ••Начиная от ионного источника и до детектора масс-спектрометр представляет собой вакуумный прибор. Довольно
- ••Масс-анализаторы
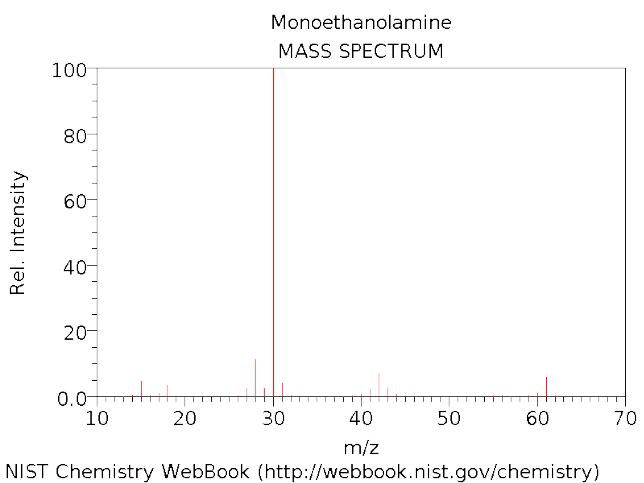
- •Масс-спектр н-декана
- ••Ионизация газообразной пробы может быть вызвана фотонами, ионами, электрическим полем, электронным ударом и
- ••Процесс ионизации и типы ионов
- ••Масс-анализаторы
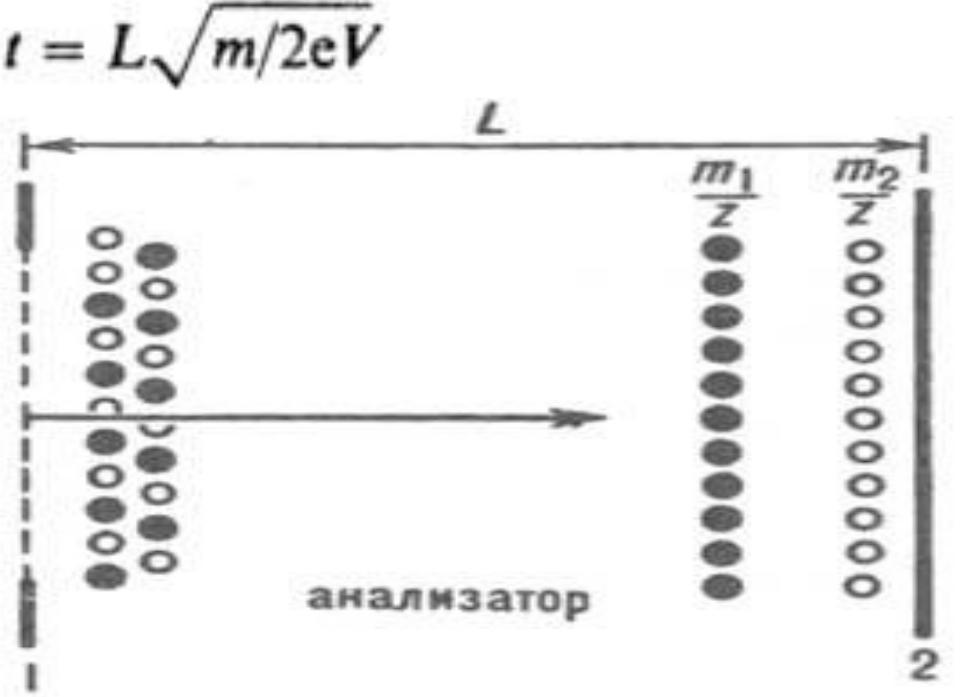
- ••Все масс-анализаторы используют физические законы движения заряженных частиц. Исторически первым масс-анализатором, остающимся непревзойденным
- ••Именно это используется для анализа ионов по массам. Для того, чтобы увеличить разрешение,
- ••Способность масс-спектрометра различать массы обычно выражается разрешением,
- •Схема масс-анализатора с однородным магн. полем: S1 и S2 - щели
- •Схема масс-анализатора с двойной фокусировкой: S1 и S2 - щели источника
- ••Квадруполь
- •Схема квадрупольного масс-анализатора: 1 - высокочастотный генератор; 2 - генератор постоянного напряжения; 3
- •Квадрупольный масс-спектрометр
- ••Ионы, влетающие параллельно оси этих стержней, попадают в гиперболическое поле и оно, в
- •Схема спектрометра ион-циклотронного резонанаса
- •Ионно-циклотронный резонанс
- •Циклотронно-резонансный масс-анализатор -ячейка в виде прямоугольного параллелепипеда или куба, помещенная в однородное магн.
- •Дальнейшее развитие квадрупольных анализаторов привело к созданию "ионной ловушки". Одна пара стержней была
- •В последнее время все большую популярность приобрели "времяпролетные" (Time Of Flight, TOF) масс-анализаторы.
- •(V - напряжение)
- •Одна из важнейших задач - нахождение зависимости между характером масс-спектра и строением исследуемой
- •Распространенность изотопов некоторых элементов
- •Некоторые масс-спектрометрические правила
- ••Пример масс-спектр трифторида фосфора PF3:
- •Примером установленных закономерностей фрагментации являются следующие схемы разрыва связей:
- •Определение парциального давления паров веществ
- •Определение константы равновесия химической реакции и теплоты реакции
- •Масс-спектромерия в химической кинетике
- ••Зачем нужна масс-спектрометрия
- ••Изотопная масс-спектрометрия углеродных
- ••Определение происхождения взрывчатых веществ помогает найти террористов, наркотиков - бороться с их распространением
- ••Ограничимся просто перечислением:

Схема спектрометра ион-циклотронного резонанаса
B
с = 2 /Т = еВ/m
T – период обращения иона,с – частота вращения иона,
B – индукция магнитного поля
Ионно-циклотронный резонанс
В этом анализаторе ионы влетают в сильное магнитное поле и вращаются там по циклическим орбитам (как в циклотроне, ускорителе элементарных частиц). Такой масс-анализатор обладает определенными преимуществами: имеет очень высокое разрешение, диапазон измеряемых масс весьма широк, может анализировать ионы, получаемые всеми способами. Однако, для своей работы он требует сильного магнитного поля, а значит, использования сильного магнита со сверхпроводящим соленойдом, поддерживаемым при очень низкой температуре (жидкого гелия, приблизительно - 270оС).
Циклотронно-резонансный масс-анализатор -ячейка в виде прямоугольного параллелепипеда или куба, помещенная в однородное магн. поле. Ионы, попадая в ячейку, движутся в ней по спиральной траектории (циклотронное движение) с частотой wц = 1/2pz.H/m, где H - напряженность магн. поля, т. е.
ионы с одинаковыми значениями m/z имеют определенную циклотронную частоту. Действие прибора основано на резонансном поглощении энергии ионами при совпадении частоты поля и циклотронной частоты ионов. На применении циклотронно-резонансного масс-анализатора основан метод ион-циклотронного резонанса, который используют для определения массы ионов, в частности мол. ионов, образующихся при ионно-молекулярных реакциях в газовой фазе; анализа структуры высокомолекулярных ионов; определения кислотно-основных св-в в-в. Для легких ионов R = 108. Первый масс-спектрометр ионциклотронного резонанса построен Г. Соммером, Г. Томасом и Дж. Хиплом (США, 1950).
Дальнейшее развитие квадрупольных анализаторов привело к созданию "ионной ловушки". Одна пара стержней была закручена в кольцо, а вторая пара превратилась в шарообразные чашки. Комбинация радиочастотных и постоянных напряжений, прикладываемых к электродам ионной ловушки, стала позволять удерживать ионы внутри нее или выбрасывать из нее. Внешний по отношению к масс- анализатору, ионный источник гарантирует отсутствие химической самоионизации, приводящей к искажению масс-спектров электронного удара и делает прибор гораздо более универсальным - можно анализировать отрицательные ионы, образующиеся при диссоциативном захвате электронов, можно использовать классический прямой ввод и т.д.
В последнее время все большую популярность приобрели "времяпролетные" (Time Of Flight, TOF) масс-анализаторы. В них ионы разгоняются электрическим полем, приобретают одинаковую не зависящую от массы кинетическую энергию и вылетают в бесполевое пространство.
При движении в этом пространство ионы имеют зависящую от массы скорость, определяемую известной формулой E=mv2/2, где Е-
кинетическая энергия ионов, м- масса иона, а v - его скорость. Они
разделятся пространстве и в разное время достигнут детектора, расположенного в конце бесполевого пространства.
Измерив время прихода на детектор, при известной длине бесполевого пространства можно определить их массу. С помощью этого анализатора можно измерять массы очень больших молекул (с массами в десятки и сотни тысяч атомных единиц).
В квадрупольных анализаторах большие молекулы не удается удерживать доступными электрическими полями. Магнитные анализаторы для ионов больших масс (больше 10 кило Дальтон) очень громоздки и требуют мощных источников тока и напряжения. Наиболее подходящим методом ионизации для времяпролетных масс-спектрометров оказался описанный выше MALDI (ионизация лазерной десорбцией из матрицы).
(V - напряжение)
Схема время-пролетного масс- анализатора: 1 - сетка; 2 - детектор.
Одна из важнейших задач - нахождение зависимости между характером масс-спектра и строением исследуемой орг. молекулы. При ионизации орг. молекулы образуется молекулярный ион, в котором далее происходят процессы гетеро- и гомолитического. разрыва связей или разрыва связей с перегруппировкой молекулы и образование осколочных ионов, которые в свою очередь могут подвергаться дальнейшему распаду. Последовательные распады ионов, устанавливаемые из масс-спектра, называются направлениями или путями распада. Направления распада - важная характеристика каждого класса соединений. Совокупность всех направлений распада составляет характерную для каждого органического соединения схему фрагментации. Если масс-спектр прост, схема фрагментации сводится к одному пути распада, например, при распаде молекулярного иона СН3ОН+
последовательно образуются ионы СН2=ОН+ и Н—С=О+. В случае сложных масс-спектров схема фрагментации отвечает

Распространенность изотопов некоторых элементов
 Элемент
Элемент
Водород
 Углерод
Углерод
Азот
 Кислород
Кислород
Фтор
 Кремний
Кремний
Фосфор
 Сера
Сера
Хлор Мышьяк
Селен
Бром
Теллур
Иод
Изотоп (распространенность в природе, %)
 1Н (99,985); 2H (0,015)
1Н (99,985); 2H (0,015)
(98,893); (1,107)
 14N (99,634); 15N (0,366)
14N (99,634); 15N (0,366)
16O (99,759); 17O (0,037); 18O (0,204)
 (100)
(100)
28Si (92,21); 29Si (4,70); 30Si (3,09)
 31P (100)
31P (100)
32S (95,0); 33S (0,75); 34S(4,22); 36S (0,02)  35Cl (75,77); 37Cl (24,23)
35Cl (75,77); 37Cl (24,23)
75As (100)
74Se (0,87); 76Se (9,02); 77Se (7,58); 78Se (23,52); 80Se (49,82); 82Se (9,19)
79Br (50,537); 81Br (49,463)
120Te (0,089); 122Te (2,46); 123Te (0,89); 124Te (4,74); 125Te (7,03); 126Te (18,72); 128Te (31,759); 130Te(34,27) 127I (100)
Некоторые масс-спектрометрические правила
•1. "Азотное правило". Большинство встречающихся в органических соединениях элементов имеют либо четную массу основных изотопов и четные валентности (C, O, S, Si, Ge, Pb и др.), либо нечетную массу и нечетные валентности (H, F, Cl, Br, I, As, Sb и др.). Поэтому М+. соединений, составленных из любых комбинаций этих элементов, имеют четную массу. Азот имеет четную массу и нечетную валентность.
•2. "Четно-электронное" правило. Ион-радикалы (нечетное число электронов) могут элиминировать или радикалы, или четно-электронные нейтральные молекулы, тогда как ионы (четное число электронов) могут терять лишь нейтральные четно-электронные частицы.
•Следует отметить, что это правило имеет довольно много исключений.
•3. Правило Стивенсона-Одье. При распаде молекул под действием электронного удара положительный заряд локализуется на фрагменте, который обладает наименьшей энергией ионизации.
•4. Затрудненный разрыв связей, принадлежащих к ненасыщенным системам.
Разрыв связей, прилежащих к винильной, этинильной или арильной группе, обычно затруднен вследствие очень низкой стабильности образующихся ненасыщенных ионов или радикалов (часто за подобные ионы принимают фрагменты продуктов перегруппировки молекулярных ионов).