
Тема 3 - Ферменты - лекция 1
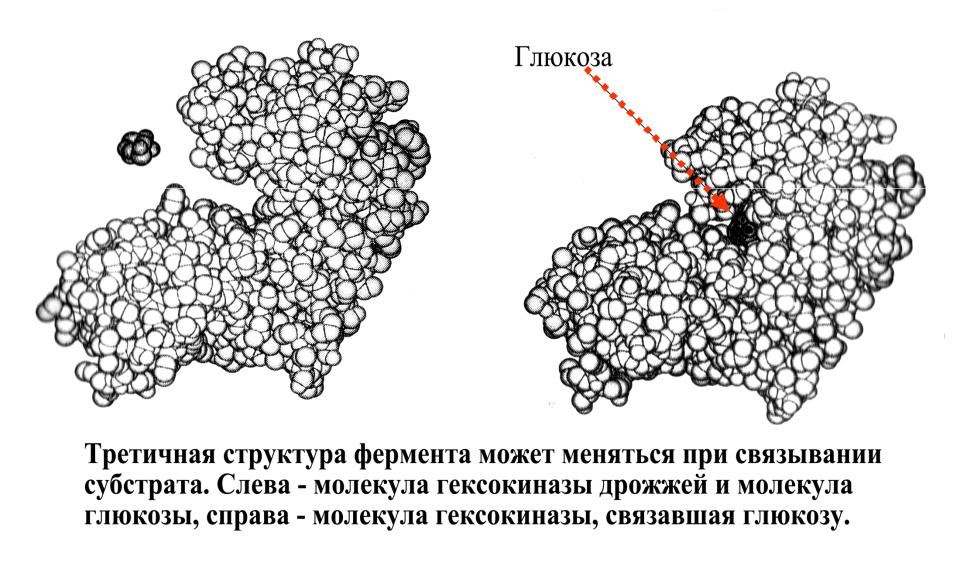
.pdfВзаимодействие субстрата и фермента согласно модели «индуцированного соответствия»:
При связывании субстрата происходит изменение формы фермента. Активный центр фермента становится пространственно комплиментарным субстрату только после связывания субстрата.
Важно, что активный центр может изменить свою форму только строго определенным образом. Активный центр не может изменить свою конформацию так, чтобы быть комплиментарным веществам, отличным от своего субстрата.
Кинетика ферментативных реакций
Уравнение Михаэлиса-Ментен
Основная предпосылка:
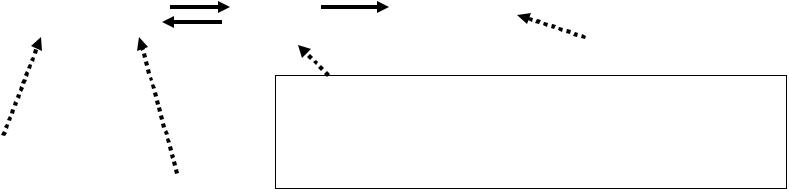
Образование фермент-субстратного комплекса – необходимый промежуточный этап катализа. Скорость реакции пропорциональна концентрации фермент-субстратных комплексов.
E + S k1 ES k3 E + P
k2
Продукт
Фермент-субстратный Фермент комплекс
Субстрат

k1 |
k3 |
E + S |
ES E + P |
k2 |
|
Исходя из приведенного уравнения реакции, при некоторых допущениях можно вывести формулу для зависимости скорости ферментативной реакции от концентрации субстрата (при постоянной концентрации фермента). При этом удобно ввести новую константу KM , называемую константой
Михаэлиса:
KM = k2 + k3 k1
Выведенное уравнение выглядит следующим образом:
V =Vmax • |
[S] |
Уравнение |
|
|
Михаэлиса- |
||
|
|||
[S]+ KM |
|||
Ментен |
|||
|
|
||
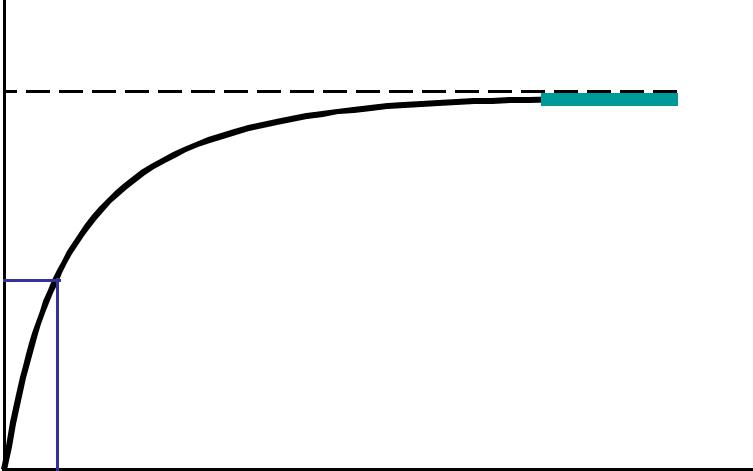
Зависимость скорости ферментативной реакции от концентрации субстрата
Начальная скорость
Vферментативной реакции (скорость измеряемая в период, когда израсходована очень малая доля субстрата)
Vmax
Насыщение
субстратом
Vmax / 2
Концентрация
субстрата
KM |
[S] |
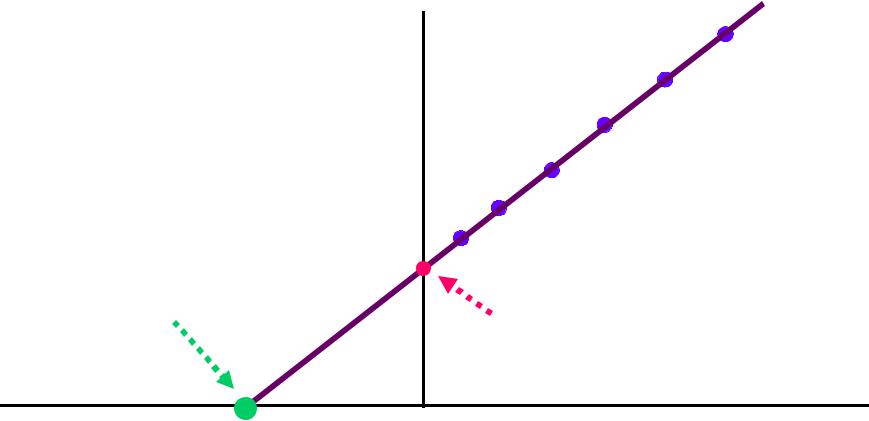
При графическом отображении зависимости скорости реакции от концентрации субстрата удобнее использовать обратные величины:
1/V
-1/KM
1/VMAX
1/[S]
