
- •Алициклические углеводороды или циклоалканы
- •1. Определения, классификация.
- •2. Номенклатура.
- •3. Изомерия.
- •4. Напряжение циклов, конформации.
- •5. Способы получения.
- •5.1. Общие
- •5.2. Специальные
- •6. Физические свойства
- •7. Химические свойства
- •7.1. Гидрирование (восстановление)
- •7.2. Гидрогалогенирование и действие минеральных кислот
- •7.3. Галогенирование.
- •7.4. Окисление.
- •8. Непредельные алициклические соединения.
Алициклические углеводороды или циклоалканы
Схема лекции.
1. Определения, классификация
2. Номенклатура.
3. Изомерия.
4. Напряжение циклов, конформации.
5. Способы получения.
5.1. Общие.
5.2. Специальные.
6. Физические свойства.
7. Химические свойства.
7.1. Гидрирование (восстановление).
7.2. Гидрогалогенирование.
7.3. Галогенирование.
7.4. Окисление.
8. Непредельные алициклические соединения.
1. Определения, классификация.
Определения:Углеводороды, имеющие замкнутую цепь атомов углерода, включающую атомы углерода в состоянии sp3-, sp2- и sp-гибридизации, называются алициклическими углеводородами. Среди них наиболее распространенными являются углеводороды, замкнутая цепь которых построена только из атомов углерода в состоянии sp3-гибридизации. Такие алициклические углеводороды называются циклоалканами.
Циклоалканы имеют общую формулу СnН2n.
Циклоалканы классифицируются:
- по числу атомов углерода в цикле;
- по числу циклов в молекуле;
- по способу соединения циклов, если их в молекуле несколько.
По числу атомов в цикле различают малые циклы, включающие три- четыре атома углерода (С3– С4), обычные – С5 - С7, средние – С8 - С11и макроциклы (12 и более атомов углерода).
По числу циклов в молекуле различают моноциклические, бициклические и полициклические.
По способу соединения циклов различают спироалканы и мостиковые соединения. В молекуле спироалканов имеется один общий (узловой) атом углерода:

Схема 1.Примеры структурных формул спироалканов.
В молекуле мостиковых соединений два цикла имеются два и более общих атомов углерода:

Схема 2.Примеры структурных формул мостиковых соединений.
2. Номенклатура.
По номенклатуре ИЮПАК названия циклических соединений строятся подобно наименованиям соединений жирного ряда с добавлением приставки «цикло-» при этом часто при изображении циклических структур символы атомов углерода и водорода опускают:

Схема 3.Примеры структурных формул циклических структур.
Если в цикле несколько заместителей, то проводится нумерация атомов углерода в цикле таким образом, чтобы сумма номеров углеродных атомов, где имеются заместители получилась минимальной. Одно- и двухвалентные радикалы, образованные из циклических углеводородов, называются аналогично радикалам ациклических углеводородов:

Схема 4.Примеры структурных формул одновалентные циклических радикалов.
Название спироалкана образуют от названия соответствующего алкана; цифрами в квадратных скобках указывают, сколько атомов углерода находится по каждую сторону от узлового атома углерода. Нумерацию атомов в молекуле спироалкана начинают с меньшего цикла от атома, соседнего с узловым.
В названии мостикового соединения в квадратных скобках указывают числа атомов углерода в цепочках, которые связывают узловые атомы. Нумерацию начинают с узлового атома в в сторону другого узлового атома по большей цепочке.
3. Изомерия.
Структурная изомерия циклоплканов обусловлена размером цикла, а для дизамещенных алканов также расположением заместителей относительно друг друга. Соответственно возможны три вида изомеров:
1. По числу углеродных атомов в кольце:

Схема 5.Примеры изомеров по числу углеродных атомов в кольце.
2. По числу углеродных атомов в заместителях:

Схема 6.Примеры изомеров по числу углеродных атомов в заместителях.
3. По расположению заместителей в кольце:

Схема 7.Примеры изомеров по расположению заместителей в кольце.
При наличии двух заместителей возможна геометрическая и оптическая изомерия. Два заместителя по разные стороны плоскости цикла образуют транс-изомер, а два заместителя по одну сторону плоскости цикла образуютцис-изомер:
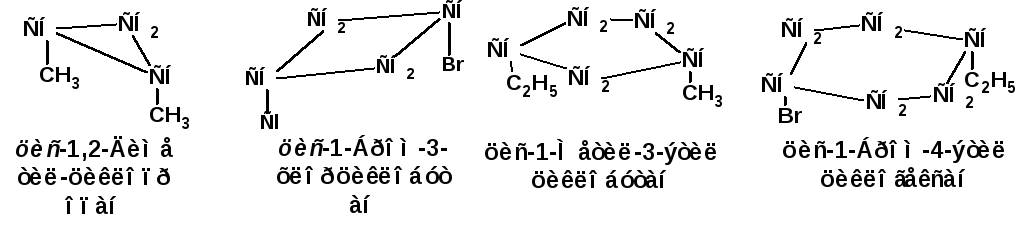
Схема 8.Примеры цис-, транс-изомеров.
Геометрическая (цис-,транс-изомерия)изомерия наблюдается при всех положения заместителей, кроме геминального (заместители у одного углеродного атома). Геометрические изомеры в алициклическом ряду очень устойчивы, поскольку изомеризация одного геометрического изомера в другой требует разрыва цикла и последующего его замыкания или разрыва связи углеродного атома цикла с заместителем и образования новой связи с другой стороны плоскости цикла.
Оптическая изомерия проявляется в том случае, если молекула не имеет плоскости симметрии. В циклогексановом ряду это, например, наблюдается при 1,2- и 1,3-транс-положениях заместителей:

Схема 8.Примеры оптических изомеров.
