
- •Лекция 8 полициклические ароматические углеводороды
- •1. Полициклические ароматические углеводороды с изолированными циклами
- •1.1. Группа бифенила
- •1.2. Полифенилметаны
- •2. Конденсированные бензоидные углеводороды
- •2.1. Нафталин
- •2.2. Антрацен, фенантрен
- •3. Гетероциклические соединения.
- •3.1. Классификация и номенклатура
- •3.2. Способы получения пятичленных циклов
- •3.3. Химические свойства пятичленных циклов
- •3.4. Способы получения шестичленных циклов (пиридин)
- •3.5. Химические свойства шестичленных циклов (пиридин)
3.3. Химические свойства пятичленных циклов
Фуран, пиррол и тиофен – бесцветные жидкости. Температура их кипения выше, чем у соответствующих, по числу углеродных атомов, соединений жирного ряда.
Химические свойства пятичленных гетероциклов определяются присутствием двойных связей, ароматического цикла и гетероатома.
Мы рассмотрим следующие свойства:
Кислотно-основные превращения с участием гетероатома;
Реакции присоединения;
Реакции замещения.
Кислотно-основные превращения.
У фурана и пиррола при действии кислот разрывается цикл и образующийся алкадиен полимеризуется. Тиофен в отличие от фурана и тиофена устойчив к действию кислот.
Фуран и тиофен устойчивы к действию щелочей и щелочных металлов. Пирролл является слабой кислотой рК = 14.3. Сплавлением пиррола с едким кали можно получить пирролкалий:

Реакции присоединения.
Пятичленные гетероциклы будучи ненасыщенными соединениями присоединяют водород, но это присоединение происходит в различных условиях:

Присоединение галогенов:
При низкой температуре присоединяются к фурану. Продукты присоединения легко отщепляют галогеноводород и образуют α-галогенфуран:

Фуран и пиррол реагируют с малеиновым ангидридом. При этом фуран образует аддукт:

Пиррол образует продукт замещения:

Тиофен реагирует только с высоко реакционноспособными диенофилами. Причем образующиеся аддукты отщепляют серу.
Окисление.
В жестких условиях фуран и пиррол окисляются с раскрытием цикла и полимеризацей образующегося диена.
При окислении в мягких условиях фуран образует малеиновый ангидрид, а пиррол имид малеиновой кислоты:

Тиофен очень плохо поддается окислению.
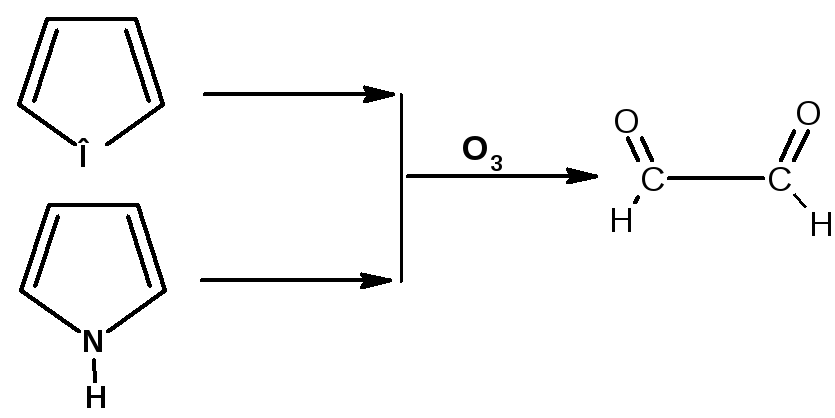
Озонолиз
Фуран и пиррол подвергаются озонолизу. Продуктом озонолиза является глиоксаль:
Реакции замещения
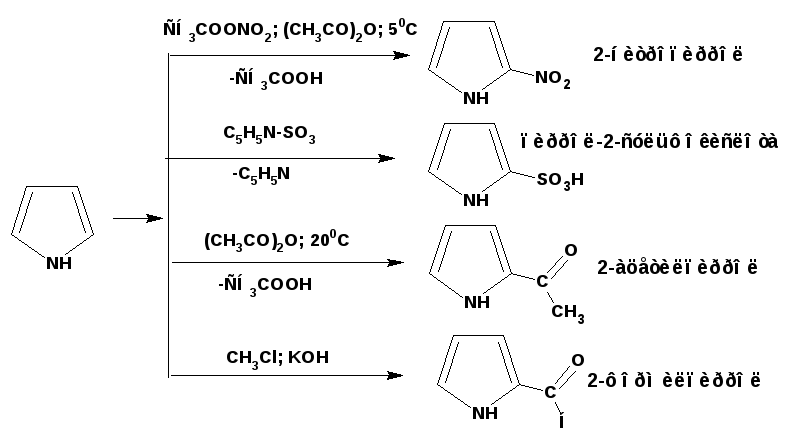
Фуран, пиррол и тиофен вступают в реакции электрофильного замещения – обычные для ароматических углеводородов. Причем реакционная способность этих соединений выше чем у бензола. (Почему?).
Замещение во всех случаях проходит в α-положение. Если α-положение занято, то реакция идет в β- положение. Такое направление обусловлено электронодонорными свойствами (положительным мезомерным эффектом гетероатома, ориентант I рода):

связи с повышенной чувствительностью пятичленных гетероароматических соединений к сильным кислотам, то применяют модифицированные электрофильные реагенты, при использовании которых исключается сильнокислая среда:

С использованием этих реагентов реакции идут в мягких условиях с хорошими выходами:


3.4. Способы получения шестичленных циклов (пиридин)
В промышленных маштабах пиридин и его производные долгое время получали из каменноугольной смолы.
Синтетические способы получения пиридина основаны на конденсации карбонильных соединений с аммиаком:
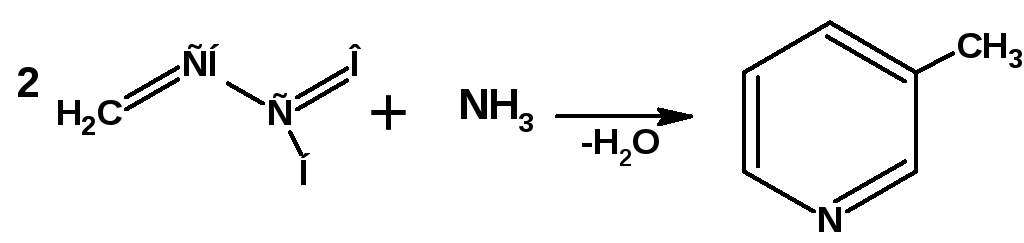

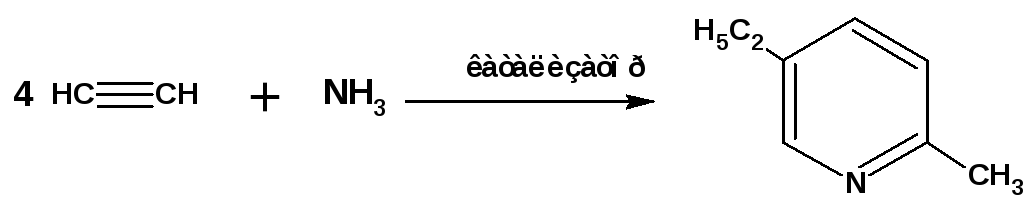
Из ацетилена и аммиака в присутствии никелевого катализатора образуются производные пиридина:
3.5. Химические свойства шестичленных циклов (пиридин)
Пиридин и его ближайшие гомологи являются бесцветными жидкостями с резким неприятным запахом. Растворимы в воде.
Пиридин вступает в реакции присоединения, замещения, реагирует как третичный амин и способен раскрывать цикл.
Основные свойства.
Свойства основания
Поскольку неподеленная электронная пара пиридина исключена из цепи сопряжения, то в отличии от пиррола, пиридин является основанием. Способен взаимодействовать с кислотами. При этом образуются соли, что характеризует пиридин как третичный амин:
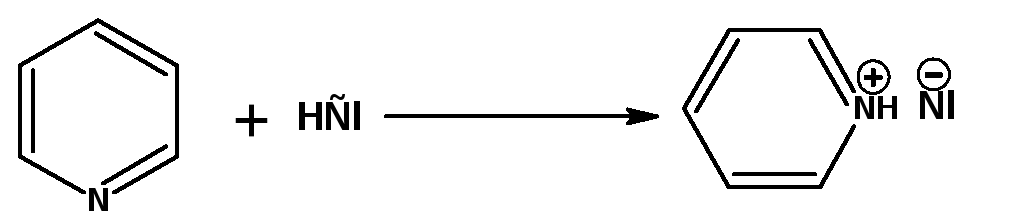
Реакции присоединения.
Пиридин является ненасыщенным соединением, поэтому способен присоединять водород. При каталитическом гидрировании пиридин с раскрытием цикла образует амиламин:

Реакции с раскрытием цикла:

Реакции замещения.
В цикле пиридина присутствует двойная связь N=С. Данная группа обладае отрицательным индуктивным и мезомерным эффектов, что характерно для ориентантов второго рода:

Стрелки, характеризующие действие мезомерного эффекта указывают, что атака электрофильным реагентом должна направляться в β-положение. Кроме того, схема показывает, что пиридин способен к реакциям нуклеофиольного замещения. Причем атака нуклеофильного реагента должна быть направлена в α-положение.
Электрофильное замещение протекает в соответствии с приведенной схемой. Причем дезактивирующее действие связи N=С приводит к тому, что реакции идут медленно и в жестких условиях:
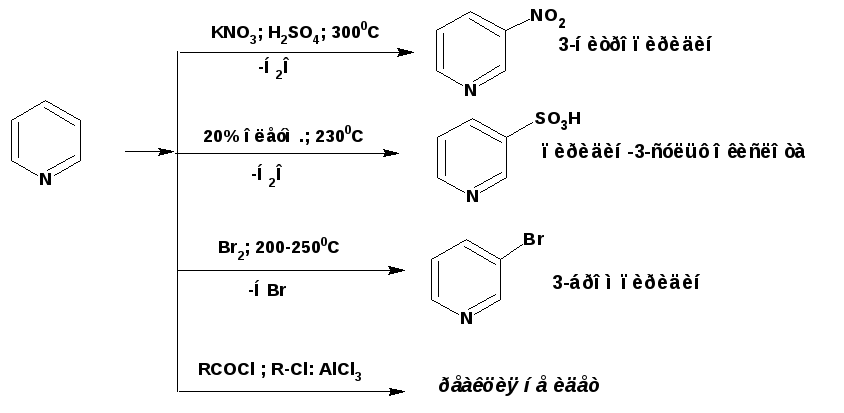
Обеднение электронной плотностью пиридинового кольца, затрудняющие электрофильное замещение, облегчает нуклеофильное замещение.
При нагревании пиридина с амидом натрия в среде NN-диметиланилина или толуола образуется 2-аминопиридин. Реакция носит имя Чичибабина:

При действии паров пиридина на сухое едкое кали при 250-3000С образуется 2-гидроксипиридин:

Пиридиновое кольцо входит во многое физиологически активные вещества. В частности:
Никотиновая кислота:
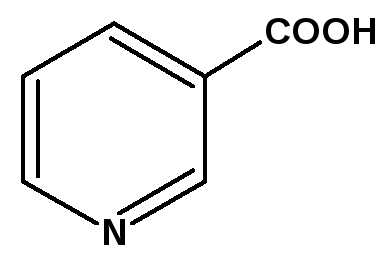
Никотиновую кислоту получают окисляя алкалоиды никотин или анабазин:

Амид никотиновой кислоты – никотинамид:

является витамином РР. Нехватка витамина РР вызывает заболевание пеллагру.
Диэтиламид никотиновой кислоты применяется как возбуждающее сердечную деятельность средство под названием кордиамин:

